运动和PI3K阻断剂对大鼠骨骼肌mT OR及下游信号的作用研究
曾凡星,朱 晗,赵 华,欧阳芡
(1.北京体育大学运动人体科学学院,北京100084;2.天水师范学院体育学院,甘肃天水741001)
运动和PI3K阻断剂对大鼠骨骼肌mT OR及下游信号的作用研究
曾凡星1,朱 晗1,赵 华2,欧阳芡1
(1.北京体育大学运动人体科学学院,北京100084;2.天水师范学院体育学院,甘肃天水741001)
目的:通过观察一周注射PI3K阻断剂和跑台运动对mTOR及其下游信号的影响,深入探讨PI3K对运动骨骼肌蛋白合成信号的机理。方法:8周龄雄性SD鼠在适应性训练后分为四组:安静组(S)、阻断剂组(SL)、运动组(E)、运动+阻断剂组(EL),每组6只。运动方式为跑台运动(坡度为10%,跑速20m/min,60min),每天一次,共7天。腹腔注射外源性LY294002。用Western Blotting法检测腓肠肌MHC、mTOR(Ser2448)、p70S6K(Thr389)和4EBP1(Thr37/46)的磷酸化表达。结果:在一周后,LY294002明显抑制MHC,运动有促进的趋势,并减弱LY294002对MHC的抑制效应。LY294002显著抑制mTOR(Ser2448)、p70S6K(Thr 389)和4EBP1(Thr 37/46)的磷酸化表达,而运动明显增强其表达。外源性LY294002和运动因素间存在交互效应,LY294002减弱运动对此通路的促进效应。结论:1)一周外源性PI3K阻断剂注射明显抑制mTOR及下游信号,并能显著抑制运动所引起的蛋白促合成效应。2)mTOR的两个下游信号对运动均较敏感,但4EBP1对PI3K阻断剂的反应较为迟钝。
PI3K;LY294002;mTOR通路;骨骼肌肥大;运动
骨骼肌蛋白质代谢是机体在运动训练适应过程中的关键环节,目前对这种适应机制的研究主要关注于骨骼肌内细胞信号转导的调控。研究证实,运动促进骨骼肌肥大过程的主要合成信号通路为PI3K/Akt/mTOR通路[1]。前期研究发现,运动可以有效地增强mTOR及下游信号的磷酸化反应。但使用在体阻断骨骼肌PI3K信号结合运动研究mTOR及下游信号鲜见。以mTOR及其下游信号(p70S6K和4EBP1)为着眼点,观察该通路在注射一周PI3K阻断剂的耐力运动模型中的变化特征及与蛋白合成的关系,研究PI3K对运动骨骼肌蛋白合成的调控机理。
1 材料与方法
1.1 研究对象与分组
健康雄性、SPF级8周龄SD大鼠,体重(177.8±5.4)g,由北京维通利华实验动物技术有限公司提供。国家标准啮齿类动物饲料,分笼饲养,4只/笼。自由饮食,温度维持在22℃~24℃,相对湿度50%~65%。昼夜节律人工控制光照(光照时间为8∶00~20∶00)。
在适应性训练后,动物经体重分层后随机分为四组:安静组(S)、阻断剂组(SL)、运动组(E)、运动+阻断剂组(EL),每组6只。各组体重在正式分组前无组间差异。
1.2 动物运动方案
正式训练前,动物在跑台上进行4天的适应性训练,之后休息3天。适应性训练方案见表1。

表1 动物适应性训练方案
正式实验共7天,安静组常规饲养,运动组进行7天的运动,运动方案为上坡跑(坡度为10%)、速度20m/min,每天训练60min(根据Bedford经验公式,相当于75%VO2max)[2]。运动时间为每日上午8∶00~9∶00。
1.3 LY294002注射方案
LY294002(购自Cayman ChemicalCompany公司,产品批次为0400072-24)为PI3K的特异性阻断剂[3],采用大鼠腹腔注射。每天运动后即刻,SL和EL组在大鼠腹腔注射LY294002。其他组注射同等剂量的安慰剂。具体剂量安排如表2。

表2 LY294002注射剂量安排表
1.4 测试样本采集与处理
取材前禁水禁食12h,以0.3mL/100g为剂量,腹腔注射10%水合氯醛麻醉。麻醉后腹主动脉取血,然后速取后肢腓肠肌。接着用生理盐水将其洗净,剔除肌腱及筋膜组织,用干净滤纸将其吸干,用锡纸将其包裹后迅速投入液氮,而后置于-80℃冰箱保存待测。
1.5 指标测试方法
1.5.1 提取蛋白 匀浆缓冲液的配制:取R IPA裂解液100mL,分别加入蛋白酶抑制剂和蛋白磷酸酶抑制剂(Roche公司)各10片,最后取100mM PMSF 1000μL加入。PMSF于临用前数分钟加入。于匀浆前新鲜配制。
用精密天平称取腓肠肌120mg,用眼科剪迅速剪碎,按1∶10比例向玻璃匀浆器中加入预冷的裂解液,再在冰水浴中进行匀浆,直至没有肉眼可视的悬浮物。将组织匀浆液倒入1.5mL EP管中,静置10min。于4℃,12 000g,10min离心,取上清液,分装后保存于-80℃待测。
1.5.2 蛋白浓度测试法(Bradford) 配制Bradford工作液:按照《精编分子生物学实验指南》配制[4]。标准曲线制备:用1 mg/mL BSA标准蛋白分配制0、10、20、40、60、80、100ug梯度。加入5mL Bradford工作液,用旋涡混匀器混匀后静置5min。测A595nm。制作标准曲线后,再分批次测试样品浓度。
1.5.3 Western Blot测试 Tris-甘氨酸电泳缓冲液、上样缓冲液、电转液、堆积胶和分离胶的配制均参照《Current protocols in protein science》实验方法[5],TBS、TBST、封闭液按照Cell Signaling抗体说明书的要求配制。
取100μg总蛋白配制成上样体系,置95℃沸水中5min,再于4℃中冷却,上样前以3 000rpm离心5min。配制分离胶6%(MHC、mTOR)、8%(Actin、p70S6K)、10%(β-actin)或16.5%(4EBP1)以及5%浓缩胶。浓缩胶用80V恒压,分离胶换120V恒压电泳。再用半干转将蛋白转到NC膜上,以恒压20V半干转。封闭90min后用加入一抗,不同抗体稀释比例分别为β-actin(购自Santa Cruz公司)为1:500,FastMyosin Skeletal Heavy chain antibody[MY-32](Abcam公司)为1∶2000,Phospho-mTOR(Ser2448)(Cell Signaling公司)为1∶800,Phospho-p70S6K(Thr389)(Cell Signaling公司)为1∶1200,Phospho-4E-BP1(Thr37/46)(Cell Signaling公司)为1∶800,然后4℃孵育过夜。次日晨用TBST洗膜后用不同浓度二抗室温孵育60min。用ECL发光试剂与膜在暗室中反应、曝光。曝光底片用凝胶成像系统的透光拍照,用Quantity One图像分析系统分析。将每个条带与相应样品的β-actin条带光密度值进行比较,计算出目的条带的相对含量值。
1.6 数据统计方法
对实验检测结果的数据处理运用SPSS 13.0软件。组间比较采用双因素方差分析(UN IANOVA)和单因素方差分析(One-Way ANOVA)。对观测点的组间多重比较(Post Hoc)采用LSD或Tamhane’s T2方法分析。显著性检验水平以P<0.05表示具有显著性差异,P<0.01表示具有非常显著性差异。
2 结果
在一周的实验后,分别测得各个实验动物组腓肠肌的MHC和mT OR及其下游信号表达值,具体实验结果见表3、图1。

表3 LY294002和运动干预下大鼠M HC和mTOR及下游信号表达值(相对含量)
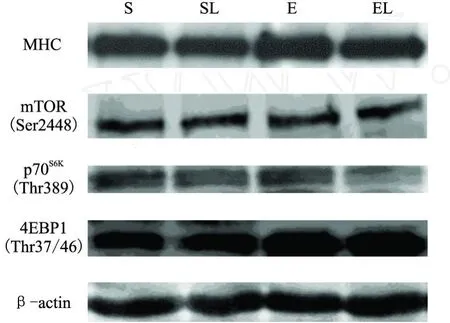
在一周后,LY294002(F=10.305,P<0.01)明显抑制MHC,运动(F=2.388,P>0.05)有促进的趋势,并减弱LY294002对MHC的抑制效应。LY294002显著抑制mTOR(Ser2448)(F=25.342,P<0.01)、p70S6K(Thr389)(F=38.083,P<0.01)和4EBP1(Thr37/46)(F=3.455,P<0.05)的磷酸化表达,而运动明显增强表达。外源性LY294002和运动因素间存在交互效应,运动减弱LY294002对此通路的抑制效应。具体表现为S组和E组的MHC均显著高于SL组(分别为17.6%和20%)。E组的mTOR(Ser2448)磷酸化显著高于SL组和EL组(分别为32.9%和22.8%)。S组和E组的p70S6K(Thr389)磷酸化均显著高于SL组(分别为25%和52.5%),EL组显著高于SL组(20%)。E组的4EBP1(Thr37/46)磷酸化显著高于S组、SL组和EL组(分别为34%、36.7%和15.5%)(图1)。
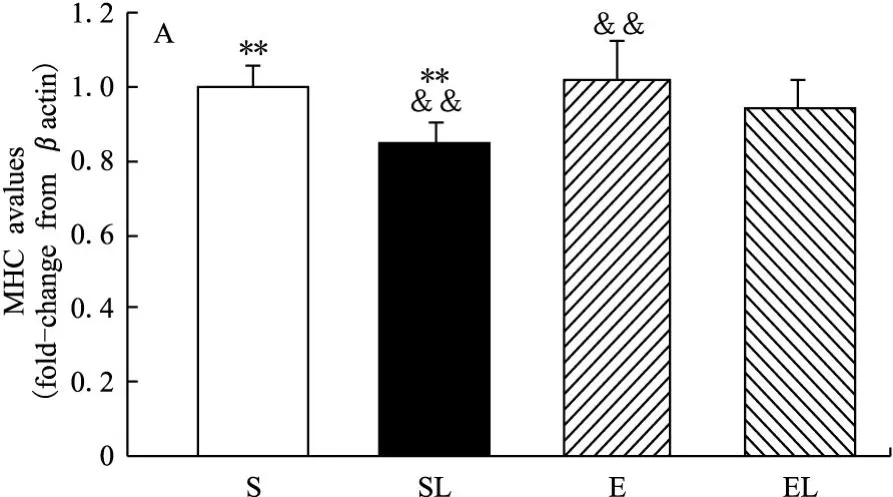


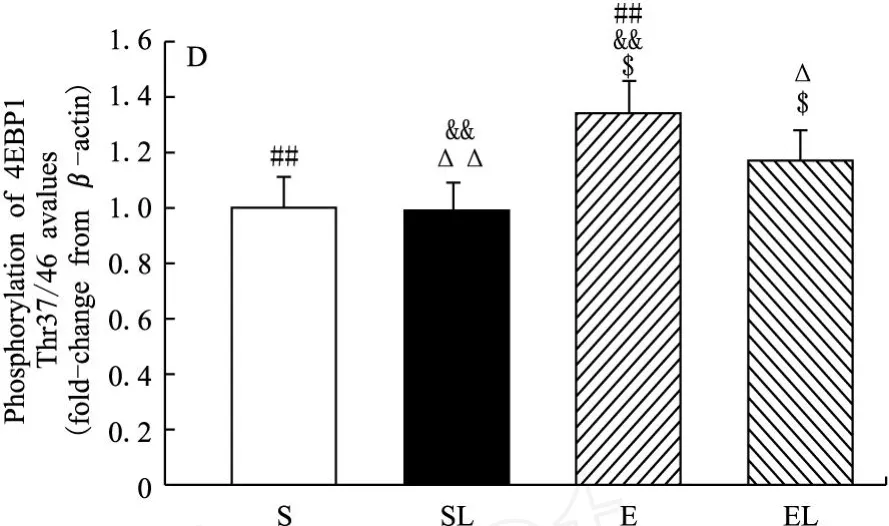
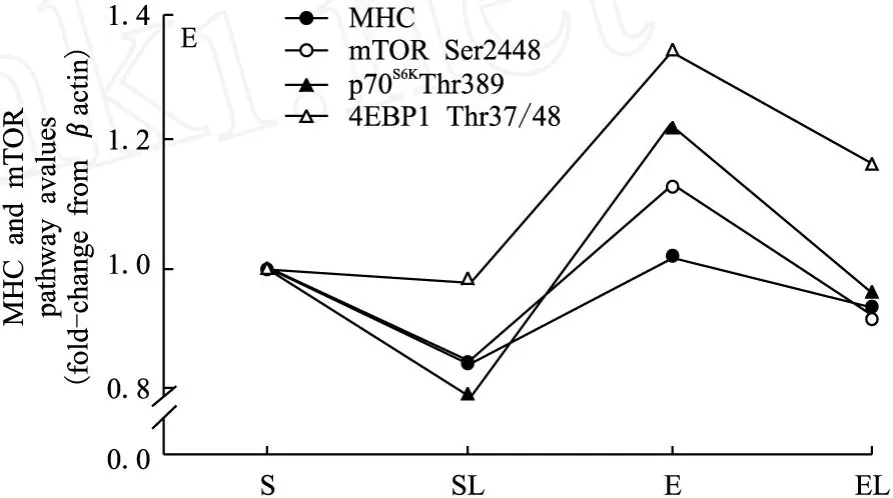
图1 LY294002和运动干预下大鼠腓肠肌M HC和mTOR及其下游信号表达图
3 讨论
3.1 PI3K阻断剂对运动骨骼肌蛋白合成的影响
PI3K为IGF-I发挥促合成效应信号中非常重要的一个信号。PI3K在受其上游信号如生长因子、胰岛素等激活后[6-7],其在细胞膜上将二磷脂酰肌醇(PIP2)转化为三磷脂酰肌醇(PIP3),然后以PIP3作为第二信使启动下游的蛋白[8]。对PI3K信号的阻断,能够很大程度地影响位于其下游的Akt和mTOR信号[9]。因而形成IGI-I/PI3K/Akt/mTOR通路,影响机体的蛋白质代谢过程。在该通路中的mTOR信号分子及其下游信号是肌肉肥大过程中的关键因子。Bodine(2001)等[1]发现使用mTOR信号分子的特异性阻断剂——雷帕霉素,能阻断95%的肌肉肥大效应。
LY294002为PI3K的特异性抑制剂,它能抑制PI3K家族的活性,这种抑制效应呈一定的剂量依赖[3]。研究实验所取材组织为腓肠肌,为典型的以快肌纤维为主的肌肉,其MHCIIb型达到约90%,IId/x型约10%[10]。本研究测试的MHC为快肌型。研究结果显示,一周跑台运动具有促进腓肠肌MHC增加的趋势(P>0.05),LY294002明显抑制MHC(P<0.01),并明显抑制运动对MHC的促进效应。MHC的减少意味着肌肉收缩蛋白的丢失。PI3K阻断剂能抑制肌肉收缩蛋白的合成,并能显著抑制运动所引起的促合成效应。
3.2 PI3K阻断剂对运动骨骼肌mTOR及下游信号的影响
mTOR的促合成效应主要是通过对p70S6K和4EBP1的磷酸化来实现的。mTOR的下游信号p70S6K磷酸化后,能促进5’TOPmRNA翻译,提高mRNA的翻译能力[11,12];另外一个下游信号4EBP1磷酸化后可调节eIF4E的活性,来提高翻译的起始效率,从而促进翻译的起始和延伸过程,增加蛋白合成[13],最终导致骨骼肌肥大。mTOR的这两种下游信号能被雷帕霉素所阻断,并能在离体情况下被重组mTOR所激活[14,15]。Fujita等[16]发现促人体合成的营养素能敏感地被mTOR所感受到,引发一个迅速地和有效地通过加强翻译的起始和延伸过程(mTOR、p70S6K、4EBP1磷酸化均显著增加),来促进人骨骼肌蛋白的合成。在体情况下,由Akt/mTOR通路所激活的基因能充分地引起肌肉肥大,阻止肌肉萎缩;而它们的阻断剂能阻断在体情况下的肌肉肥大。本研究发现,一周注射LY294002能够使mTOR(Ser2448)蛋白磷酸化水平显著抑制约15%。
p70S6K参与mRNA转录的起始过程,它被认为是这一过程所必需的[12]。虽然这些转录仅为100到200个基因,但他们能编码细胞mRNA的20%。这些编码的产物有核糖体蛋白、延长因子等,这些都是蛋白质生物合成的基因,p70S6K调控着翻译组件的生物合成[17]。它可以磷酸化调节mRNA翻译过程中的至少3种蛋白,包括elF4B、核糖体蛋白S6和真核翻译延伸因子eEF2。其Thr389位点的磷酸化是p70S6K被激活的标志。本研究发现,一周注射LY294002能使p70S6K(Thr389)蛋白磷酸化水平显著抑制约20%。
4EBP1即eIF4E结合蛋白,又称PHAS1。真核细胞mRNA翻译的有效起始依赖于eIF-4F复合体,后者由eIF-4E、eIF-4A、eIF-4G组成。eIF-4E和eIF-4G的活性被eIF-4E结合蛋白——4EBP所抑制。4EBP1能抑制翻译起始所必需的帽子结构,进而控制翻译过程[18]。Gregory[14]HEK293细胞的鼠PHAS-1基因进行转染,或者用野生型mTOR,或者用雷帕霉素抵抗型mTOR的基因突变,发现不管是在体还是离体,4EBP1激酶的活性受到mTOR功能的直接影响。本研究发现,一周注射LY294002能使4EBP1(Thr37/46)蛋白磷酸化水平显著抑制约2%。
本研究显示,一周的实验后,mTOR及其两个重要下游信号p70S6K和4EBP1的活性均表现出明显抑制,且变化趋势相似。在mTOR活性表达有一定抑制后,位于其下游的p70S6K和4EBP1的活性均有更为显著的变化。这些结果提示LY294002通过抑制PI3K后,通过mTOR作用于其下游信号p70S6K和4EBP1,从而对蛋白质合成的关键环节——翻译过程产生抑制效应。
通过前期的研究,本研究所选用的模型为具有抗阻效应的跑台练习[19,20]。实验结果显示,LY294002显著抑制mTOR(Ser2448)(P<0.01)、p70S6K(Thr389)(P<0.01)和4EBP1(Thr37/46)(P<0.05)的磷酸化表达,而运动明显增强其表达。外源性LY294002和运动因素间存在交互效应,运动减弱LY294002对此通路的抑制效应。
3.3 PI3K阻断剂和运动对骨骼肌mTOR及下游信号影响
研究结果表明,PI3K阻断剂抑制骨骼肌蛋白合成,运动促进其蛋白合成,且能减弱PI3K阻断剂对MHC的抑制效应。表现为一周的实验后,LY294002明显抑制MHC,运动有促进的趋势,并减弱LY294002对MHC的抑制效应。此外,运动和LY294002对运动骨骼肌mTOR及其下游信号影响的侧重点有所不同。如实验结果所显示,LY294002对该通路的影响是整体性的,通过对PI3K的直接抑制,而使其下游信号受到相当的影响。本研究结果显示,在阻断PI3K后,4EBP1活性的变化并不明显,只有2%的降低;而对运动则更为敏感,有34%的升高。而p70S6K则表现出对二者均相当敏感。对PI3K的阻断,可使p70S6K有20%的降低;而相对于运动,则有22%的升高。而mTOR信号的变化幅度基本小于其下游信号的变化,对PI3K阻断剂和运动分别有15%的降低和13%的升高。显示出mTOR作为始动因素,其下游信号随之发生相应的变化。mTOR的两个下游信号对运动均较敏感,但4EBP1对PI3K阻断剂的反应似乎较为迟钝。
4 结论
1)一周外源性PI3K阻断剂注射明显抑制mTOR及下游信号,并能显著抑制运动所引起的蛋白促合成效应。
2)mTOR的两个下游信号对运动均较敏感,但4EBP1对PI3K阻断剂的反应较为迟钝。
[1]Bodine S C,Stitt T N,GonzalezM,et al.Akt/mTOR pathway is a crucial regulator of skeletal muscle hypertrophy and can prevent muscle atrophy in vivo[J].Nat Cell Biol,2001,11(3):1014-1019.
[2]Bedford T G,Tipton CM,W ilson N C,et al.Maximum oxygen consumption of rats and its changes with various experimental procedures[J].J Appl Physiol,1979,47(6):1278-1283.
[3]Gharbi S I,ZvelebilM J,Shuttleworth S J,et al.Exploring the specificity of the PI3K family inhibitor LY294002[J].Biochem J,2007,404(1):15-21.
[4]奥斯伯.新编分子生物学实验指南[M].北京:科学出版社,2005:80-250.
[5]Coligan J E,Dunn B M,Speicher D W,et al.Current Protocols in Protein Science[M].Washington:JohnW iley&Sons,Inc.,2003:1403-1540.
[6]Shavlakadze T,Chai J,Maley K,et al.A growth stimulus is needed for IGF-1 to induce skeletalmuscle hypertrophy in vivo[J].J Cell Sci,2010,123(Pt 6):960-971.
[7]W itkowski S,Lovering R M,Spangenburg E E.High-frequency electrically stimulated skeletal muscle contractions increase p70S6Kphosphorylation independent of known IGF-I sensitive signaling pathways[J].FEBSLett,2010,584(13):2891-2895.
[8]Barnett S F,LedderL M,Stirdivant SM,et al.Interfacial catalysis by phosphoinositide 3’-hydroxykinase[J].Biochemistry,1995,34:14254-14262.
[9]AokiM,Blazek E,Vogt P K.A role of the kinase mTOR in cellular transformation induced by the oncoproteins P3k and Akt[J].Proc NatlAcad SciU SA,2001,98(1):136-141.
[10]Hamalainen N,Pette D.The histochemical profiles of fast fiber types I IB,I ID,and I IA in skeletalmuscles ofmouse,rat,and rabbit[J].J Histochem Cytochem,1993,41(5):733-743.
[11]赵 华,曾凡星,张 漓.4周低氧运动对骨骼肌mTOR/p70S6K通路的时程影响[J].体育科学,2010,30(1):51-61.
[12]Ruvinsky I,Meyuhas O.Ribosomal protein S6 phosphorylation:from protein synthesis to cell size[J].Trends Biochem Sci,2006,31(6):342-348.
[13]Mayhew D L,Kim J S,Cross J M,et al.Translational Signaling Responses Preceding Resistance Training-Mediated Myofiber Hypertrophy in Young and Old Humans[J].J Appl Physiol,2009,107(5):1655-1662.
[14]Brunn G J,Hudson C C,Sekulic A,et al.Phosphorylation of the translational repressor PHAS-I by the mammalian target of rapamycin[J].Science,1997,277(5322):99-101.
[15]Burnett P E,Barrow R K,Cohen N A,et al.RAFT1 phosphorylation of the translational regulators p70 S6 kinase and 4E-BP1[J].Proc NatlAcad SciU SA,1998,95(4):1432-1437.
[16]Fujita S,Dreyer H C,Drummond M J,et al.Nutrient signalling in the regulation of human muscle protein synthesis[J].J Physiol,2007,582(Pt 2):813-823.
[17]Volarevic S,Thomas G.Role of S6 phosphorylation and S6 kinase in cell growth[J].ProgNucleic Acid ResMolBiol,2001,65:101-127.
[18]Rolli-DerkinderenM,Machavoine F,Baraban J M,et al.ERK and p38 inhibit the expression of 4E-BP1repressor of translation through induction of Egr-1[J].J Biol Chem,2003,278(21):18859-18867.
[19]贺道远.低氧运动对骨骼肌PKB/mTOR信号通路的影响[D].北京:北京体育大学,2007.
[20]朱一力.骨骼肌mTOR信号通路在运动中变化规律及对蛋白合成调控机制[D].北京:北京体育大学,2008.
责任编辑:乔艳春
Exercise and Blocking PI3K on mTOR and Downstream s of mTOR of SkeletalM uscle in Rats
ZENG Fanxing1,ZHU Han1,ZHAO Hua2,OU YANG Q ian1
(1.School of Hum an Sports Science,Beijing Sport U niversity,B eijing100084,China;2.Sports School,Tianshui N orm al U niversity,Tianshui741001,Gansu,China)
A im:the purpose of this study was to exam ine the effect of m TOR and dow nstream of m TOR on m uscle protein synthesis in resistance treadm ill exercise m odel through blocking PI3K in vivo.M ethods:adult m ale Sprague-D aw ley rats(8w eeks old)were random ly divided into4groups after adaptive training:sedentary(S),LY294002group(SL),exercise group(E)and LY294002plus exercise group(EL).The follow ing treadm ill training w as applied:20m/m in at10%slope,60m in;once per day,7days.Rats w ere treated daily w ith Either8%ethanol orLY294002(5.5m g/kg,diluted w ith 8%ethanol)intraperitoneal injection for7days.The M HC and phosphorylation of m amm alian target of rapam ycin(m TOR)(Ser2448),70-kD a ribosom al protein S6kinase(p70S6K)(Thr389),eIF4E binding protein1(4EBP1)(Thr37/46)of gastrocnem ius m uscle w ere determ ined byW estern blotting.Results:after1week,M HC was significantly inhibited by L Y294002.Exercise had a tendency to increase M HC,and it attenuated the inhibitory effect of LY294002on M HC.Phosphorylation of m TOR(Ser2448)(P<0.01),p70S6K(Thr389)and4EBP1(Thr37/46)w ere significantly inhibited by LY294002,but they w ere elevated by exercise.Exercise had synergy effect w ith blocking PI3K in vivo.And exercise could attenuate the inhibitory effect of LY294002.Conclusions:these results suggest that:1)The phosphorylation of m TOR and dow nstream s of m TOR of skeletal m uscle w as inhibited significantly by blocking on PI3K,and attenuated the effect of exercise in vivo.2)D ow nstream s of m TOR w ere all sensitive to exercise,but4EBP1was little sensitive to blocking on PI3K.
PI3K;LY294002;m TOR pathw ay;hypertrophy;exercise
G804.4
A
1004-0560(2010)06-0082-05
2010-11-10;
2010-12-03
国家自然科学基金项目(批准号30671013)。
曾凡星(1956-),男,教授,主要研究方向为体育运动中内分泌变化及适应机制研究。

