氮掺杂的二氧化钛可见光光催化降解亚甲基蓝
张 秀 芳, 董 晓 丽, 马 春, 张 新 欣
( 大连工业大学 化工与材料学院, 辽宁 大连 116034 )
0 引 言
光催化降解污染物技术是利用半导体材料在光照下能受激活,产生高活性自由基,氧化进而消除污染物。从1972 年日本学者Fujishima和Honda[1]发现TiO2电极在紫外光照下光催化分解水以来,关于TiO2材料的研究引起了广泛的关注。但TiO2的禁带宽度较大(3.0~3.2 eV),只能利用一小部分的太阳光谱。为了利用太阳光,可见光响应的催化剂的开发是非常必要的。TiO2的阴离子掺杂改性是制备可见光催化剂较有效的途径。Asahi等[2]认为阴离子掺杂能够在TiO2的带隙间产生能吸收光的能级;掺杂后的导带能级最小值,包括次级的混合状态,和TiO2一样高或者高于H2/H2O2的电位,能够保证催化剂的光还原活性;新带隙的状态和TiO2的带隙状态相互交迭,保证在光生载流子的生命周期内将其传递至催化剂表面的反应中心上。许多学者[3-7]通过氮掺杂实现了TiO2的可见光响应。非金属元素掺杂TiO2的制备方法主要包括磁控溅射法、加热法、溶胶凝胶法、机械化学法和气相渗入法等。
染料废水因其具有色度高、毒性强、难降解等特点,成为水处理研究的热点。本文以气相渗入法制备了N/TiO2催化剂,并以亚甲基蓝 (MB) 为模型污染物,考察N/TiO2可见光催化降解染料废水的性能。
1 实 验
1.1 试 剂
钛酸四丁酯、乙醇、盐酸、MB均为分析纯。
1.2 仪 器
紫外可见分光光度计,UV-550,日本;721分光光度计,上海第三分析仪器厂;管式炉;VL-503台式离心机,上海安亭科学仪器厂;恒温磁力搅拌器,金坛市华峰仪器有限公司。
1.3 掺氮二氧化钛(N/TiO2)纳米颗粒的制备
将23.5 mL钛酸四丁酯溶入200 mL乙醇中,搅拌30 min形成溶液A;将15 g 4.4 mL/L HCl溶入20 mL乙醇中,形成溶液B。将溶液B滴加至溶液A中,于空气中反应60 min。将所得溶胶陈化后,所得凝胶在500 ℃下煅烧2 h,得到TiO2粉末。将TiO2粉末放入管式炉中,通氨气,以15 ℃/min的速度从室温升至500 ℃,保持10 min。
1.4 降解实验
取50 mL一定浓度的MB溶液加入烧杯中,加入0.1 g光催化剂,于暗室中磁力搅拌0.5 h使催化剂保持均匀悬浮态,达到吸附平衡。以500 W氙灯为光源,在烧杯和光源之间加400 nm滤波片,将波长小于400 nm的光滤掉。反应一定时间取样,离心分离,取上清液,用紫外可见分光光度计在665 nm处测量吸光度。甲基蓝的脱色率用如下公式计算:
式中,D为降解率,%;C0为甲基蓝的初始质量浓度,mg/L;Ct为降解t时间后甲基蓝的质量浓度,mg/L。
2 结果与讨论
TiO2和N/TiO2的紫外可见吸收光谱见图1。掺氮后,TiO2吸收光谱发生了明显的红移,且在可见光区的吸收明显增强。TiO2和N/TiO2的禁带宽度可由Kubelka-Munk公式αhv=A(hv-Eg)n/2计算。
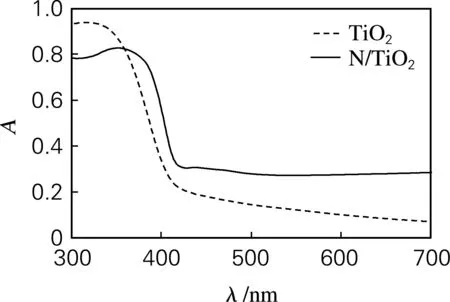
图1 TiO2和N/TiO2的紫外可见吸收光谱Fig.1 UV-vis diffuse reflectance spectroscopy of TiO2 and N/TiO2
对于TiO2这类直接跃迁型半导体,n取1。计算结果如图2所示。TiO2和N/TiO2的禁带宽度分别为3.09和2.98 eV,说明掺杂氮后,TiO2的禁带宽度变小了。这可能是由于氮元素取代了TiO2晶格中的氧造成的。
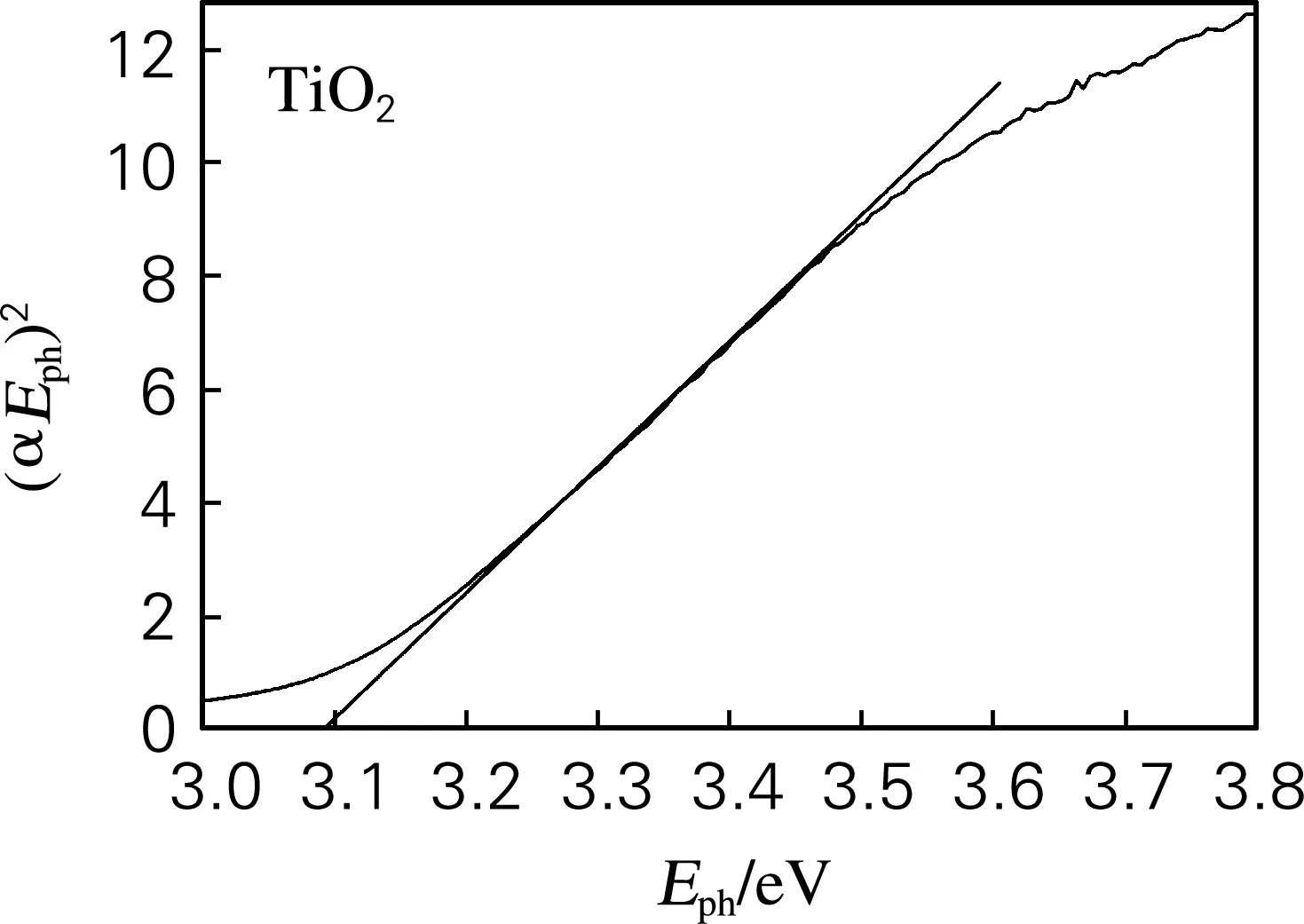
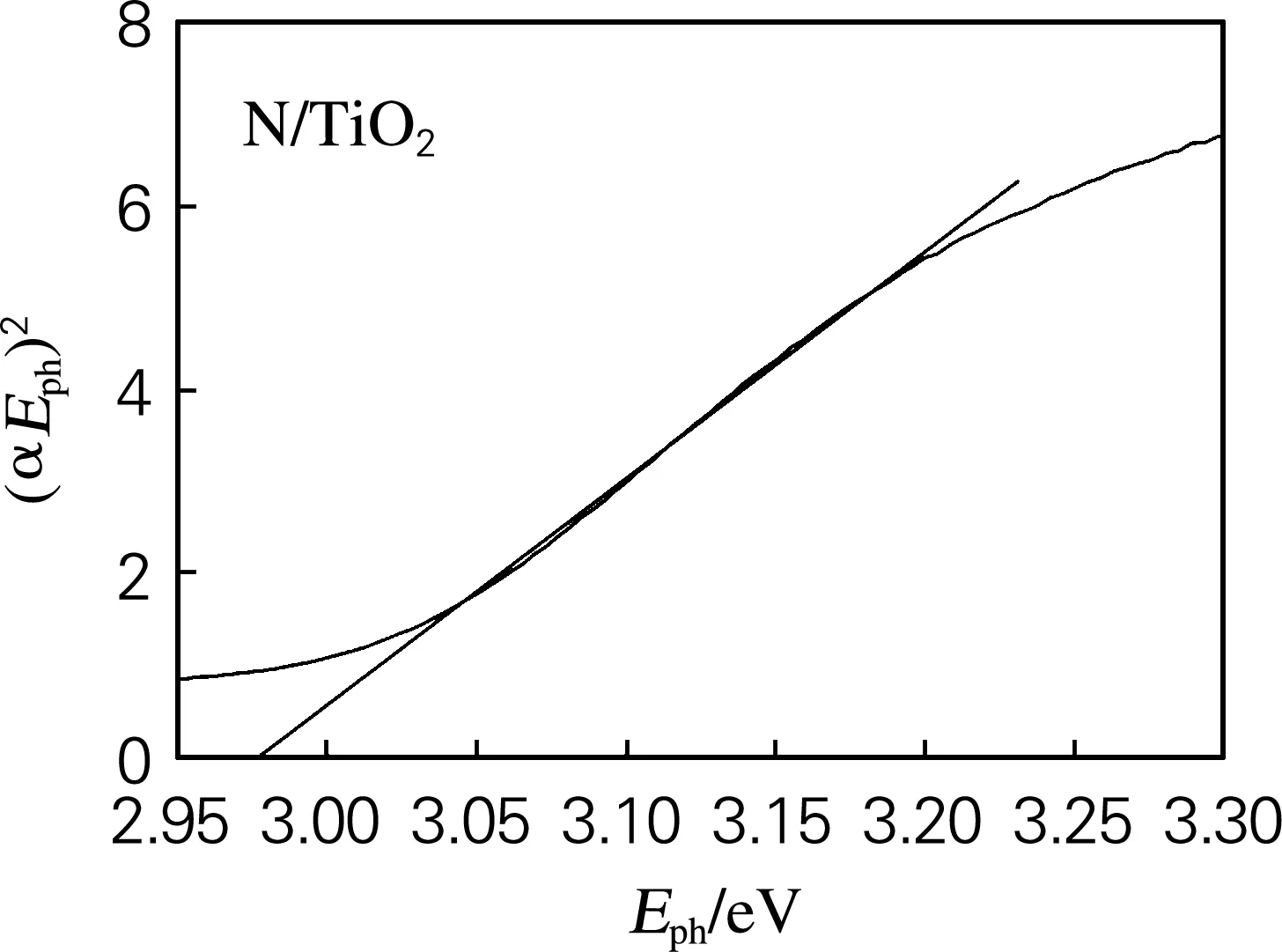
图2 TiO2和N/TiO2的禁带宽度计算示意图Fig.2 Calculation of the band gap by Kubelka-Munk function
图3为脱色率随MB初始质量浓度变化曲线。从图3可以看出,MB的初始质量浓度对其脱色率影响较大。MB的初始质量浓度为30 mg/L时,去除率最高。根据描述非均相光催化反应的基本动力学规律的L-H方程可知,当反应物质量浓度很低时,反应物分子在催化剂表面未达到饱和吸附,此时反应物质量浓度增加,反应速度就会提高。当反应物初始质量浓度达到一定数值时,由于质量浓度越高光穿透溶液的能力越弱,能参与光催化氧化反应的光子数量越少,因此,质量浓度升高会导致脱色率下降。
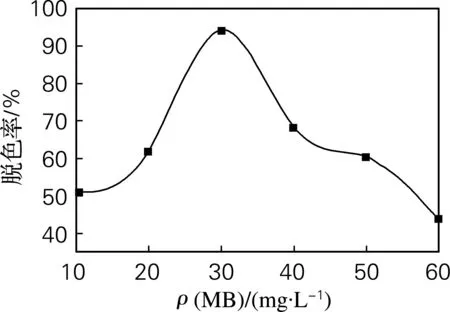
图3 脱色率随MB初始质量浓度变化曲线Fig.3 The removal rate vs the original concentration of MB
MB脱色率随pH变化曲线见图4。由图4可见,反应液初始pH对MB脱色率影响较大。反应液pH从3逐渐增大,MB的脱色率逐渐增加;当pH=5.2时,脱色率最大;之后随着pH值变大,脱色率降低。原因是pH影响TiO2表面的带电状态和亚甲基蓝的存在形式。TiO2的等电点大约为6,反应液 pH小于等电点时,TiO2表面带正电荷,有利于光生电子向表面迁移与吸附的O2结合生成·OH,进而促进氧化底物,提高光催化速率。反应液 pH大于等电点时,TiO2表面带负电荷,有利于空穴向表面迁移与水结合生成·OH。但pH过高或过低,·OH的生成会受到抑制。且甲基蓝在酸性条件下的酮式结构比中性、碱性条件下的偶氮结构易降解。
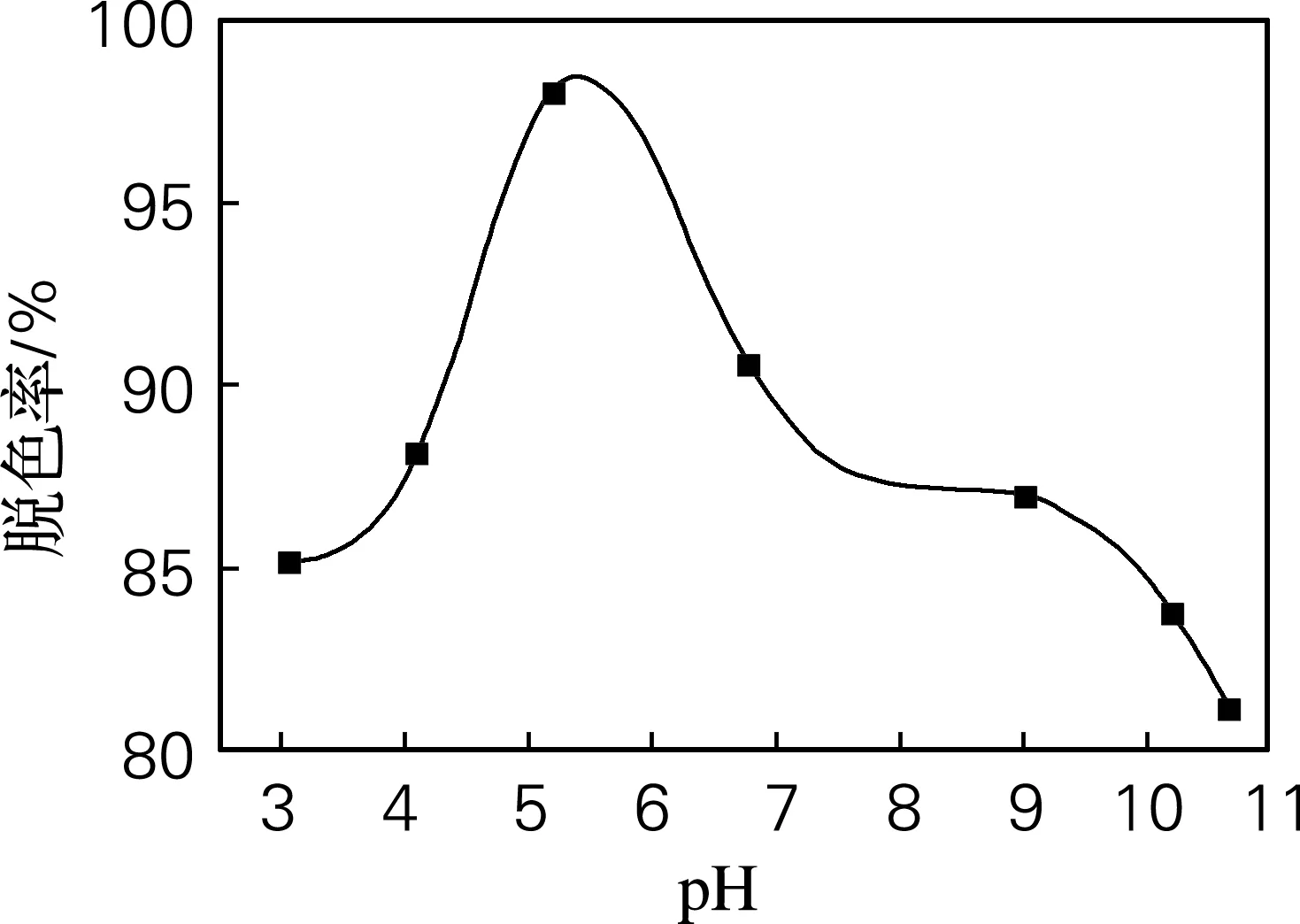
图4 MB脱色率随pH变化曲线Fig.4 The removal rate of MB vs pH
图5(a)为在N/TiO2可见光光催化过程中,MB质量浓度随时间变化曲线。反应条件为初始质量浓度30 mg/L,pH为5.2。该曲线表明,随着反应时间的不断增长,MB的脱色率不断增加。反应5 h后,MB的脱色率为96.6%。以ln(C0/Ct)对时间作图(图5(b)),回归得一条直线,R=0.985,线性较好,因此,该反应符合拟一级动力学模型。反应常数为0.717 h-1。
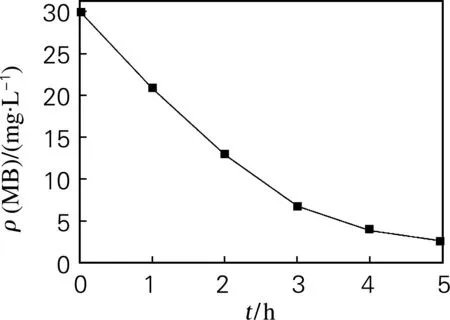
(a)

(b)图5 光催化反应中MB质量浓度随时间变化曲线和MB的ln(C0/Ct)随时间变化曲线Fig.5 The concentration vs time and ln (C0/Ct) vs time plotted for MB degradation in photocatalytic process
3 结 论
采用气相法,以氨气为氮源,成功制备了N/TiO2。氮掺杂使TiO2的禁带宽度变窄,实现了TiO2的可见光响应。在可见光条件下,反应5 h后,N/TiO2光催化降解MB脱色率为96.6%。该反应符合拟一级动力学模型,反应常数为0.717 h-1。N/TiO2较好的可见光催化降解染料的能力将使其在太阳光光催化降解难降解污染物的领域具有广泛的应用前景。
[1] FUJISHIMA A, HONDA K. Electrochemical photolysis of water at a semiconductor electrode[J]. Nature, 1972, 238:37-38.
[2] ASAHI R, MORIKAWA T, OHWAKI T, et al. Visible-light photocatalysis in nitrogen-doped titanium oxides[J]. Science, 2001, 293:269-271.
[3] SATO S. Photocatalytic activity of NOx-doped TiO2in the visible light region[J]. Chemical Physics Letters, 1986, 123(1-2):126-128.
[4] IRIE H, WATANABE Y, HASHIMOTO K. Nitrogen-concentration dependence on photocatalytic activity of TiO2-xNxpowders[J]. Journal of Physical Chemistry B, 2003, 107(23):5483-5486.
[5] IHARAA T, MIYOSHI M, IRIYATNA Y et al. Visible-light-active titanium oxide photocatalyst realized by an oxygen-deficient structure and by nitrogen doping[J]. Applied Catalysis B:Environmental, 2003, 42(4):403-409.
[6] MOZIA S, TOMASZEWSKA M, KOSOWSKA B, et al. Decomposition of nonionic surfactant on a nitrogen-doped photocatalyst under visible-light irradiation[J]. Applied Catalysis B:Environmental, 2005, 55:195-200.
[7] KOSOWSKA B, MOZIA S, MORAWSKI A W, et al. The preparation of TiO2-nitrogen doped by calcinations of TiO2·xH2O under ammonia atmosphere for visible light photocatalysis[J]. Solar Energy Materials and Solar Cells, 2005, 88:269-280.

