新三黄片中黄芩苷在大鼠体内的药物动力学研究
常金花,于海龙,刘翠哲
(河北省中药研究与开发重点实验室,承德医学院中药研究所,河北承德 067000)
新三黄片为本室自制,主要由大黄、黄芩浸膏、盐酸小檗碱组成,是临床上常用中成药,具有清热解毒、泻火通便之功效。其中,黄芩苷是黄芩浸膏的主要成分,也是新三黄片质量控制的指标成分之一。本实验应用高效液相色谱法测定新三黄片中的黄芩苷在大鼠血浆中的浓度,研究其在大鼠体内的药动学行为,为新三黄片的药动学研究提供实验基础。
1 仪器、试剂、实验动物
恒温水浴锅(EYELA,上海爱朗仪器有限公司),循环水式真空泵(SHB,郑州长城科工贸有限公司),自动漩涡混合器(ZH-2,天津药典标准仪器厂),Jascopump1580(日本分光公司),Jasco-UV1575(日本分光公司)。甲醇(色谱纯,天津协和昊鹏色谱科技有限公司),乙腈(色谱纯,天津协和昊鹏色谱科技有限公司);黄芩苷对照品(0715-200111,中国药品生物制品检定所)。Wistar大鼠(雄性),180-220g,合格证号SCXK(京)2002-0003,北京维通利华实验动物技术有限公司。
2 方法与结果
2.1 色谱条件 色谱柱:HisQil C18(250mm×4.6mm,5μm),流 动 相:甲 醇-水-甲 酸(V:V:V,50:50:0.1),检测波长:276nm;柱温:30℃;流速:0.65ml/min;进样量:20μl。
2.2 对照品溶液的配制 取黄芩苷对照品适量,精密称定,加甲醇溶解,超声助溶,甲醇定容,配制成6.4μg/ml的对照品贮备液。分别精密量取0.5ml、1.0ml、2.0ml、4.0ml、8.0ml、10.0ml贮备液至10ml容量瓶中,甲醇定容,得到不同浓度的黄芩苷对照品溶液。
2.3 空白血浆的制备 取Wistar大鼠,摘眼球取血,肝素抗凝,2500r/min离心20min,取上清液,-20℃保存,备用。
2.4 样品的处理
2.4.1 空白血浆:取空白血浆100μl,加入1mol/ml磷酸二氢钾溶液50μl,涡旋20s,依次加入甲醇100μl、乙腈350μl,涡旋5min,超声20min,3000r/min 离心15min,取上清液,40℃氮气挥干,残渣用200μl流动相复溶,14000r/min离心15min,取上清液,20μl进样。
2.4.2 制备模拟生物样品(QC):精密量取一定体积一定浓度的黄芩苷对照品溶液,挥干溶剂,其余按“2.4.1”项同法操作。
2.4.3 血浆样品:取灌服三黄片的大鼠血浆200μl,加入1mol/ml磷酸二氢钾溶液50μl,涡旋20s,依次加入甲醇200μl、乙腈700μl,余按“2.4.1”项同法操作。
2.5 方法专属性 分别制备空白血浆、模拟生物样品、血浆样品的色谱图。结果发现,在选定的色谱条件下,黄芩苷的峰形良好,无杂质峰干扰,理论塔板数不小于4000,分离度大于1.5。
2.6 标准曲线的制备 分别精密量取100μl不同浓度的对照品溶液,挥干溶剂,加入空白血浆100μl,使血浆中药物浓度分别为0.32μg/ml、0.64μg/ml、1.28μg/ml、2.56μg/ml、5.12μg/ml、6.4μg/ml,加 入1mol/ml磷酸二氢钾溶液50μl,涡旋20s,依次加入甲醇100μl、乙腈350μl,余按“2.4.1”项同法操作,记录黄芩苷的峰面积。以峰面积为横坐标,浓度为纵坐标,绘制标准曲线,得回归方程为y=48596.68x-7037.43,r=0.9994,线性范围为0.32μg/ml-6.4μg/ml。
2.7 精密度与准确度 精密吸取黄芩苷对照溶液100μl,挥干甲醇,精密加入空白血浆100μl,配成高、中、低三种已知药物浓度的QC样品,使黄芩苷在血浆中浓度 分 别 为5.12μg/ml、2.56μg/ml、0.64μg/ml,每 个浓度5份。按“2.6黄芩苷标准曲线的制备”项同法操作,分别于同一天内和连续三天进样分析,记录黄芩苷的峰面积,经方差分析求得精密度和准确度,结果日内精密度RSD分别为7.3%、4.2%、5.3%,日间精密度RSD分别为6.7%、4.9%、3.4%,准 确 度RE 为2.3%、9.9%、11.7%,均符合要求。
2.8 提取回收率实验 精密吸取黄芩苷对照溶液100μl,挥干甲醇,精密加入空白血浆100μl,配成高、中、低三种已知药物浓度的QC样品,使黄芩苷的血浆浓度分别为5.12μg/ml、2.56μg/ml、0.64μg/ml,每个浓度5份。按“2.6黄芩苷标准曲线的制备”项同法操作,记录峰面积,与相应浓度未经处理的溶液比较,计算方法的提取回收率,结果低、中、高浓度的提取回收率均在70%以上,RSD均小于5%,满足要求。
2.9 黄芩苷在大鼠体内的药动学研究 取健康雄性Wistar大鼠65只,禁食12h,自由饮水,将新三黄片加蒸馏水制成混悬液,以1650mg/kg(相当于黄芩苷200mg/kg)灌胃给药,给药后大鼠进食并自由饮水。分别在灌胃给药后5min、15min、30min、60min、120min、180min、300min、420min、540min、660min、840min、1080min、1440min 摘眼球取血2ml(每个时间点5只),肝素抗凝,2500r/min离心20min,分离血浆,-20℃保存,按“2.4.3”项同法操作,HPLC法测定大鼠血浆样品中黄芩苷的血药浓度。黄芩苷在大鼠体内各取血点的血药浓度曲线见附图。
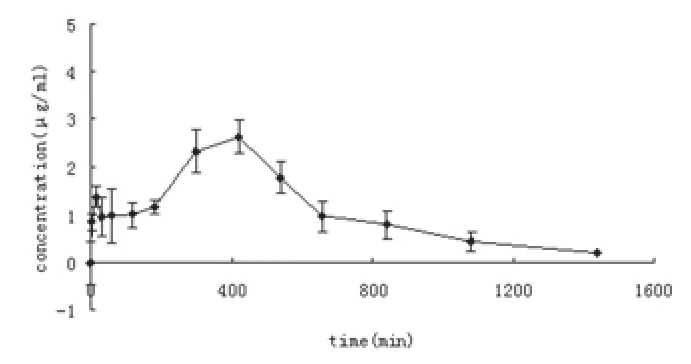
附图 黄芩苷血药浓度-时间变化曲线
将测得的黄芩苷的血药浓度数据用3p97药动学软件处理,依据相关系数r最大和AIC最小的原则选择合适的隔室模型,结果表明新三黄片中黄芩苷在大鼠体内符合二隔室模型,AUC为1431.9μg·min/ml,主要药动学参数见附表。
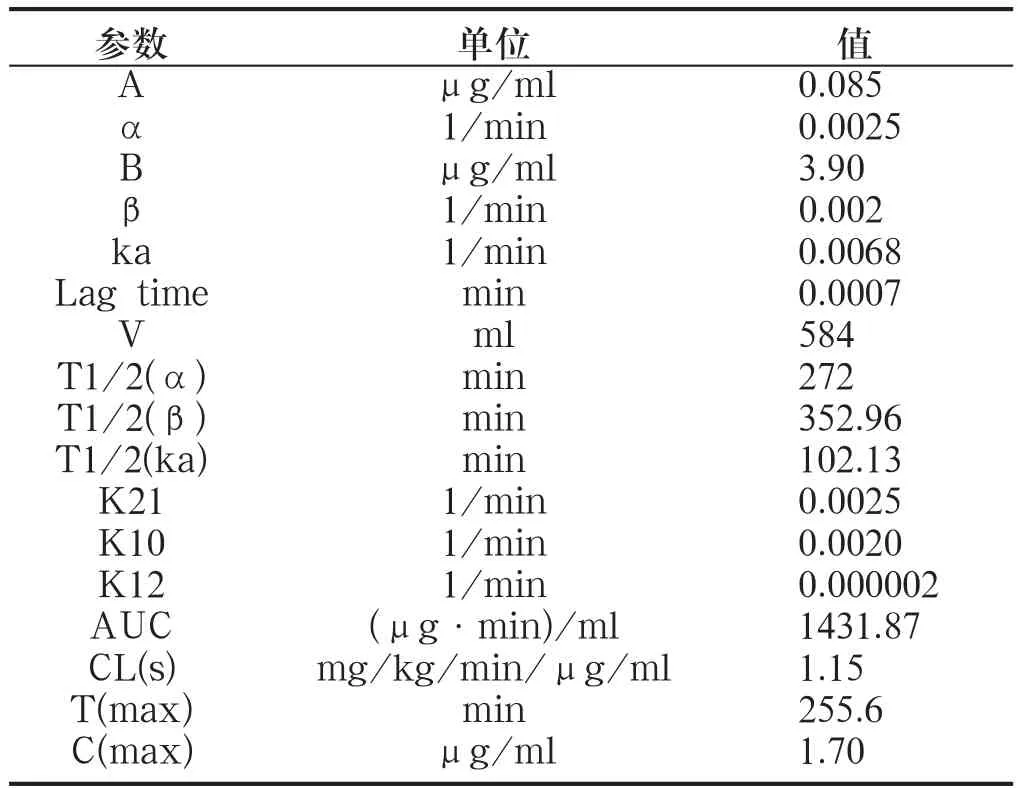
附表 黄芩苷主要药动学参数
3 讨论
黄芩苷测定的色谱条件:经紫外全波长扫描,确定黄芩苷的检测波长为276nm。本研究选择的流动相是甲醇-水-甲酸(V:V:V,50:50:0.1),在此条件下黄芩苷可与血浆内源物质很好分离,峰形对称。应用甲酸能够减少酸性物质对色谱柱的损害,而且黄芩苷的峰形也满足要求。柱温选择30℃,可缩短QC样品中黄芩苷的保留时间。
根据黄芩苷血药浓度-时间曲线,大鼠体内黄芩苷的血药浓度呈现多峰现象。出现多峰现象的原因可归结为胃排空的可变性,肠道运动的多变性,食物、肝肠循环及制剂剂型遭破坏等对吸收的影响[1]。在大鼠体内,黄芩苷的血药浓度分别在15min和7h达到高峰。推测黄芩苷的第一个吸收峰是由于新制剂很快在胃中吸收,因为黄芩苷具有弱酸性,在胃中呈非解离的分子状态,容易被吸收,并且在体肠吸收试验显示在胃中吸收8%左右[2];随着黄芩苷在消化道内由上向下的转移,胃肠道的pH值逐渐升高,黄芩苷易被解离成离子状态,吸收逐渐减少,表现为血药浓度逐渐下降[3-4]。黄芩苷到达结肠后在结肠菌群的作用下被水解为更易被吸收的黄芩素,后者可直接吸收入血[5];吸收后的黄芩素在UDPG2葡糖醛酸转移酶的作用下,结合一个葡糖醛酸基又复原为黄芩苷,这可能就是黄芩苷血药浓度在大鼠体内出现第二个吸收峰的原因[6]。此外,黄芩苷的第二个吸收峰可能与黄芩苷在大鼠体内可能存在肝肠循环有关[7]。
经方法学考察表明,本文所建立的RP-HPLC测定大鼠血浆中黄芩苷的方法,简便快捷,专属性好,灵敏度高,精密度、准确度及提取回收率均符合要求,结果可靠准确,可以应用于大鼠血浆中黄芩苷的药代动力学的研究。
[1]Leon Shargel,Susanna Wu-Pong,Andrew B.C.Yu.应用生物药剂学与药物动力学[M].第5版.北京:化学出版社2006.3.
[2]王弘,陈济民,张清民.黄芩苷的物化常数测定[J].沈阳药科大学学报,2000,17(2):105-106.
[3]刘太明,蒋学华.黄芩苷和黄芩素大鼠在体胃、肠的吸收动力学研究[J].中国中药杂志,2006,31(12):999-1001.
[4]王弘,陈济民,张清民.黄芩苷在大鼠胃、离体小肠的吸收动力学研究[J].沈阳药科大学学报,2000,17(l):527-529.
[5]Nakajima T,Imanishi M,Yamamoto K,et al.Inhibitor effect of baicalein, a flavonoid in Scutellaria Root,o eotaxin production by human dermal fibroblasts [J]Planta Med,2001,67(2):132-135.
[6]Akao T,Sakashita Y,Hanada M,et al.Enteric excretio of baicalein, a flavone of Scutellariae Radix,vi glucuronidation in rat:involvement of multidrug resistance associated protein 2 [J].Pharm Res,2004,21(11):2120-2126
[7]Jie Xing,Xiaoyan Chen,Dafang Zhong.Absorptio and enterohepatic circulation of baicalin in rats[J].Lif Sciences,2005,78(2):140-146.

