EGFP基因在不同细胞中的转染效率
徐贵江 张 明 任丽伟 洪菊生 李国庆
1 扬州市妇幼保健医院(225002)
2 扬州大学动物科学与技术学院(225002)
目前,基因疗法在医学领域掀起了研究热潮。然而,实施基因治疗的前提是将功能基因导入需要接受治疗的靶器官或靶组织的细胞中,让功能基因表达产生能够消除或减轻疾病症状的物质。
对此,基因转染研究就显得尤为重要。基因转染方法众多,如磷酸钙法、电穿孔法、阳离子脂质体法、病毒介导法和显微注射法等。不同的转染方法、不同的细胞系转染效率不尽相同。本研究采用EGFP报告基因转染AAV-293、NIH-3T3、CEF 3种细胞,旨在比较3种细胞用于基因转染时效率的高低。
1 材料与方法
1.1 实验材料
E.coliDH5a菌株、pEGFP-C1质粒、鸡胚成纤维细胞(CEF)均由扬州大学动物科学与技术学院分子实验室提供;AAV-293和NIH-3T3细胞株为作者医院保存。
1.2 主要仪器和设备
超净台;CO2培养箱;荧光倒置显微镜;电子天平;离心机;水浴锅,电热恒温板等。
1.3 主要试剂
高糖DMEM培养液、胰蛋白酶、聚乙烯亚胺(PEI)购自 Sigma公司;胎牛血清购自杭州四季青公司;质粒小量抽提试剂盒购自(大连)Takara 公司。
1.4 质粒的小量抽提
将含有质粒pEGFP-N1的E.coliDH5а培养过夜,次日使用质粒小量抽提试剂盒抽提质粒pEGFP-N1。
1.5 质粒的纯化与消毒
将抽提的质粒pEGFP-N1进行去内毒素纯化处理,用2倍体积的无水乙醇沉淀提取质粒,具体方法步骤见参考文献[1]。75%乙醇洗涤质粒沉淀进行灭菌处理,在无菌条件下晾干后,溶解于5%葡萄糖溶液中。
1.6 质粒的浓度及纯度测定
使用核酸浓度及纯度分析仪测定纯化的质粒pEGFP-N1。
1.7 PEI介导质粒转染细胞
将AAV-293、NIH-3T3、CEF 3种细胞在含10% FBS的DMEM培养液中培养,待生长至90%汇合度时,用0.25%胰蛋白酶溶液消化分散细胞,将分散的细胞悬液接种于6孔细胞培养板,浓度为1×105个细胞/孔,然后于37℃,5% CO2培养箱中培养,当细胞生长至80% 汇合度时,吸除细胞培养液,细胞用预热至37℃的PBS缓冲液洗涤3次后,将PEI包裹的纯化好的质粒pEGFP-N1加入每板孔中,于CO2培养箱中孵育3h后,改换含10%FBS的完全培养基,继续培养48h后,观察结果。
1.8 转染效率的评定
转染48h后,在荧光倒置显微镜下观察EGFP在细胞的表达,分析转染效率。
2 试验结果与分析
2.1 质粒的浓度及纯度测定
核酸浓度及纯度测定结果表明,纯化后质粒pEGFP-N1的浓度约为1μg/μL,且OD260/280=1.83说明质粒的纯度很好,可以用来转染细胞。
2.2 质粒转染细胞的观察结果
转染48h后,于荧光倒置显微镜下观察,结果表明,EGFP基因转染AAV-293、NIH-3T3、CEF 3种细胞后,都可观察到绿色荧光(图1)。
2.3 评定转染效率
通过观察分析荧光强度及绿色荧光细胞数,比较转染效率表明,EGFP基因在NIH-3T3细胞中的转染效率最高,其次是AAV-293细胞,CEF细胞中较低。
3 讨 论
本研究采用的是阳离子聚合物聚乙烯亚胺(PEI)介导基因转染的方法[2]。PEI的相对分子量为25×103,是一种有机高分子聚合物,具有较高的阳离子电荷密度,能形成高度分枝,每相隔二个碳个原子,即:每第3个原子都是质子化的氨基氮原子,使得聚合物网络在任何pH下都能充当有效的“质子海绵”体,从而将DNA 网于其中,这种多聚阳离子能将各种基因转入各种种属细胞,其转染效果好,而且细胞毒性低[3,4]。因此PEI 作为DNA的转染剂可有效用于体内和体外的基因转染。
本研究采用增强型绿色荧光蛋白[5-9](EGFP)基因转染细胞。在评定转染效率时,只需用肉眼在荧光显微镜下通过分析荧光强度及荧光细胞数目就可直观地判定转染效率的高低。
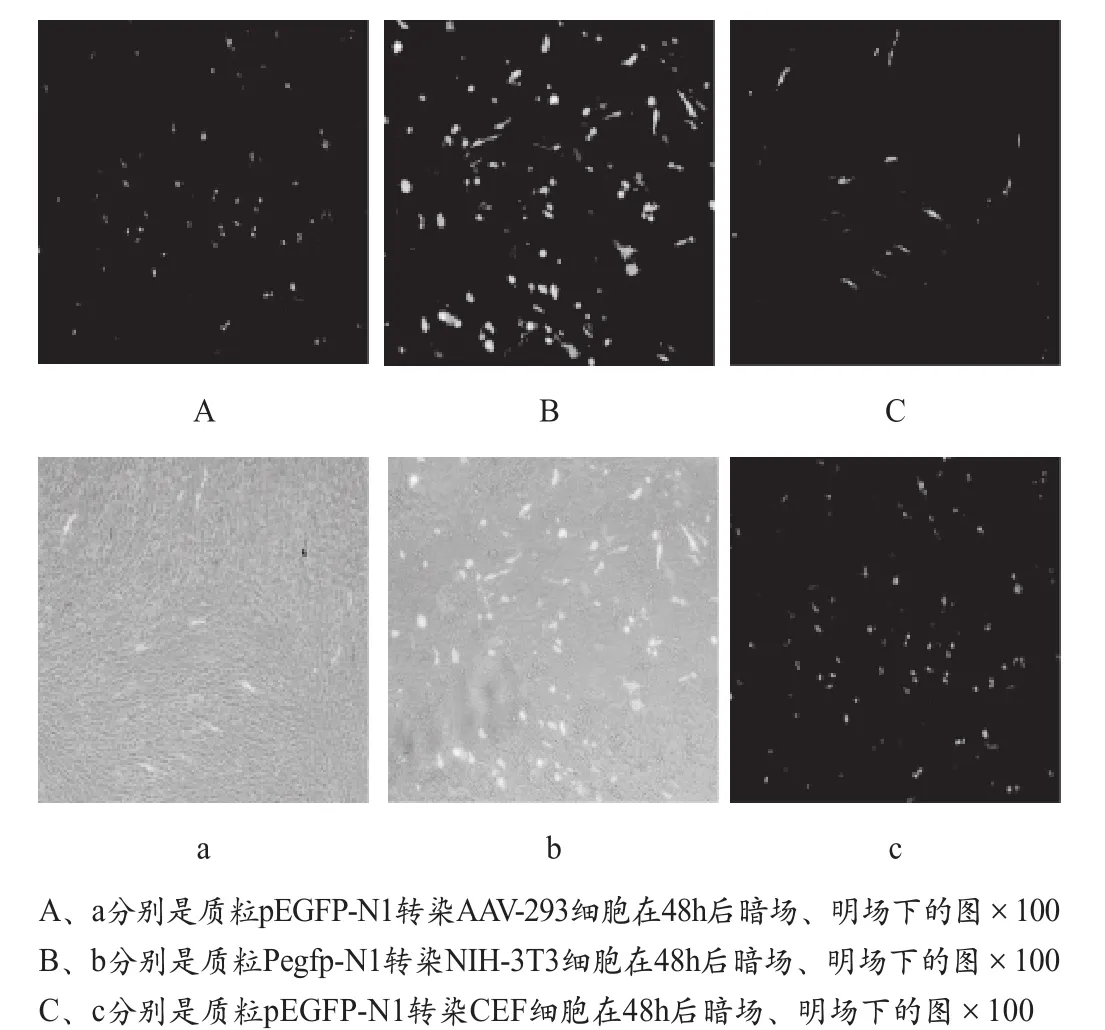
图1 pEGFP-N1质粒转染细胞AAV-293、NIH-3T3、CEF
近些年来基因治疗有成功的案例,但更多的是在总结教训,是一个喜忧参半的全新领域。基因疗法失败的根本原因在于,功能基因在需要接受治疗的靶器官或靶组织的细胞中转染效率不高,绝大多数基因尚未表达产物时,就被机体清除。本研究表明,在实施基因治疗时,不妨先看看功能基因在靶细胞上的转染效率,以为后期基因治疗的成功奠定基础。
[1]张泉,袁燕,袁维峰等.动物用质粒DNA内毒素去除方法的建立及其质量检验[J].中国兽医学报,2009,29(1): 63-66.
[2]Boussif O,Lezoualc' HF,Zanta MA,et al.A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo:polyethylenimine[J].Proc Natl Acad Sci USA,1995,92(16): 7297-7301.
[3]高波,谢飞,宋成义等.聚乙烯亚胺及睡美人转座酶对基因免疫效果的影响[J].中国兽医杂志,2008,44(12): 15-17.
[4]王宇光,郑建华,赵璐等.聚乙烯亚胺介导的报告基因在体外转染效率的研究[J].哈尔滨医科大学学报,2004,38(5): 426-428.
[5]Rosochacki SJ,Matejczyk M.Green fl uorescent protein as a molecular marker in microbiology[J].Acta Microbiol Pol,2002,51(3):205-216.
[6]何海健,陈婷飞.绿色荧光蛋白及其在分子生物学上的应用[J].金华职业技术学院学报,2008,8(4): 26-30.
[7]徐飞虎,龚兴国.绿色荧光蛋白应用研究进展[J].细胞生物学杂志,2002,24(6): 332-334.
[8]赵培,张俊龙.漫谈绿色荧光蛋白——2008年度诺贝尔化学奖[J].大学化学,2008,23(6): 1-6.
[9]杨军,陈晓黎,苏宝山等.增强型绿色荧光蛋白标记的Hela细胞株的建立[J].西安交通大学学报(医学版),2008,29(6): 717-720.

