让问题成为学生探究学习的催化剂——探究氢氧化钠溶液变质的案例及评析
张永红,黄金余
(兴化市边城学校,江苏 兴化 225712)
新课程下的课堂教学更注重学生的主体地位,强调师生的互动与合作。新课程提出的“生成性的课堂教学”体现了“以人的发展为本”的教学理念。课堂上的生成不是随心所欲、天马行空,充分有效的预设是精彩生成的保证。有效的预设,需要教师围绕教学目标,依循学生的认知曲线、思维张弛及情感波澜,有指向、有预见、有弹性地展开,并以灵动的教育机智随时调整教学策略和教学进程,促进预设转化为生成,使课堂教学充满生机,更加精彩。
化学是一门以实验为基础的学科,化学探究性实验在激发学生的学习兴趣,培养思维创新能力方面有其得天独厚的优势,可以说,它是“生成”的摇篮,教师应精心预设,善于引导,促使学生自主合作,主动探究,从实验中发现问题、分析问题并解决问题。新课改特别强调通过创设恰当的问题情境来引发学生认知冲突,启迪思维,改被动接受为主动探究,落实知识与技能、过程与方法、情感态度与价值观的三维目标。现在我以一节公开课的教学过程,说明在创设问题情境,实施有效探究教学中的一些做法。
课堂实录:氢氧化钠溶液变质的探究
情景引入:老师的实验台和学生的实验桌上都有相同的两只烧杯,分别盛有NaOH溶液和Ca(OH)2溶液。
师:同学们,这两杯溶液已放置了一段时间,你们看到这两只烧杯有什么问题要问老师吗?
学生小声议论。
生1:两只烧杯中会出现什么现象?
生2:为什么会出现以上现象?
生 3:实验室怎样贮存 NaOH 和 Ca(OH)2?
师:问题提得很好。哪位同学能帮老师解决以上问题?
众生抢着回答,还有同学叙说了发生的化学反应方程式。
师:对于上述现象,你还有要探究的问题吗?
评析:将简单的问题设计成学生提问并作答,既复习了旧知,又活跃了课堂气氛,更引起学生思索:NaOH溶液中没有明显现象,怎么知道NaOH与CO2发生了化学反应呢?这样的教学设计实现了由教师引导提问到学生自主提问,再到自主开放探究的过程。
图1
老师的问题刚一抛出,同学们的情绪一下子被调动起来,大家讨论的焦点大多集中到了那杯悄无声息的NaOH溶液上。正是因为没有明显现象,为同学们探究问题的提出提供了思考的素材。同学们对这杯NaOH溶液提出了不少问题,我有意识地对这些问题进行了适当的取舍并呈现在黑板上(同时我让同学们从桌上撤下了盛 Ca(OH)2溶液的烧杯)。
这几个有价值的问题是:
(1)放置在空气中的NaOH溶液是否变质?
(2)如果变质,则生成了什么物质?
(3)是全部变质还是部分变质?
(4)变质后的NaOH溶液如何提纯?
(5)变质后的NaOH溶液中Na2CO3的含量如何测定?
评析:这些问题涉及的知识与技能较多,有碱的化学性质、碳酸盐的检验、混合物的提纯,还有过滤操作等。这杯放置在空气中却不动声色的溶液究竟发生了怎样的变化,生成了什么物质,如何检验并除去生成物等一系列探究问题在课堂上自然生成。
如何验证NaOH溶液是否变质呢?同学们明确了就是检验溶液中是否存在Na2CO3。由于验证Na2CO3的方法有多种,因而探究具有开放性。同学们依据Na2CO3的化学性质,设计了用加入酸[如稀盐酸]、碱[如 Ca(OH)2]、盐[如 Ba(NO3)2]的方法,观察是否产生气泡或沉淀来确认NaOH溶液的变质。
该溶液是否全部变质呢?同学们设计了如下几种方案:
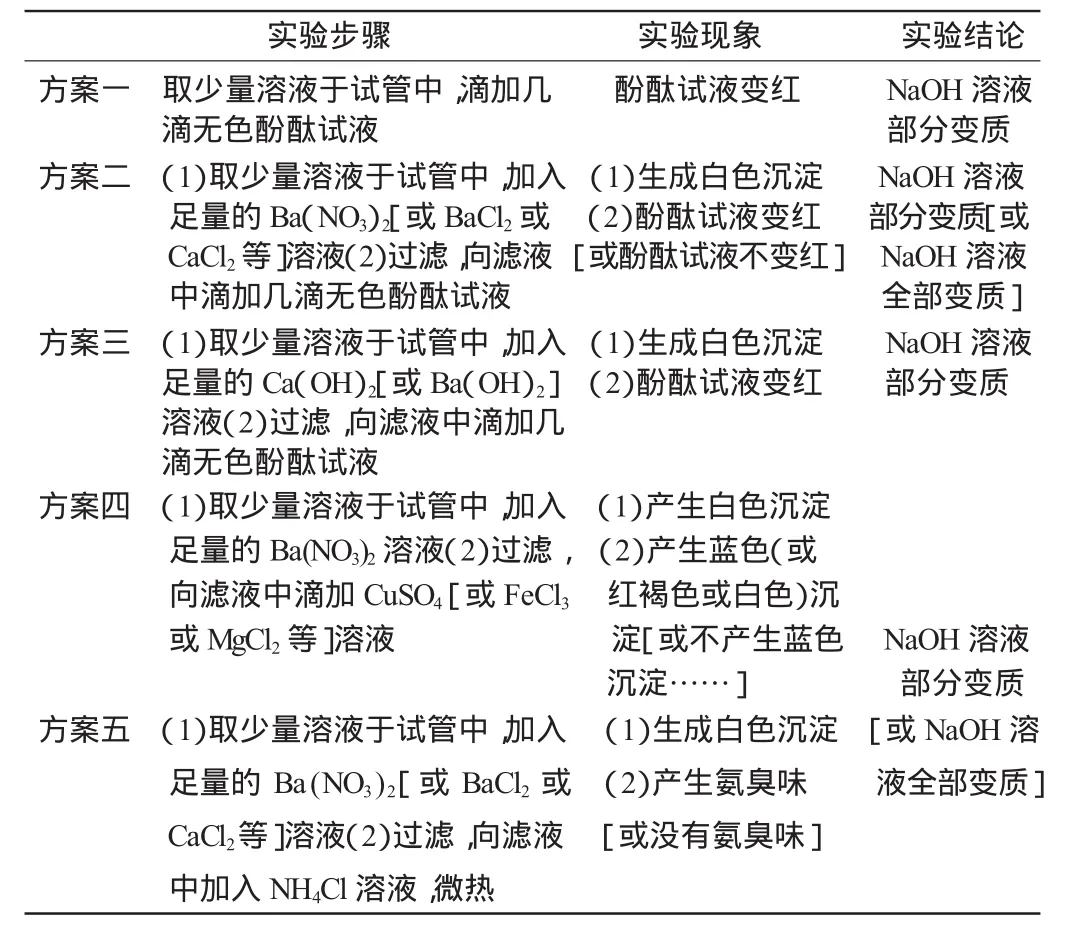
实验步骤 实验现象 实验结论方案一 取少量溶液于试管中,滴加几 酚酞试液变红 NaOH溶液滴无色酚酞试液 部分变质方案二 (1)取少量溶液于试管中,加入 (1)生成白色沉淀 NaOH溶液足量的Ba(NO3)2[或BaCl2或(2)酚酞试液变红部分变质[或CaCl2等]溶液(2)过滤,向滤液[或酚酞试液不变红] NaOH溶液中滴加几滴无色酚酞试液 全部变质]方案三 (1)取少量溶液于试管中,加入 (1)生成白色沉淀 NaOH溶液足量的Ca(OH)2[或Ba(OH)2](2)酚酞试液变红部分变质溶液(2)过滤,向滤液中滴加几滴无色酚酞试液方案四 (1)取少量溶液于试管中,加入 (1)产生白色沉淀足量的Ba(NO3)2溶液(2)过滤,(2)产生蓝色(或向滤液中滴加CuSO4[或FeCl3 红褐色或白色)沉或MgCl2等]溶液 淀[或不产生蓝色 NaOH溶液沉淀……] 部分变质方案五 (1)取少量溶液于试管中,加入 (1)生成白色沉淀 [或NaOH溶足量的 Ba(NO3)2[或 BaCl2或 (2)产生氨臭味 液全部变质]CaCl2等]溶液(2)过滤,向滤液 [或没有氨臭味]中加入NH4Cl溶液,微热
我让设计了不同方案的实验小组向全班汇报探究情况。很快就有同学提出了异议。
生4:Na2CO3也呈碱性,直接滴加酚酞试液,则无论溶液是否全部变质,酚酞试液都会变红。方案一不可行。
生5:方案三不严密。因为向溶液中加入足量OH-,就不能证明原溶液中含有OH-。
评析:同学们在问题的引领下,从多角度设计方案进行探究,考查了学生设计实验时思维的全面性和严密性。通过生生合作,生成了多种实验方案,但有的设计,需要全面分析,综合考虑,发现其缺陷,培养了学生对实验方案的评价能力。有些方案反映了学生的创新意识,显示了一定的创新设计能力。
师生讨论NaOH溶液的提纯,然后进入Na2CO3含量测定的环节。
师:那该如何测定变质后的NaOH溶液中Na2CO3的含量呢?
学生分组讨论、交流,设计实验方案。
小组代表讲述本组的设计方案,其他同学对方案进行分析讨论。大致有两种方案:一是测量Na2CO3与盐酸反应生成的CO2的体积,再通过其密度(通常状况下)求得CO2的质量,从而算出Na2CO3的含量;一是直接测定由Na2CO3与BaCl2等反应生成的沉淀质量来求解。
师:老师的桌上有一些仪器,哪位同学能上来组建方案一的实验装置?其他同学观察后作出评价。
生6:组建如下图2所示的装置图。
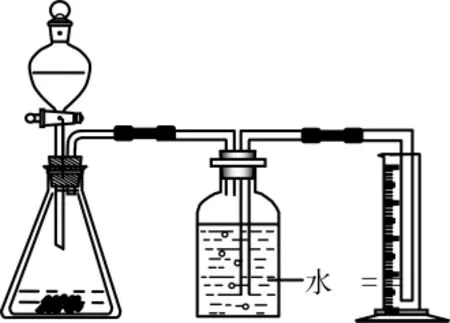
图2
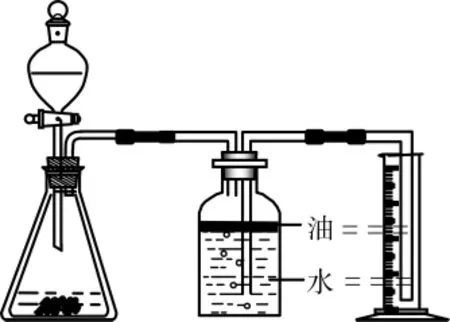
图3
生7:我认为生6的方案不行。因为CO2气体能溶于水,会造成测量结果偏小。不妨在水面上封上油以隔绝气体和水的接触(如图3)。
众生赞许地点头。
生8(略显激动):我觉得如果NaOH溶液变质程度小,生成的CO2气体会很少,这种情况下测得的结果就会不准确。
哦,学生的担心不无道理,这倒是我事先未曾预料到的问题,如果只是宣布让同学们课后思考,势必会影响学生情绪,教学质量就要打折扣。我稍作思索便灵机一动,启发道:这位同学考虑得非常周到,同学们能不能找到一种物质吸收CO2,再通过测量生成的沉淀质量来解决以上问题?
学生讨论:用 Ca(OH)2或 Ba(OH)2溶液吸收 CO2。
师:比较一下,使用哪种溶液吸收能使结果具有更高的精确度?
生9:Ba(OH)2溶液浓度大,吸收充分,且生成的BaCO3相对分子质量大,相对误差小。而Ca(OH)2溶液浓度小,生成的CaCO3相对分子质量小,相对误差较大。一起计算:2NaOH~CO2~Na2CO3~CO2~BaCO3
80 44 106 197
m(Na2CO3)=106 m(BaCO3)/197
m(CO2)=44 m(BaCO3)/197
Na2CO3%=m(Na2CO3)/[m(原溶液)+m(CO 2)]×100%
师:我们的同学很是聪明。现在谁能设计出方案二的操作程序?
生10:
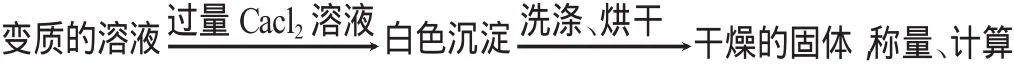
师:同学们有没有不同意见呢?
学生热烈讨论,但脸上总有一种不十分肯定的神情。此时我问:你知道Ca(OH)2的溶解性怎样?它会影响生成的沉淀质量吗?学生马上有种顿悟的感觉,认为应把CaCl2溶液换成BaCl2等含Ba2+的溶液,这样可以防止形成Ca(OH)2悬浊液增大沉淀物的质量,而且生成BaCO3的相对分子质量大,相对误差小。
评析:教学中出现了一波三折:方案一的实验装置要改进,方案二中所用试剂有问题,学生的担心需化解。在充分预设下,学生的认识不断加深,感悟时有形成。在偶遇非预设性问题时,老师尊重学生的人格,学生的思维会更加活跃,体现了“以人的发展为本”的教学理念。
师:同学们是否还有其他测定Na2CO3含量的方法,如果有,不要忘记告诉老师。
(这实际是留给学生的课后作业)
课后反思:我认为在本课实施过程中,学生始终在问题的引导下,积极思考,互相合作,用已有的化学知识进行探究学习。学生在学习过程中自然发现问题,在老师启发下分析问题并尝试解决问题,获得了预设的知识和相应的技能,学习了探究方法,并通过小组讨论、合作探究形成团队精神,达成了新课程提出的三维目标。会提问题是学生良好学习素质的体现,解决问题是学生思维发展的途径。在问题的提出和解决循环中学生快乐成长。

