YX27菌株筛分及去除富营养化河水中氨氮的研究
魏丽娜,商 平,王 伟
(1.天津科技大学 海洋科学与工程学院,天津 300457;2.天津市节水事务管理中心,天津 300074)
随着社会经济的迅速发展和人口资源的日益膨胀,水环境污染已经成为一个迫在眉睫的问题,氨氮含量是污水水质的一项重要指标,也是引起水体富营养化的主要因素之一.因此,废水的生物脱氨研究越来越受到重视[1].国内外对于脱氨技术的研究无论是在传统工艺中还是在新开发的工艺中,筛选降解氨氮的亚硝酸菌株一直以来都是研究热点与重点,也是决定反应速度的重要一步[2-4].
关于亚硝酸菌的分离和富集培养技术,国内外已有相应的研究[5-6],但这些方法、过程较为复杂,或者培养时间较长,且用于富营养化河水治理的较少.本次实验在前人研究的基础上,简化筛分过程,缩短培养时间,进行纯种亚硝酸菌分离筛选和初步鉴定,并最终将其应用于天津富营养化河水中氨氮的降解,具有实际意义.本文从曝气池活性污泥中经5次富集培养、2次分离纯化和效果测定筛选出1株降解氨氮能力较好的菌株,并通过个体形态特征、菌落特征观测和生理生化实验对其进行初步鉴定.通过多次驯化,将此菌应用于出现富营养化的河水中,并确定此株菌去除氨氮的最佳条件.
1 材料与方法
1.1 实验材料
1.1.1 菌种来源与实验用水
菌种从天津泰达污水处理厂(曝气池中)的活性污泥中分离获得;使用浓度为100 mg/L的模拟氨氮废水进行菌株复筛.氨氮去除效果测定,使用天津外环河河水,水质指标为SS:97~135mg/L,NH3-N:6.57~21.23 mg/L,TP:0.33~1.68 mg/L,COD:168.18~316.7 mg/L,pH:7.2.
1.1.2 培养基
亚硝酸细菌选择培养基主要成分为:(NH4)2SO40.2 g;K2HPO43H2O 0.13 g;MgSO47H2O 0.03 g;NaCl 0.12 g;FeSO47H2O0.02g;CaCO3(MgCO3)0.1g;NaHCO30.2g;H2O100mL;pH 7.5~8.0.培养基在121℃灭菌20 min.
亚硝酸细菌分离琼脂培养基主要成分为:(NH4)2SO40.05 g;K2HPO43H2O 0.13 g;MgSO47H2O 0.03 g;NaCl 0.12 g;FeSO47H2O 0.02 g;CaCO3(MgCO3)0.1 g;NaHCO30.2 g;H2O 100 mL;pH 7.5~8.0.培养基在121℃灭菌20 min.固体分离培养基补加 (1.5%~2%)的琼脂.
亚硝酸细菌分离硅胶培养基制作方法:根据文献 [7]制作硅胶平板,取155mL蒸馏水加5.5mL比重为1.84的浓硫酸,取185 mL蒸馏水加22.0 mL比重为1.19的浓盐酸,两者混合即为稀酸液,称82.6 g硅酸钠(Na2SiO39H2O),加500mL蒸馏水,搅拌溶解即为水玻璃,分别吸取15mL水玻璃和10mL稀酸液于小烧杯中,快速搅拌混匀,倒入培养皿中,静置凝固.将凝固后的硅胶板洗至无Cl,倒置过夜晾干.在每一硅胶板表层加入亚硝酸菌分离培养液2 mL后放入烘箱35~45℃维持1.0~1.5 h至表层无营养液流动,然后与培养皿盖子一同在紫外灯下照射30min即成为分离亚硝酸细菌的硅胶培养基.将其应用于培养亚硝酸细菌时采用“桶水袋罩法”,保证了培养条件的稳定性,且平板基本不裂,菌落的培养与观察均不受影响.
本次实验采用肉膏蛋白胨培养基、麦芽汁培养基、马铃薯葡萄糖培养基作为杂菌检验培养基[8].
1.1.3 混合试剂[8-9]
本次实验采用格利斯试剂,革兰氏染色试剂,生理生化特征鉴定试剂和纳氏试剂.
1.2 实验方法
1.2.1 菌种富集培养
取10 mL所采集的泥样加入到事先已灭菌、内装200 mL亚硝酸细菌选择培养基的三角瓶中 (内置玻璃珠),30℃摇床、160 r/min培养10 d.再从中取样10 mL接入内装200 mL亚硝酸细菌富集培养基的三角瓶中,30℃摇床、160 r/min继续培养10 d,如此富集5次,有利于所筛菌株的富集.
1.2.2 菌种分离纯化与杂菌检验
从富集培养菌悬液中取出1 mL菌悬液接入装有9 mL无菌水的试管内,依次得到101、102、103、104、108梯度的菌悬液,分别取0.1 mL菌悬液于亚硝酸菌分离硅胶培养基,用涂布器均匀涂布,待培养基凝固后倒置平皿,放入30℃培养7~14 d.挑取单菌落于亚硝酸菌分离琼脂培养基进行平板划线分离,30℃培养7~14 d,进行单菌分离.将得到的单菌株转接到斜面上,做好标记.各菌株采用牛肉膏蛋白胨培养基检查异养型细菌、麦芽汁培养基检查酵母菌、马铃薯葡萄糖培养基检查霉菌.若分离纯化所得菌株分别接种于上述3种有机营养培养基平板上,均不生长,则移入斜面保藏备用.否则,需要进一步进行分离、纯化.
1.2.3 菌株筛选
1.2.3.1 氨氮降解菌的初筛
将亚硝酸细菌选择培养液分装于试管中,每管10mL,灭菌后,将分离纯化得到的菌株各接一环于该液体培养基中.另取1管培养基接种1.0 mL无菌水作为对照.30℃培养7~14 d后,取培养液于白瓷比色板上,加格利斯试剂Ⅰ液和Ⅱ液各1滴,若有亚硝酸盐存在,则呈红色,证明有亚硝化作用[10].将有亚硝化作用的菌株保存,备用.
1.2.3.2 氨氮降解菌的复筛
将初筛得到的菌株接种到氨氮浓度为100mg/L的模拟氨氮废水中,30℃、160 r/min摇床培养7d,然后经2 000 r/min离心10 min,取上清液0.5 mL,稀释100倍,以空白培养液作对照,测定培养液中氨氮浓度的变化,根据标准曲线换算含量.
1.2.4 氨氮的测定方法
通过纳氏试剂分光光度法[9]对水中氨氮进行测定.
1.2.5 YX27菌株的形态和生理生化实验
YX27菌株的个体形态特征及菌落形态特征观察所用的菌株均为琼脂培养基培养7 d的菌株.
YX27菌株形态特征的形态观察:首先是用肉眼进行最基本的群落观察,然后通过染色在显微镜下对其形状、大小及染色特性进行观察,直观地了解细菌在形态结构上的特性,根据不同微生物在形态结构上的不同,达到区别、鉴定微生物的目的.由于各种细菌的新陈代谢类型不同,对不同物质利用后所产生的代谢产物有差异,所以采用生理生化反应来鉴别YX27菌株在形态和其他方面不易区别的微生物.
菌体浓度的测定:1)将YX27接种到亚硝酸细菌液体培养基中,在30℃、160r/min的摇床上振荡培养,每隔1d取样在600nm波长下测定其OD值,并做此菌株的生长曲线.2)通过MPN-Griess法对YX27进行计数检测[11].用平板法计数亚硝酸细菌比较繁琐、菌落小、培养时间长,杂菌也会同时生长,而且亚硝酸细菌的单菌落很难同杂菌菌落相区别.因此,本实验对于 YX27菌株采用最大可能数法 (most probable number,MPN)计数.取1 mL YX27菌悬液进行10倍梯度稀释,取101、102、 1088个稀释度,将上面各稀释度样品分别取l mL接种到含9mL亚硝酸细菌计数培养基的试管中,每一稀释度各接种4管,30℃培养7d,格利斯试剂使之显色.
1.2.6 YX27去除天津外环河河水中氨氮的条件优化
将筛选出的菌株YX27经与实验用水指标相似的培养液进行逐步培养,通过驯化使其适应环境,应用于天津外环河河水中氨氮的去除,考察pH值、温度、时间和摇床转速等条件对氨氮去除率的影响.
2 结果分析
2.1 氨氮降解菌的分离和筛选
经过富集培养和分离纯化共得到48株菌株,经过格利斯试剂验证显色的有32株菌,显色越深表明亚硝化作用越强.菌株在此过程中显色并不能说明这些菌株就是亚硝酸菌,还需要通过测定这些菌株的氨氮去除率来进一步判断是否有亚硝化作用.用初始NH3-N浓度为100 mg/L的模拟废水对这些菌株进行氨氮去除率(即亚硝化能力)的摇瓶实验,测定指标为氨氮浓度,以不接菌种的培养液作为空白对照,30℃、160r/min,培养7d后观察各菌株的氨氮去除率,去除率达70%的菌株有YX45、YX15、YX27,其中菌株YX27对氨氮去除率最高,达80.18%.因此,本次实验选用氨氮去除效果最好的YX27为实验菌株.
2.2 YX27菌株的初步鉴定
由YX27菌株的个体形态特征(图1)、菌落特征和生理生化实验(表1)可知:YX27是不需要有机生长因子,严格好氧的专性化能自养细菌,参考《常见细菌系统鉴定手册》[12]和《伯杰细菌鉴定手册》(第8版)[13],初步鉴定YX27属于亚硝化球菌属().
2.3 YX27菌株的生长情况
2.3.1 YX27菌株的生长曲线
在亚硝酸细菌选择培养基中接入YX27菌株,在温度30℃、160 r/min下振荡培养,每天取样在波长600nm处测定其OD值,绘制生长曲线,结果如图2所示.由于此类菌是化能自养菌,生长比较缓慢,世代周期长,2 d后进入对数生长期;在第7 d菌体浓度达到最高,再延长培养时间出现衰亡趋势.
2.3.2 YX27菌株的MPN-Griess计数检测结果
根据出现的阳性管数得到MPN数量指标421,查MPN表得细菌近似值为9.5,数量指标第1位数字4对应的稀释度为105,则亚硝酸细菌密度为9.5×106mL1.
2.4 YX27菌株在富营养化河水氨氮去除中的应用
2.4.1 pH值对氨氮去除率的影响
图1 YX27菌株革兰氏染色Fig.1 Gram staining of YX27
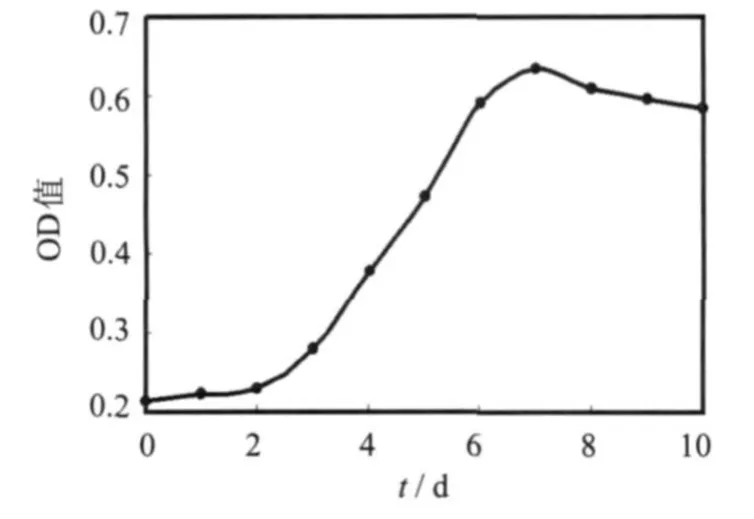
图2 YX27菌株生长曲线Fig.2 Growth curveof YX27
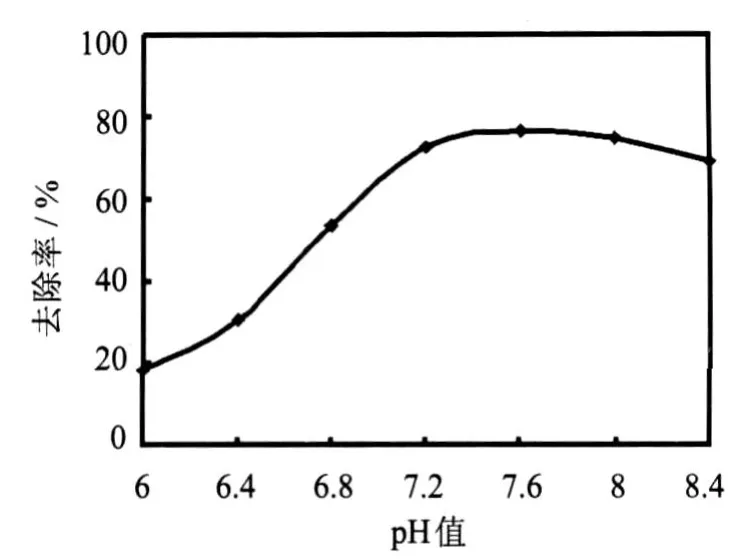
图3 pH值对氨氮去除率的影响Fig.3 Effectof pHvalueon NH3-Nremoval rate
从制成的YX27菌株种子培养液中分别用接种环接一环于100mL pH值分别调至6.0、6.4、6.8、7.2、7.6、8.0、8.4的河水中,在温度30℃、摇床160 r/min下处理,7 d后测定氨氮浓度,考察pH值对废水中氨氮去除效果的影响,结果见图3.
pH值是影响废水生物脱氨一个重要因素,从图3可以看出随着pH值的升高YX27菌株对氨氮的去除率均呈上升趋势,pH值在7.2~7.6时氨氮去除率增加趋势逐渐缓慢,且去除率均在72.00%以上,最高去除率达到76.56%.因为硝化需要消耗废水中的碱,因此pH值较低时细菌的降解作用比较微弱,去除率比较小,考虑到初始时细菌的生长和硝化过程所需,处理废水时pH值控制在7.2~7.6之间为宜.
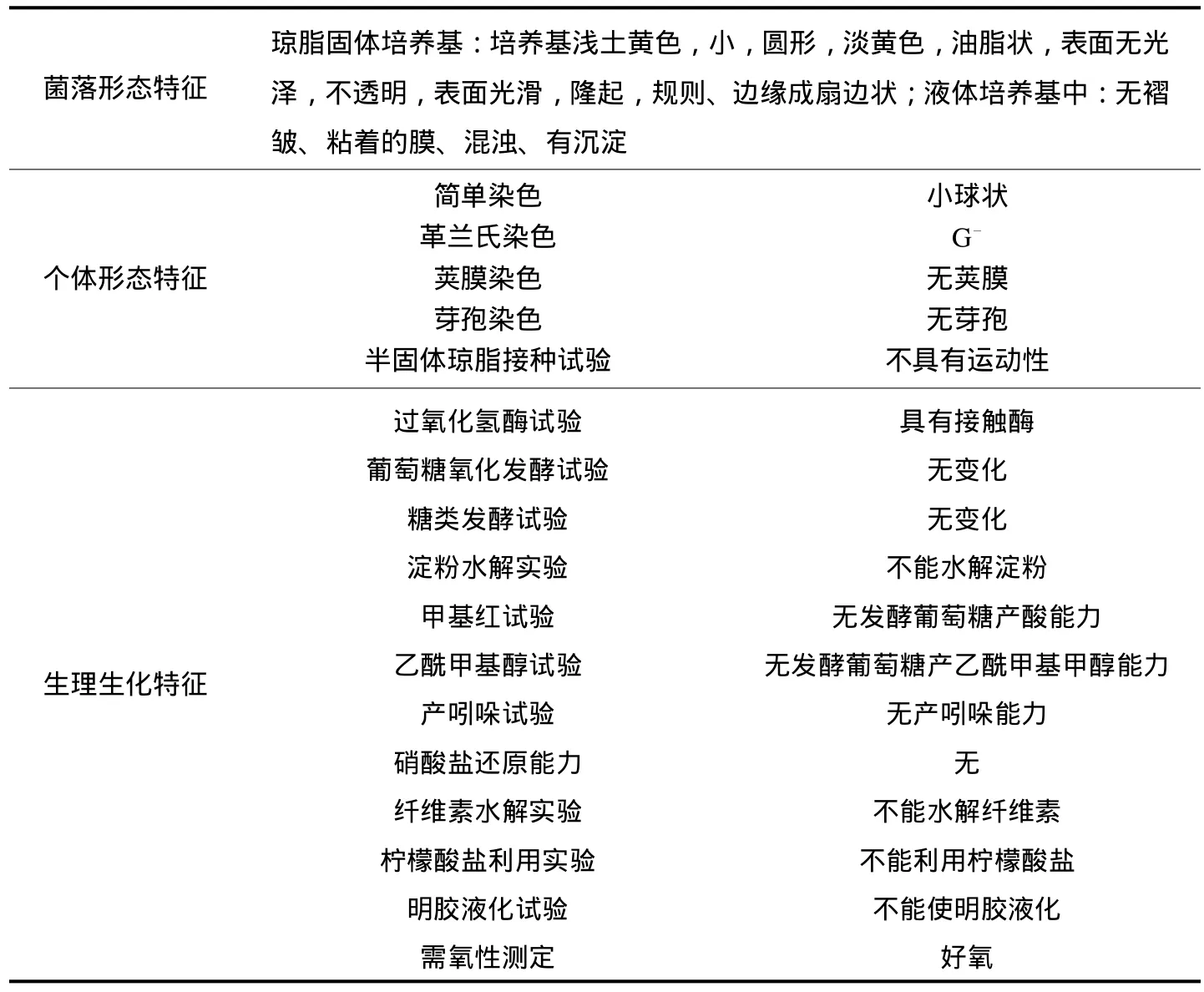
表1 YX27菌株个体形态、菌落、生理生化特征Tab.1 Features of individual morphology colony physiological of YX27
2.4.2 温度对氨氮去除率的影响
从制成的YX27菌株种子培养液中分别用接种环接一环于pH值为7.4的7瓶100 mL河水中,分别置于温度20℃、22℃、24℃、26℃、28℃、30℃、32℃下160 r/min振荡处理,7 d后测定氨氮浓度,考察处理温度对氨氮去除效果的影响,结果见图4.
温度是影响细菌生长和代谢的重要因素,也是影响生物脱氨的重要原因,从图4可以看出,随着反应温度的升高,去除率不断增大,在30℃时去除率最大,去除率最高时达到80.24%,若温度再高则可能会破坏细菌的酶系造成去除率下降,因此适宜温度在30℃左右.
2.4.3 振荡速度对氨氮去除率的影响
亚硝酸细菌正常代谢需要溶解氧,大多数学者认为溶解氧应控制在1.5~2.0 mg/L为宜[3].通过改变摇床转速可以考察溶解氧浓度的变化对亚硝酸细菌的处理效果.从制成的 YX27菌株种子培养液中分别用接种环接一环于pH值7.4的6瓶100 mL河水中,温度为30℃,转速分别为50 r/min、100 r/min、120 r/min、140r/min、160r/min、180r/min,振荡处理7d后测定氨氮浓度,考察处理的振荡速度对氨氮去除效果的影响,结果见图5.

图4 温度对氨氮去除率的影响Fig.4 Effect of temperatureon NH3-N removal rate
如图5所示,随着振荡速度的加快,溶解氧浓度增加,去除率不断增大,在振荡速度为180 r/min时去除率最大,去除率最高时达到79.06%.
2.4.4 处理时间对氨氮去除率的影响
从制成的YX27菌株种子培养液中用接种环接一环于pH值7.4的100 mL河水中,在温度30℃、180 r/min下培养,每天取样测一次氨氮浓度,连续测定10d,考察处理时间对氨氮去除效果的影响,结果见图6.
从图6可以看出,随时间的变化,YX27菌株在1~2 d对氨氮的去除率均较低,从3~7 d随时间的推移对氨氮的去除率稳定增加,去除率最高时达到86.12%,7 d后增加速度平缓或有下降趋势,基本达到稳定.由图2细菌生长曲线可知,在第7d细菌数量最多,菌体浓度最高,此时废水中细菌可摄取的营养物质已经很少,继续反应氨氮去除率无明显提高,因此YX27菌株最佳反应时间为7~8 d.
3 结论
1)本实验采用两种分离培养基对YX27菌株进行分离纯化:硅胶平板选择性强,用于分离亚硝酸细菌;而琼脂平板容易培养,生长时间较短,用于纯化亚硝酸细菌.有效提高了亚硝酸细菌的分离纯化效率,方便实用.
2)采用MPN-Griess计数检测对YX27菌株进行计数,克服了用平板法计数亚硝酸细菌较繁琐、菌落小、培养时间长,杂菌同时生长且难同杂菌菌落相区别等缺点.
3)通过YX27菌株个体形态特征、菌落特征观测和生理生化实验,初步鉴定YX27菌株属于亚硝酸球菌属
4)通过驯化的YX27菌株应用于富营养化河水中氨氮的去除,实验结果表明:在pH值7.2~7.6、振荡速度180r/min、温度30℃时,YX27菌株对富营养化河水中氨氮的去除效果较好,去除率最高可达到86.12%,处理时间7~8 d.
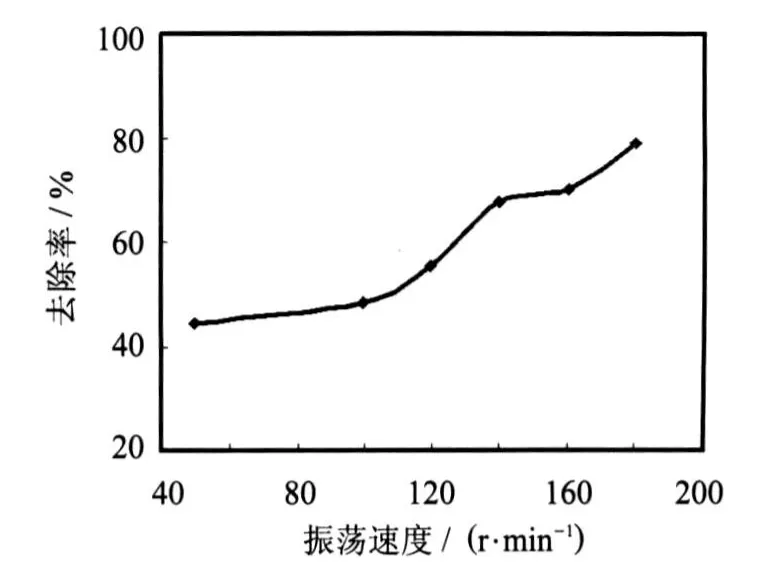
图5 振荡速度对氨氮去除率的影响Fig 5 Effect of vibrating rateon NH3-N removal rate
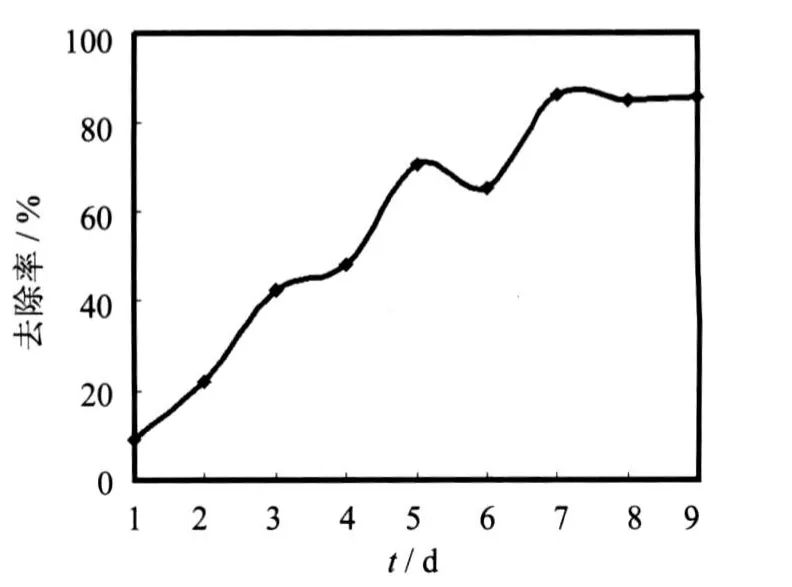
图6 时间对氨氮去除率的影响Fig.6 Effect of timeon NH3-N removal rate
[1]蔡钰颖,商平,魏丽娜,等.降解氨氮微生物菌株的分离筛选及去除效果实验研究 [J].净水技术,2008,27(3):44-47.
[2]吴剑,齐鄂荣,程晓如,等.废水生物脱氮技术的研究发展 [J].武汉大学学报:工学版,2002,35(1):76-79.
[3]杨波,杨志恒,胡文荣,等.亚硝化细菌处理氨氮废水的研究 [J].武汉理工大学学报,2007,3(29):63-66.
[4]钟理,谭春伟,胡孙林,等.氨氮废水降解技术进展 [J].化工科技,2002,10(2):59-62.
[5]Bollmann A,Laanbroek HJ.Continuouscultureenriehmentsof ammonia-oxidizingbacteriaatlow ammoniumconcentrations[J].FEMSMicrobiology Ecology,2001,37:211-221.
[6]杨宁.污泥中硝化细菌富集培养技术的研究 [J].科技情报开发与经济,2003,13(7):103-105.
[7]胡君利,林先贵,褚海燕,等.土壤氨氧化细菌的分离方法研究 [J].土壤,2005,37(5):569-571.
[8]钱存柔.微生物学实验 [M].北京:北京大学出版社,1985.74-76,205-246.
[9]魏复盛,寇洪茹,洪水皆.水和废水监测分析方法 [M].第4版.北京:国家环境科学出版社,2002.
[10]孔庆鑫.一株新型脱氮微生物的分离鉴定及其脱氮机制 [D].北京:中国人民解放军军事医学科学院,2004.
[11]陈岭.氨单加氧酶基因(amoA)在氨氧化细菌种群分析和定量检测中的应用研究 [D].杭州:浙江大学,2003.
[12]东秀珠,蔡妙英.常见细菌系统鉴定手册 [M].北京:科学出版社,2001.
[13]布坎南RE,吉本斯N E.伯杰细菌鉴定手册 [M].第8版.中国科学院微物研究所翻译组,译.北京:科学出版社,1984.622-651.

