油脂下脚料降解菌的选育
颜焱娜,杨红武,刘仁萍,吴民熙,曾 炽,孙天玮,吴永尧
湖南农业大学生物科学技术学院,长沙 410128
油脂下脚料降解菌的选育
颜焱娜,杨红武,刘仁萍,吴民熙,曾 炽,孙天玮,吴永尧*
湖南农业大学生物科学技术学院,长沙 410128
从油污土样等样品分离获得两种高产蛋白酶的菌株,命名为M1、DB2,其酶活力分别 213.04,206.95 U/ mL。利用该两株菌分别对大豆粕,芝麻粕,菜籽粕作为发酵基质进行了初步的降解蛋白能力比较研究,结果表明M1、DB2均能很好的降解三种粕中的粗蛋白。M1、DB2的最适生长温度分别为 30、35℃,最适生长 pH分别为 7、8,最佳生长时间分别为 12、32 h。初步鉴定M1、DB2为芽孢杆菌属。
大豆粕;芝麻粕;菜籽粕;蛋白酶;芽孢杆菌(Bacillissp.)M1和DB2
饼粕是利用油料作物的籽实提取油脂后的产品[1]。饼粕中含有 30%~50%的粗蛋白质,氨基酸组成较全面[2],是一种良好的蛋白资源。我国每年油脂下脚料总量在 1000万吨以上,然而饼粕中大多含有抗营养因子,导致这种优良蛋白质资源没有得充分利用,甚至废弃,这无疑造成了环境污染和自然资源的极大浪费[3]。为此本项目组以大豆粕,芝麻粕,菜籽粕为基质,筛选高效降解饼粕粗蛋白的菌株,将饼粕通过生物发酵处理后,使饼粕中的各种抗原成分、抗营养因子被有效降低去除,饼粕中的蛋白质被分解成大量的植物小肽。这种无抗原的植物小肽吸收率高,可作为优良蛋白质来源[4]等,为饼粕综合开发利用提供一定的理论和试验依据。
1 材料与方法
高压灭菌锅;恒温培养箱;HZQ-Q振荡器;凯氏定氮装置。
大豆粕、芝麻粕、菜籽粕为湖南金叶肥料公司提供。
1.2 方法
1.2.1 培养基的配制
分离纯化培养基:固体肉汤培养基[5]。
初筛培养基:酪蛋白培养基[6]。
产酶发酵培养基:芝麻粕 5 g,pH 7.5的缓冲液45 mL,NaCl 0.5%;大豆粕 5 g,pH 7.5的缓冲液 45 mL,NaCl 0.5%;菜籽粕 5 g,pH 7.5的缓冲液 45 mL,NaCl 0.5%复筛培养基:芝麻粕 100 g(40目筛),pH自然,50%水;大豆粕 100 g(40目筛),pH自然,50%水;菜籽粕 100 g(40目筛),pH自然, 50%水。
涂料、瓷砖、地板、橱柜所用板材,甚至部分高价施工辅料,随时存在“被偷换”的可能,因此业主们常常被告诫,要经常去工地监工。但事实上,工人想偷换材料并不那么容易。比如一般电线和电缆等施工辅材上都印有品牌的标识,从暗盒处能看到,如果工人偷换,很容易被发现。
1.2.2 菌种分离纯化
将土壤制成悬浊液并稀释后,均匀涂布于固体肉汤培养基上,37℃培养 2 d,挑取单菌落并接种至斜面培养基上保存备用。
1.2.3 菌株筛选
将斜面菌株,分别接种于酪蛋白培养基平板中,放入 37℃恒温箱,培养 48 h,比较生长菌落直径及透明圈直径[7]。(2)将酪蛋白培养基平板筛选的优势菌株接种至产酶发酵培养基中,发酵 48 h后,发酵液用于冷冻离心机 6000 r/min离心 15 min,取上清液 1 mL,稀释 20倍用福林酚法测定发酵液中的蛋白酶活力[8],选取蛋白酶活力高的菌株为复筛出发菌。
1.2.4 菌株降解三种粕能力比较
经过初筛获得的优势菌株分别接种 10%到复筛培养基中发酵 7天后,检测其中的总氮含量、蛋白氮含量、非蛋白氮含量[9]。其中总氮含量的测定[8]:采用凯氏定氮法。蛋白氮含量的测定:称取 5 g样品加 10 mL质量分数为 6%硫酸铜溶液,静置过夜,过滤收集沉淀,用凯氏定氮法测定蛋白氮含量(硝化时连同滤纸一起放入凯氏瓶内硝化)。
粗蛋白含量 =蛋白氮含量 ×6.25
非蛋白氮含量 =总氮含量 -蛋白氮含量
1.2.5 菌株生长特性
分别考察以下单因素对M1、DB2生物量的影响:(1)培养时间分别为 4、8、12、16、20、24、28、32、36 h;(2)培养温度分别为 30、35、40、45、50、55℃; (3)培养基的 PH分别 4、5、6、7、8、9,从而了解该两株菌的生长特性,其中生物量大小以发酵液在600nm吸光度大小表示。
1.2.6 菌种的初步鉴定
根据《常见细菌系统鉴定手册》、《伯杰细菌鉴定手册》,对筛选菌株进行初步鉴定。
2 结果与分析
2.1 不同菌株产蛋白酶活性比较
从油污土样等样品中获得 8株产蛋白酶菌株,即 T1、T2、T5、B1、M1、X1、DB2、CH1、CH3,为了进一步比较它们产蛋白酶活力,分析了该 8株菌在大豆粕,芝麻粕,菜籽粕三种产酶发酵培养基中产蛋白酶能力。结果见表 1,M1、DB2在大豆粕酶活较高,其中M1达到了213.04 U/mL,DB2达到了 206.95 U/ mL,与有关研究[9]比较,可知该两株菌的酶活力较高,可作为良好的出发菌株。而M1、DB2在芝麻粕、菜籽粕中酶活力均只有 35 U/mL左右,酶活力不高,这可能是芝麻粕,菜籽粕中的营养成分与大豆粕不同,不利于M1、DB2的生长代谢,从而影响它们的蛋白酶表达水平。但相对于其他菌株在芝麻粕、菜籽粕中产酶能力的比较,M1、DB2仍表现为蛋白酶活较高,故选取M1、DB2两株菌进行降解不同粕中蛋白质能力比较。
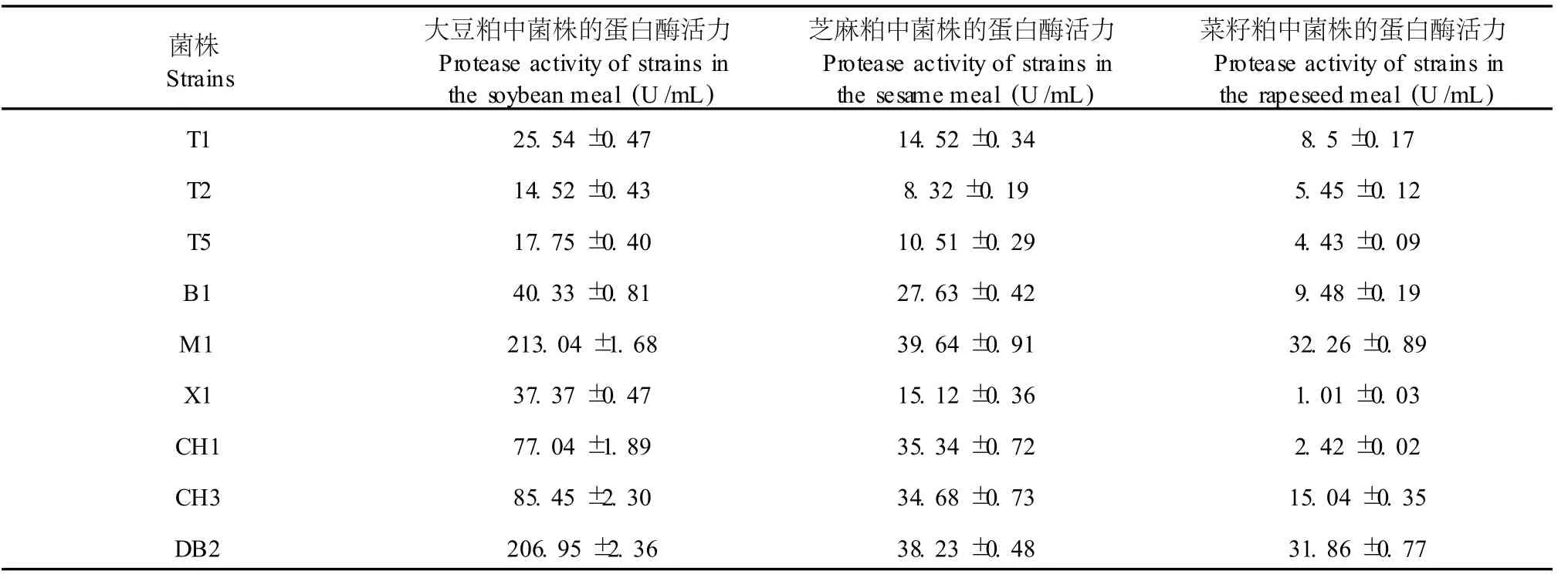
表 1 蛋白酶产生菌株在不同粕中产蛋白酶活力Table 1 Protease activity by protease producer in different oil cakes
2.2 不同菌株降解三种粕蛋白能力的比较

表 2 三种粕粗蛋白降解效果Table 2 Degradation effect of protease in the three different oil cake

将初筛得到的菌株分别接种于复筛培养基中,以未发酵粕为对照。通过分析了经降解后的三种粕中总氮的含量,蛋白氮含量,非蛋白氮含量,比较不同菌株降解这三种粕蛋白的能力,结果见表 2。可知,M1、DB2对粕蛋白质的降解显著性高于未发酵的粕 (P<0.05),这说明它们对三种粕都具有很好的降解能力。其中M1使大豆粕、芝麻粕、菜籽粕中的蛋白氮含量分别下降 31.0%;11.5%;29.67%。DB2分别使大豆粕、芝麻粕、菜籽粕中蛋白氮下降34.8%;16.1%;27.12%。M1,DB2两株菌各自降解大豆粕中的蛋白质能力显著性高于降解芝麻粕中的蛋白质 (P<0.05)。产生这一差异的原因可能是该三种粕主要成分有差异,三种粕中粗脂肪含量依次为大豆粕 <菜籽粕 <芝麻粕,无氮浸出物含量依次为大豆粕 >菜籽粕 >芝麻粕,粗脂肪含量越低,无氮浸出物含量越高可能越有利于M1、DB2两株菌的生长及蛋白酶的合成。
2.3 菌株的生长特性
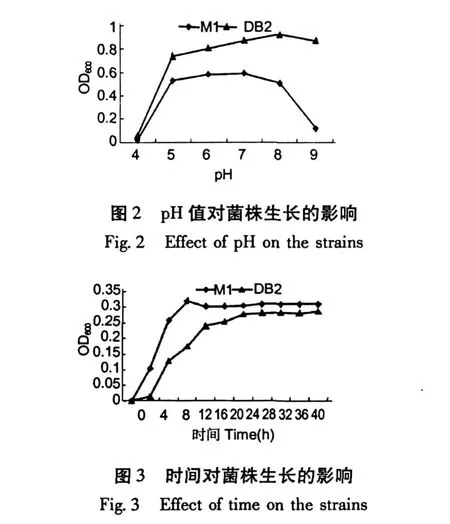
考察了温度、时间、pH对M1,DB2菌株的生物量影响,结果见图 1~3。由图可知,M1菌株最佳生长条件为温度为 30℃,时间为 12 h,pH值为 7时; DB2菌株最佳生长条件温度为 35℃,时间为 32 h, pH值为 8时。M1的生长速度较快,DB2的耐高温性较强。产生这种差异可能与菌株种属差异有关,为此对两株菌株形态,生化生理特性进行了初步鉴定。
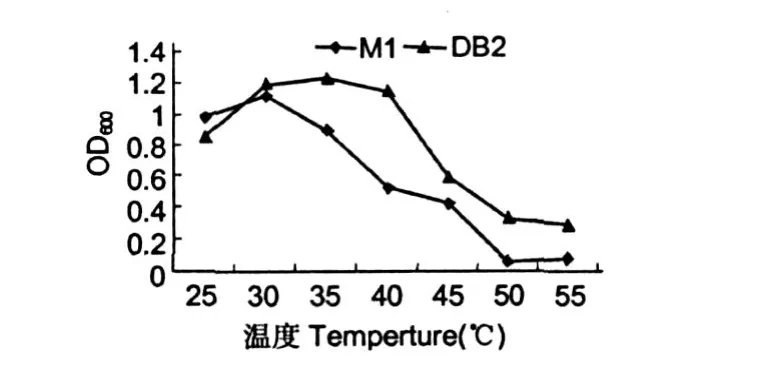
图 1 温度对菌株影响Fig.1 Effect of temperature on the strains
2.4 初步鉴定结果
根据《常见细菌系统鉴定手册》、《伯杰细菌鉴定手册》,对其形态及培养特征进行了初步鉴定M1,DB2为芽孢杆菌属B acillissp.M1和DB2。
3 结语
从油污土样等样品分离获得两种高产蛋白酶的菌株 M1、DB2。其在大豆粕中酶活力分别为213.04,206.95 U/mL。M1、DB2均能很好的降解三种粕中的粗蛋白,其中两株菌降解大豆粕中的蛋白质能力显著性高于降解芝麻粕中的蛋白质 (P<0.05)。
M1、DB2为产中性蛋白酶菌株,M1,DB2的最适生长温度分别为 30、35℃,最适生长 pH分别为 7和 8,最佳生长时间分别为 12、32 h。两株菌均为革兰氏染色阳性菌,杆状菌株,含有孢子,其中 DB2耐热性较好,初步鉴定为芽孢杆菌属。
综上所述,M1、DB2可作为降解大豆粕粗蛋白的优良菌株,为饼粕综合开发利用提供一定的基础数据资料和试验依据。
1 Xue ZC(薛志成).The rational use ofMeal in animal feed.The Anim al Feed in Hunan(湖南饲料),2005,3:28-29.
2 Xiao SP(肖世平),QiLH(漆林花).The nutritional value of rapeseed meal and hang-nutritional factor.The An im al Feed in Guangdong(广东饲料),1995,6:11-13.
3 Wang XS(汪习生),Nuo JQ(罗继权).Swill restaurant waste oil and waste an imal and vegetable oils is deserve to use deeply.Study on Renewable Resources(再生资源研究), 2001,3:24-26.
4 Wei L(卫琳),Song JM(宋俊梅),Huang YF(黄永锋). Researching and applicating the Solid-state fermentation of soybean meal in animal feed.The Use of New Technologies in the Protein RawMaterial(蛋白原料应用新技术),2008, 8:12-13.
5 Du LX(杜连祥),Lu FP(路福平).Microbiology of Laboratory Technicians(微生物学实验技术).Beijing:China Light Industry Press,2005,8(1):349-350.
6 ShaoW(邵伟),TangM(唐明),Ling L(李铃),et al.Application of complex mutation on high-yield strain selecting for mucor racemosus.China Condim ent(中国调味品 ), 2004,12(12):14-14.
7 Jiang XR(姜锡瑞).The Manual of Enzyme Preparation(酶制剂运用手册).Beijing:China Light Industry Press,1999, 2(1):292-297.
8 Qiu X(邱鑫),Xiao HQ(肖汉乾),Xiang TY(向天勇),et al.Screening,identification and fer mentation conditions of the crude protein-degradative strain.Am ino Acids&B iotic Resources(氨基酸和生物资源),2005,27(1):1-5.
9 Wu X(伍欣),Zhang XY(张晓昱),Wu L(武龙).Screening of alkaline protease producing alkalophilicBacillussp..Journal of M icrobiology(微生物学杂志),2005,25(20): 40-44.
Isolation of Stra insDegrading the Garbage of O il and Fat
YAN Yan-na,YANG Hong-wu,L IU Ren-ping,WU Min-xi,ZENG Chi,SUN Tian-wei,WU Yong-yao*
College of B ioscience and B iotechnology,HNAU,Changsha 410128,China
Two high yield proteases-producing strains named asM1,DB2 were isolated from the Oil-contaminated soil samples.The protease activities ofM1,DB2 were 213.04,206.95 U/mL,respectively.The results showed that the content of protein in soybean meal,sesame meal,rapeseed meal has descended after fermentation with M1,DB2.The optimum temperature forM1,DB2 growth were 30,35℃,The optimum pH forM1,DB2 growthwere 7,8.The optimum time forM1,DB2 growth is 12,32 h.Theywere all identified asBacillissp.M1,Bacillissp.DB2
Soybean meal;sesame meal;rapeseed meal;protease;Bacillissp.M1,DB2
Q939.97
A
1001-6880(2010)04-0674-04
2009-03-17 接受日期:2009-07-07
湖南省中南烟草实验站项目(08-10Aa02)
*通讯作者 Tel:86-532-88963253;E-mail:yywu357@sohu.com

