L-菊苣酸在不同溶剂中的光致差向异构化
谢继国,陈 波,郭建伟,姚守拙
化学生物学及中药分析省部共建教育部重点实验室湖南师范大学,长沙 410081
L-菊苣酸在不同溶剂中的光致差向异构化
谢继国,陈 波*,郭建伟,姚守拙
化学生物学及中药分析省部共建教育部重点实验室湖南师范大学,长沙 410081
研究了不同溶剂中L-菊苣酸在紫外光照下的稳定性。经过紫外光谱,液质联用、旋光度核磁共振氢谱的鉴定分析,结果表明,在光照条件下L-菊苣酸会部分生成它的差向异构体,不同的溶剂中其异构化程度不同,在 365 nm,达到平衡时异构化率结果为:乙腈 >甲醇 >四氢呋喃 >水;在 254 nm下,则为:乙腈 >四氢呋喃 >甲醇 >水,且在 254 nm下比在 365 nm下异构化程度大些。
L-菊苣酸;内消旋菊苣酸;光致差向异构化
紫锥菊 (Echinacea purpurea)原产北美地区,作为免疫促进剂和免疫刺激剂而受到重视。紫锥菊中主要化学成分[1]有多糖、糖蛋白、烷基酰胺和咖啡酸衍生物,菊苣酸是其中重要的活性成分之一,能抑制透明质酸酶和抗 H IV-1整合酶[2,3],还具有抗炎,抗病毒[4],抗癌,抗氧化及清除自由基等作用。
菊苣酸有三种手性异构体[5](图 1),天然存在紫锥菊中的为(R,R)-(-)-菊苣酸 (L-菊苣酸),据文献报道,在水溶液中,由于菊苣酸结构中的酚羟基和酯键的存在,菊苣酸很不稳定,容易发生降解或氧化,加入一些添加剂[6]或者特殊储存[7]稳定菊苣酸。文献报道了湿度和温度对菊苣酸稳定性[8]的影响。
本文首次报道了 L-菊苣酸的光致异构化,研究了不同溶剂对其光致异构化的影响。
1 实验部分
1.1 仪器与试剂
Waters 2695液相分离单元 (Waters公司);Micromass ZQ2000质谱仪 (Waters公司);Flexi-DryTMMP冻干机 (美国 FTS systems);Waters Prep LC4000制备色谱仪 (Waters公司);HPD101大孔吸附树脂(河北沧州宝恩化工厂);RE-520旋转蒸发仪 (上海亚荣生化仪器厂);AL204电子分析天平(梅特勒-托尔多);ZF-C型三用紫外分析仪(上海金达生化仪器有限公司)。
4%紫锥菊提取物 (购自长沙九汇现代中药公司);菊苣酸标准品 (美国 Sigma公司);甲醇、乙酸乙酯均为分析纯 (湖南师范大学试剂厂);甲酸、乙腈为色谱纯 (Tedia公司);二次蒸馏水 (Milli Q纯水系统)
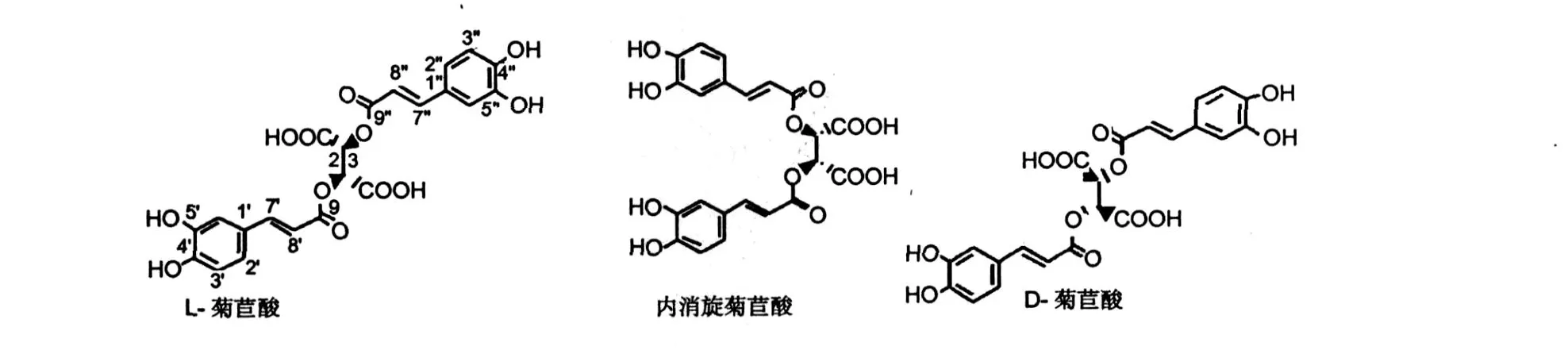
图 1 菊苣酸的三种立体异构体Fig.1 Structure of ciohoric acid isomers
1.2 色谱和质谱条件[9]
色谱柱:Spherigel C18(5μm,200×4.6 mm);检测器及检测波长:Waters 2487 detector,330 nm;进样量 10μL;流动相:A(0.1V甲酸 +100V水)∶B(乙腈)=85∶15;流速 1 mL/min;室温下分析。
质谱扫描模式为负离子模式 ESI-;离子源温度: 110℃;毛细管电压:3.0 kV;锥孔电压:35 V;N2为脱溶剂气体。
1.3 菊苣酸的制备及样品处理
1.3.1 菊苣酸的制备过程
4%紫锥菊提取物的水溶液→大孔吸附树脂HPD101→乙酸乙酯萃取→蒸干得到浸膏→浸膏上制备色谱→冻干产品 (经测定其纯度约为 98%)。
1.3.2 光照产物的制备以及结构鉴定
称取 100 mg L-菊苣酸溶于乙腈中,置于紫外灯下照射,然后用制备液相色谱分离得到其光照产物,经过高效液相色谱色谱测定纯度约为98%。取一定量的L-菊苣酸及其光照产物分别进行核磁共振氢谱测定,另外分别配制 50 mg/mL的菊苣酸及其光照产物的甲醇溶液,用旋光仪测定两者的旋光度。
1.3.3 不同溶剂中的菊苣酸的紫外光照
称取一定量的菊苣酸,分别溶解于水、甲醇、乙腈、四氢呋喃,配制成浓度为 0.2 mg/mL的溶液,分别于 254 nm和 365 nm波长下进行紫外光照射,用HPLC-PDA-MS测定菊苣酸的变化。
2 结果与讨论
2.1 菊苣酸光照产物的结构确定
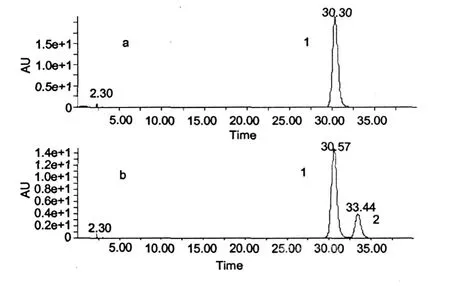
图 2 L-菊苣酸甲醇溶液及其 254 nm紫外光照后的典型色谱图Fig.2 Typical chromatograms of the standard solution of L-cichoric acid(a)in methanol and the resulted solution(b)after irradiated underUV254nm
当把菊苣酸的甲醇溶液置于紫外灯下光照时,短时间内就可以部分地转化成另外一种物质,如图2所示。为了确定生成的光照产物的结构,我们分别对菊苣酸及其光照产物的质谱图、PDA扫描图以及1H NMR图进行了比较分析,表 1给出了峰 1和峰 2的质谱碎片离子和分子离子的相对丰度,我们可以看出,光照产物跟 L-菊苣酸的质谱碎片离子都是一样的,分子离子峰[M-H]-都为 473,只是碎片离子的丰度略有差别,可以初步判定峰 2为菊苣酸的异构体。再对两物质的 PDA光谱扫描图 (图 3)比较,基本上没有差别,可以排除是顺反异构的可能性。最后再对比两者的1H NMR:L-菊苣酸 (500 MHz,DMSO-d6)δ:5.684(s,2H,H-2,H-3),6.349~6.380(d,2H,J=15.5 Hz,H-8′,H-8′′),6.777~6. 793(d,2H,J=8.0 Hz,H-2′,H-2′′),7.079~7.098 (m,4H,H-3′,H-3′′,H-6′,H-6′′),7.545-7.576(d, 2H,J=15.5 Hz,H-7′,H-7′′),9.159(s,2H,C4-OH),9.684(s,2H,C5-OH)。L-菊苣酸的光照产物(500 MHz,DMSO-d6)δ:5.638~5.666(s,2H,H-2, H-3),6.344~6.376(d,2H,J=17 Hz,H-8′,H-8′′),6.771-6.787(d,2H,J=8.0 Hz,H-2′,H-2′′), 7.053-7.094(m,4H,4H,H-3′,H-3′′,H-6′,H-6′′), 7.507~7.537(d,2H,J=15 Hz,H-7′,H-7′′),9.188(s,2H,C4-OH),9.711(s,2H,C5-OH)。从而我们可以确定所产生的新物质为菊苣酸的手性异构体。
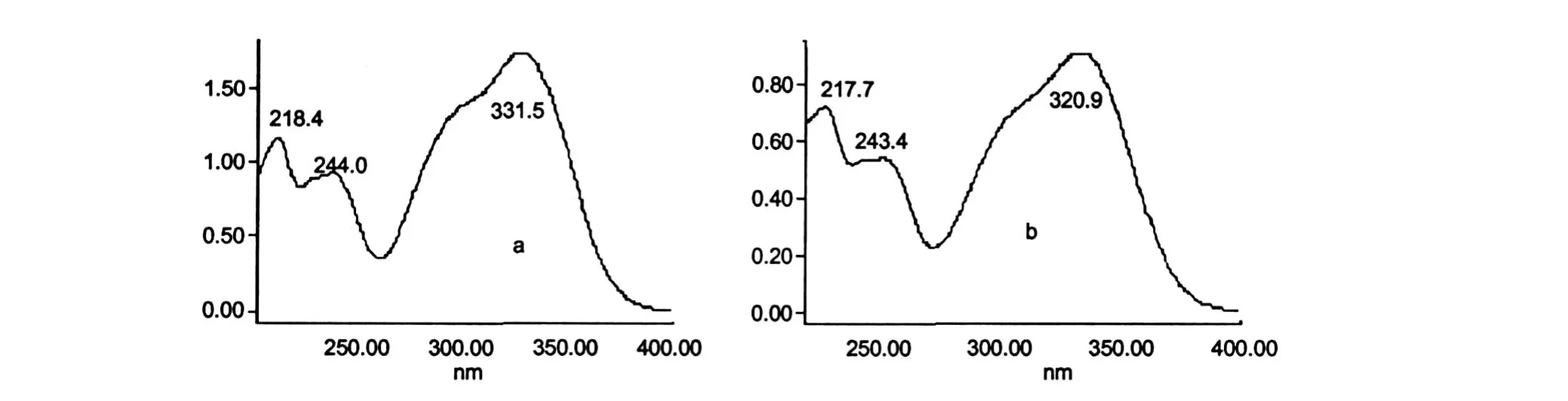
图 3 峰 1和峰2的 PDA光谱图Fig.3 PDA spectrums of peak1(a)and peak2(b)
菊苣酸有三种手性异构体,为了进一步确定这种异构体的构型,我们对其进行了旋光度的测定为:(25℃),测定的结果为:(L-cichoricacid)= -350°,= 0°,文献参考值[10]isomerization product ofL-cichoric acid) =-333°,= + 340°。由此可以确定物质 2为内消旋菊苣酸 (m esochicoric acid),也就是说 L-菊苣酸在紫外光照下可以部分生成它的差向异构体。
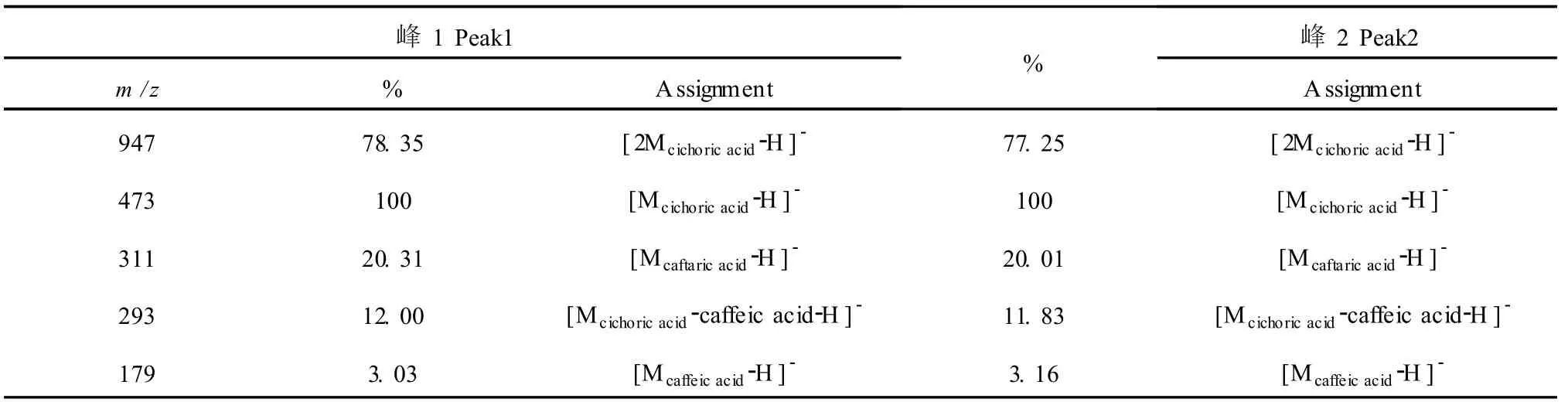
表 1 L-菊苣酸和其光照产物的的 ESI/MS数据Table 1 The negative ion ESI/MS spectrums data of peak 1 and peak 2
2.2 不同溶剂对菊苣酸光致差向异构化的影响
为了进一步研究不同溶剂对菊苣酸光致差向异构化的影响,我们考察了菊苣酸在四种溶剂中的异构化情况以及不同波长(254 nm和 365 nm下)对异构化的影响,如图 4所示,分别为在甲醇、四氢呋喃、乙腈、水中的结果。在 254 nm下,一开始时,随着光照时间的增长。四种溶剂中菊苣酸差向异构体的含量都增大,当光照 1.5 h后,异构体的含量基本上保持不变,异构化反应达到平衡。不同溶剂中,异构化程度差别较大,在水,甲醇,乙腈三种常用的反相色谱溶剂中,随着极性的减小,异构转化率增加。但是在四氢呋喃中,极性减小,异构化转化率小于在甲醇和乙腈中的,水中的最小,达到平衡时异构化率大小顺序为:乙腈 >四氢呋喃 >甲醇 >水。在 365 nm下,光照 0.5 h后就达到了平衡,平衡时的异构化率大小为:乙腈 >甲醇 >四氢呋喃 >水。在同一种溶剂中,波长也影响最后异构化平衡时的转化率,波长越短,异构化程度越高,且在四氢呋喃中两个不同波长下最后的平衡转化率相差较大。
3 结论
在不同溶剂中,L-菊苣酸在紫外光照下都会部分地转化为其差向异构体 (在不同溶剂中异构化情况不一样)。就考察的四种溶剂来说,在 254 nm下,达到平衡时异构化率结果为:乙腈 >四氢呋喃 >甲醇 >水。在 365 nm,则为:乙腈 >甲醇 >四氢呋喃 >水。另外,紫外光照的波长越短,异构化程度越高。
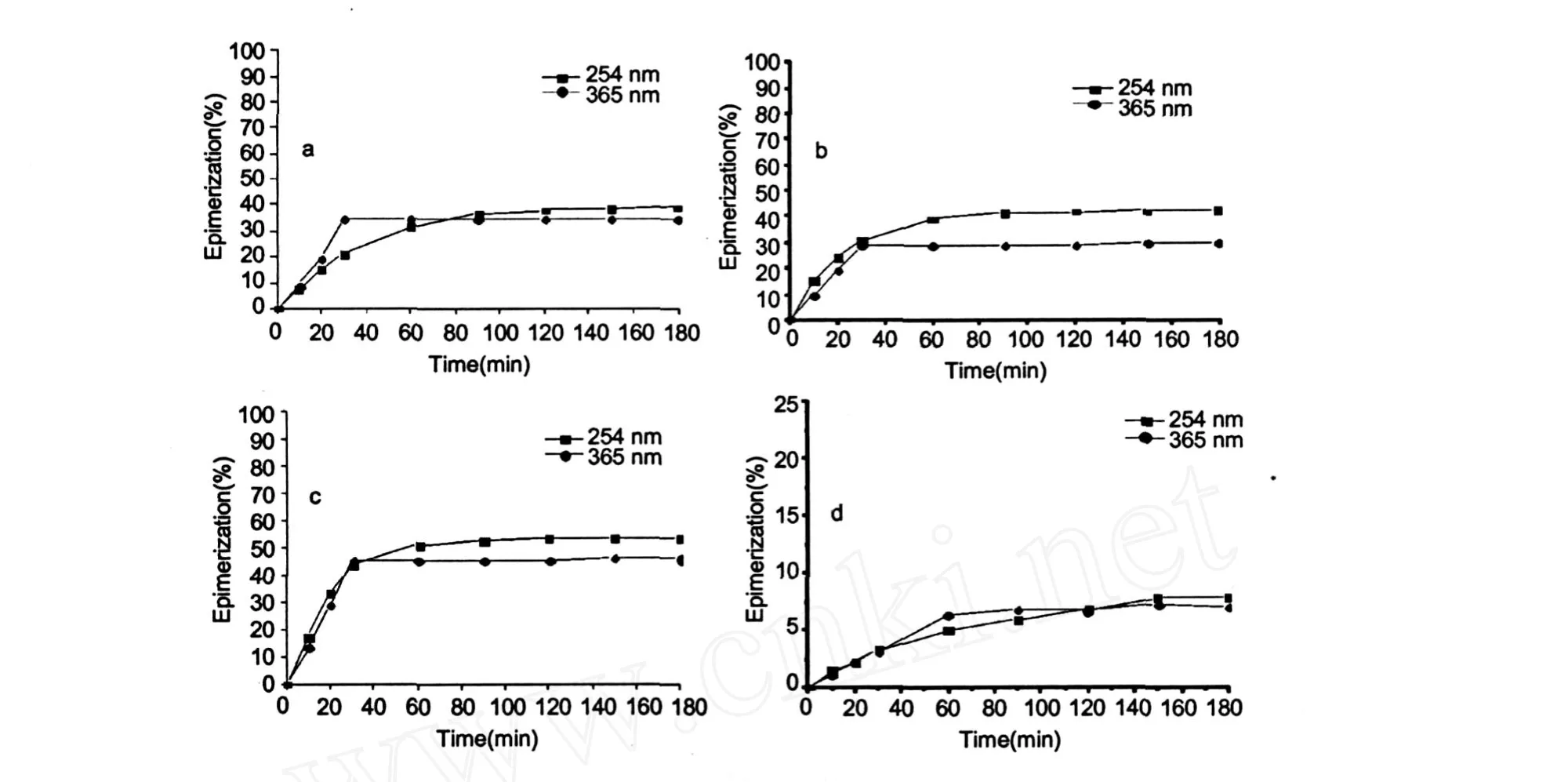
图 4 在不同溶剂中菊苣酸差向异构体含量随光照时间的变化图Fig.4 Relationship between epimerization rates ofL-cichoric acid with irradiation time in different solvents a.甲醇Methanol;b.四氢呋喃 Tetrahydrofuran;c.乙腈Acetonitrile;d.水Water
1 Bauer R. Immunomodulatory agents from plants.Basel,Switzerland:BirkhauserVerlag,1999.41-88.
2 Anni P,Denis B,Etienne S,et al.4-Oxo-ionol and linalool glycosides from raspberryfruits.Phytochem istry,1992,31: 4187.
3 King PJ,RobinsonWEJ.Resistance to the anti-human immunodeficiency virus type 1 (H IV-1)compound,L-chicoric acid results from a singlemutation at amimo acid 140 of integrase.J V irol,1998,72:8420-8424.
4 WackerA,HilmigW.Virushemnug untEchinnacea purpurea(virsus-inhibition by Echinecea purpurea).Planta M edica, 1978,33:89-102.
5 Scarpati ML,Oriente G.Chicoricacid(dicaffeyltartaric acid):its isolation from chicory and synthesis.Tetrahedron, 1958,4:43-48.
6 Nusslein B,Kurzmann M,Bauer R.J Nat Prod,2000,63: 1615-1618.
7 DouglasLS,RonBHW.Effectof drying temperature on alkylamide and cichoric acid.J Agric Food.Chem,2003,51: 1608-1610.
8 ChantalBergeron.J Agric Food Chem,2002,50:3967-3970.
9 Luo XB,Chen B,Yao SZ,et al.Simulaneous analysis of caffeic acid derivatives and alkamides in roots and extracts ofEchinacea purpureaby high perfor mance liquid chromatography-photodiode array detetion-electrospray mass spectrometry.J Chrom atogrA,2003,986(1):73-81.
10 Zhao H,Burke TR.Facile synthesis of(2R,3R)-(-)and (2S,3S)-(+)-chicoric acids.Synthetic comm unications, 1998,28:737-740.
Photoep imerization of L-C ichoric Acid in D ifferent Solvents
XIE Ji-guo,CHEN Bo*,GUO Jian-wei,YAO Shou-zhuo
Key Laboratory of Chem ical B iology&Traditional ChineseM edicine Research, M inistry of Education,Hunan Nor mal University,Changsha 410081,China
The photoepimerization ofL-cichoric acidwas investigated.When the solution ofL-cichoric acidwas irradiated with the UV light,L-cichoric acid was converted to another compound partially.W ith the separation and identification by HPLC-MS,UV spectrum,optical rotation,and1H NMR,the results demonstrated that L-cichoric acid could partially be epimerized tomeso-cichoric acid.The rates of epimerization ofL-cichoric acid in different solvents had significant differences.At 365 nm,the ratio of epimerization at the equilibrium state isordered as follows:acetonitrile>methanol>tetrahydrofuran>water.While at 254 nm,the order is:acetonitrile> tetrahydrofuran>methanol>water.In addition, the ratio of epimerization at 254 nm ismore than that at 365 nm.
L-cichoric acid;m eso-cichoric acid;photoepimerization
R284.1;Q946.91;R932
A
1001-6880(2010)04-0630-04
2008-11-24 接受日期:2009-02-05
国家“973”基金项目(2006CB504701)
*通讯作者 Tel:86-731-8865515;E-mail:dr-chenpo@vip.sina.com

