鱼精蛋白凝聚法测定和厚朴酚脂质体的包封率
刘卫斌,薛彦宁,秦永刚(.陕西榆林市第二医院,榆林市 79000;.陕西中药研究所,咸阳市 7000)
鱼精蛋白凝聚法测定和厚朴酚脂质体的包封率
刘卫斌1*,薛彦宁1,秦永刚2(1.陕西榆林市第二医院,榆林市 719000;2.陕西中药研究所,咸阳市 712000)
目的:建立和厚朴酚脂质体包封率(EE)的测定方法。方法:以反相高效液相色谱法为分析手段,采用鱼精蛋白凝聚法测定和厚朴酚脂质体EE。结果:和厚朴酚检测浓度在2.006~160.512 mg·L-1范围内与峰面积积分值呈良好的线性关系(r=0.999 9),最低检测限和最低定量限分别为1.4、4.0 ng;鱼精蛋白凝聚法的平均回收率为(95.70±2.07)%,RSD=1.71%(n=9);平均EE为85.87%。结论:鱼精蛋白凝聚法操作简单、可行、重现性好,适用于脂溶性药物和厚朴酚脂质体EE的测定。
和厚朴酚脂质体;反相高效液相色谱法;包封率;鱼精蛋白凝聚法
和厚朴酚为木兰科落叶乔木植物厚朴Magnolia officinalisCortex的有效成分,是从厚朴中分离得到的具有生物活性的小分子物质。药理学研究证明,和厚朴酚具有抗氧化[1]、抗焦虑[2]、抗菌[3]、抗血栓形成[4]和抗肿瘤[5~7]的作用。和厚朴酚水溶性差,几乎不溶于注射用水,故影响了其在临床中的应用。将和厚朴酚开发成脂质体剂型,可以解决其难溶问题,提高药物稳定性、载药量、靶向性及疗效。脂质体还可能延长和厚朴酚在体内的循环时间,改善其在体内的吸收及分布。脂质体制备过程中,包封率(EE)是控制质量与筛选处方和工艺条件的重要指标之一。2005年版《中国药典》(二部)规定,脂质体EE不得低于80%[8],所以建立快速、准确的EE测定方法是研制脂质体重要的环节。本研究将以高效液相色谱(HPLC)法为分析手段,采用鱼精蛋白凝聚法测定建立一种简单、准确、可操作性强的测定和厚朴酚脂质体EE的方法。
1 仪器与材料
1.1 仪器
LC2010型HPLC系统(日本岛津公司);AL104型电子天平(瑞士梅特勒-托利多仪器上海有限公司)。
1.2 试药
和厚朴酚对照品(中国药品生物制品检定所,批号:110730-200408,纯度≥99.0%);和厚朴酚原料药(西安融升生物科技有限公司,纯度≥98.0%);磷脂(成都科龙化工试剂厂,纯度≥98.0%);胆固醇(成都科龙化工试剂厂,纯度≥98.0%);聚乙二醇(PEG,成都科龙化工试剂厂,分子量:2 000);鱼精蛋白(美国Sigma公司,批号:YY15284);乙腈为色谱纯,水为重蒸馏水,其余试剂均为分析纯。
2 方法与结果
2.1 色谱条件与系统适用性试验
色谱柱:Phenomenex C18(150 mm×4.6 mm,5 μm);流动相:乙腈-水(65∶35);柱温:25 ℃;流速:1.0 mL·min-1;检测波长:294 nm;进样量:10 μL。理论板数按和厚朴酚色谱峰计算应不低于3 000。色谱见图1。
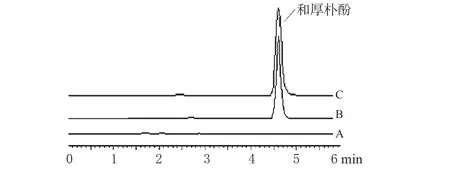
图1 高效液相色谱图A.空白脂质体;B.和厚朴酚脂质体;C.和厚朴酚对照品Fig 1 HPLC chromatogramsA.blank liposomes;B.honokiol liposomes;C.honokiol control
2.2 对照品溶液的制备
精密称取和厚朴酚对照品50.16 mg,置于50 mL棕色容量瓶中,加乙腈溶解并稀释至刻度,摇匀,配成含和厚朴酚浓度为1.003 2 mg·mL-1的对照品溶液,冰箱4℃贮存,备用。
2.3 方法学考察
2.3.1 线性关系考察 精密吸取一定体积的和厚朴酚对照品溶液,用流动相稀释成2.006 4、5.016、10.032、20.064、40.128、80.256、160.512 mg·L-1的溶液,按“2.1”项下色谱条件分别进样。以峰面积积分值(A)为纵坐标,和厚朴酚检测浓度(C,mg·mL-1)为横坐标,制备标准曲线,得回归方程为A=16 400C-2 763(r=0.999 9)。结果表明,和厚朴酚的检测浓度在2.006~160.512 mg·L-1范围内与峰面积积分值呈良好线性关系。
2.3.2 精密度试验 取5.016、20.064、80.256 mg·L-1的和厚朴酚对照品溶液,按“2.1”项下色谱条件于日内(0、2、4、6、8、10 h)各时间点进样分析,测定峰面积积分值,计算日内精密度。结果,3个浓度的RSD分别为0.29%、0.21%、0.15%(n均为6),表明日内精密度良好。取相同浓度的和厚朴酚对照品溶液,按“2.1”项下色谱条件于日间(1、2、3、4、5 d)进样分析,测定峰面积积分值,计算日间精密度。结果,3个浓度的RSD分别为1.92%、0.74%、1.59%(n均为6),表明日间精密度良好。
2.3.3 加样回收率试验 取空白脂质体溶液0.05 mL,置于2 mL EP离心管中,再分别加入7.5、30.0、120.0 μL浓度为1.003 2 mg·mL-1的和厚朴酚对照品溶液,加乙腈分别至1.5 mL,使和厚朴酚检测浓度分别为5.016、20.064、80.256 mg·L-1,超声1 min,12 000 r·min-1离心5 min,取上清液按“2.1”项下色谱条件进样分析,每个浓度平行操作3份,计算加样回收率,结果见表1。
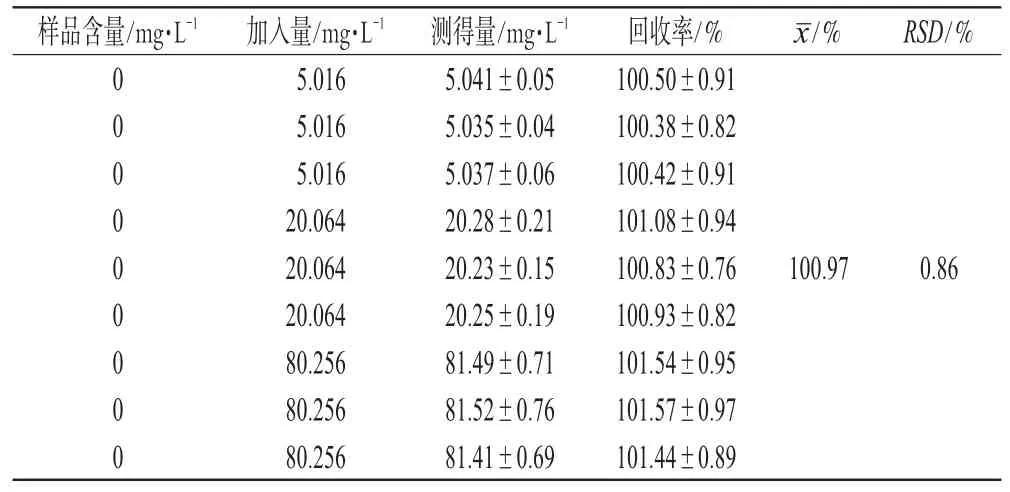
表1 加样回收率试验结果(n=9)Tab 1Results of recovery test(n=9)
2.3.4 最低检测限和最低定量限测定 按“2.1”项下色谱条件,将2.0、1.0、0.5、0.1 mg·L-1的和厚朴酚对照品溶液分别进样10 μL,记录色谱图。采用基线信号与噪声比方法,以信号∶噪声=3∶1时的浓度为最低检测限浓度;照《药品质量标准分析方法验证指导原则》[8],以信号∶噪声=10∶1时的浓度为最低定量限浓度。即最低检测限和最低定量限分别为1.4、4.0 ng。
2.4 和厚朴酚脂质体的制备
采用薄膜超声法,精密称取磷脂-胆固醇-PEG(1∶0.3∶0.08,W/W)/W为总脂,将和厚朴酚-总脂(1∶4)加入到一定量装有甲醇的圆底烧瓶中溶解,减压蒸发成薄膜,加入一定量水进行水化处理,超声处理,即得和厚朴酚脂质体。
2.5 粒径和电位测定
取和厚朴酚脂质体溶液,用超纯水稀释,测定其粒径大小和Zeta电位。结果,平均粒径为93.84 nm,平均电位为-21.8 mV。
2.6 鱼精蛋白凝聚法
采用鱼精蛋白凝聚法分离游离药物与脂质体。用移液枪精密吸取0.1 mL和厚朴酚脂质体于2 mL EP管中,加入10 mg·mL-1的鱼精蛋白溶液0.1 mL,涡旋60 s,静置3 min,加入1 mL生理盐水,混匀,室温下以3 000 r·min-1离心30 min,沉淀脂质体。精密吸取上清液0.1 mL,以流动相稀释后按“2.1”项下色谱条件测定,并计算游离药物含量(C游)。
2.7 鱼精蛋白凝聚法加样回收率试验
配制低、中、高浓度(0.106 1、0.285 6、0.641 5 mg·L-1)的游离和厚朴酚乙醇-水溶液,加入空白脂质体(粒径约为100 nm),得混合脂质体混悬液。取上述脂质体混悬液0.1 mL,添加0.1 mL 鱼精蛋白(10 mg·mL-1),搅匀,静置3 min,加入1.0 mL生理盐水,3 000 r·min-1离心30 min,沉淀脂质体。精密吸取上清液0.1 mL,以流动相稀释后按“2.1”项下色谱条件测定,并计算加样回收率,结果见表2。
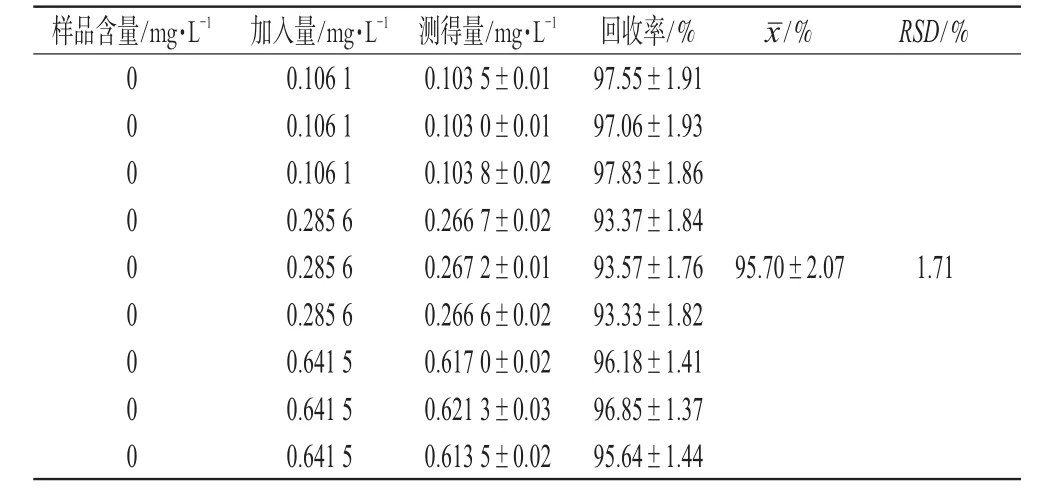
表2 鱼精蛋白凝聚法加样回收率试验结果(n=9)Tab 2 Results of recovery test of protamine aggregation method(n=9)
2.8 和厚朴酚脂质体EE测定
按“2.1”项下色谱条件,测定“2.4”项下制得的和厚朴酚脂质体中和厚朴酚含量(C总),并根据下式计算和厚朴酚脂质体EE:EE=(C总-C游)/C总×100%。结果,和厚朴酚在脂质体中的EE可达到80%以上,平均值为85.87%,详见表2。

表3 和厚朴酚脂质体EE测定结果Tab 3 Encapsulation efficiency of honokiol liposomes
3 讨论
为准确测定脂质体EE,将脂质体和游离药物分离是关键步骤。本试验曾采用SephadexG-50凝胶柱层析法分离脂质体与游离和厚朴酚,因为和厚朴酚不溶于水,当用pH 7.4的PBS进行洗脱时,游离和厚朴酚截留在凝胶柱顶端,待脂质体完全洗出柱子后,截留在柱子顶端的游离和厚朴酚缓慢被洗出凝胶柱,色谱峰很宽且不规则,洗脱时间很长,测定不准确。本试验也曾采用透析法,此法虽操作简单,但耗时较长,且重复性不好,故该方法有待考察。超速离心法对离心机转速要求较高,仪器耗费较大,离心时间通常需要1 h以上,方法成本较高。和厚朴酚水溶性差,而凝胶柱分离法、透析法、超滤法等都是用于分离水溶性药物。为了探讨一种简单、速效、准确的脂质体EE的测定方法,本试验建立了鱼精蛋白絮凝-离心法分离脂质体,以RP-HPLC法为分析手段,测定脂质体药物EE。
鱼精蛋白的最大特点就是碱性氨基酸占有较大比例[9],其等电点为10~12,可溶于水和稀酸,热稳定性较好。本文所用鱼精蛋白是鲑鱼精蛋白(salmine),约含2/3以上的精氨酸。精氨酸是一种含有胍基的碱性氨基酸,带正电,正是由于这些带有正电荷的胍基的大量存在,多聚阳离子鱼精蛋白会与带负电或中性的脂质体产生絮凝作用,常规离心即可将脂质体和游离药物分离。因此,它是一种针对脂质体电荷性质的凝聚离心法,具有快速、可操作性强的优点。鱼精蛋白凝聚法的适用范围比较广泛,可以测定不同溶解性质药物脂质体的EE,但此法也存在一定的局限性:脂质体的Zeta电位对鱼精蛋白凝聚法测定脂质体EE有一定影响,它更适于中性或负电荷脂质体的分离。
[1]Ogata M,Hoshi M,Shimotohno K.Antioxidant activity of magnolol,honokiol,and related phenolic compounds[J].J Am OilChem Soc,1997,74(5):557.
[2]Kuribara H,Kishi E,Hattori N.Application of the elevated plus-maze test in mice for evaluation of the content of honokiol in water extracts of magnolia[J].Phytother Res,1999,13(7):593.
[3]Syu WJ,Shen CC,Lu JJ,et al.Antimicrobial and cytotoxic activities of neolignans from Magnolia officinalis[J].Chem Biodivers,2004,1(3):530.
[4]Pyo MK,Lee Y,Yun-Choi HS.Anti-platelet effect of the constituents isolated from the barks and fruits of Magnolia obovata[J].Arch Pharm Res,2002,25(3):325.
[5]Yang SE,Hsieh MT,Tsai TH,et al.Downmodulation of Bcl-XL,release of cytochrome c and sequential activation of caspases during honokiol-induced apoptosis in human squamous lung cancer CH27 cells[J].Biochem Pharmacol,2002,63(9):1 641.
[6]Wang T,Chen F,Chen Z,et al.Honokiol induces apoptosis through p53-independent pathway in human colorectal cell line RKO[J].World J Gastroenterol,2004,10(15):2 205.
[7]Hirano T,Gotoh M,Oka K.Natural flavonoids and lignans are potent cytostatic agents against human leukemic HL-60 cells[J].Life Sci,1994,55(13):1 061.
[8]Bai X,Cerimele F,Ushio-Fukai M,et al.Honokiol,a small molecular weight natural product,inhibits angiogenesis in vitro and tumor growth in vivo[J].J Biol Chem,2003,278(37):35 501.
[9]国家药典委员会编.中华人民共和国药典(二部)[S].2005年版.北京:化学工业出版社,2005:附录181、附录172.
[10]Sun P,Wang ZH ,Zheng MX.The research of protamine and application in food industry[J].Food Res Develop,2003,4(2):15.
Determination of Encapsulation Efficiency of Honokiol Lipsomes by Protamine Aggregation Method
LIU Wei-bin,XUE Yan-ning(Yulin Municipal Second Hospital of Shaanxi Province,Yulin 719000,China)
QIN Yong-gang(Shaanxi Institute of Chinese Materia Medica,Xianyang 712000,China)
OBJECTIVE:To establish a method for the determination of encapsulation efficiency(EE)of honokiol liposomes.METHODS:RP-HPLC method was adopted for the analysis of honokiol liposomes.Protamine aggregation method was applied to determinate the encapsulation efficiency of honokiol liposomes.RESULTS:The linear range of honokiol was 2.006~160.512 mg·L-1.The limits of detection and quantitation were 1.4 ng and 4.0 ng,respectively.The mean recovery rate of protamine aggregation method was(95.70±2.07)%(RSD=1.71%,n=9).The mean encapsulation efficiency of honokiol liposomes was 85.87%.CONCLUSION:The protamine aggregation method is simple,practical and reproducible for determination of the encapsulation efficiency of honokiol liposomes.
Honokiol liposomes;RP-HPLC;Encapsulation efficiency;Protamine aggregation method
R283.2;283.69
A
1001-0408(2010)39-3695-03
*主任药师。研究方向:中药学。电话:0912-3362085。E-mail:leibaolin@163.com
2010-06-16
2010-08-27)

