Humanin对STZ诱导培养的皮层神经细胞损伤的保护作用1)
马国英,杨小荣,赵 欣,赵晋枫,秦华平,史瑞红,张 策
链脲佐菌素(STZ)是一种烷基化物,脑室注射STZ可以导致正常大鼠出现阿尔茨海默病(AD)样的病理退行性变化,如线粒体功能异常、神经元死亡、学习记忆与认知的障碍等[1]。在离体神经细胞培养中可以引起细胞活力的下降,活细胞数目的减少,乳酸脱氢酶(LDH)的释放增加。其机制可能是削弱或破坏胰岛素的信号转导,破坏胰岛素受体的自身磷酸化和内在酪氨酸激酶活性,增加磷酸化酪氨酸磷酸酶的活性[1]。导致胰岛素信号传导障碍,引起葡萄糖代谢紊乱和能量生成受阻。
Humanin(HN)是在AD病人大脑内发现的由24个氨基酸组成的线性多肽[2],能够有效抑制多种 FAD(Family Alzheimer’s disease)基因突变和 Aβ衍生物诱发的神经毒作用,初始被认为是 AD特异性或AD相关毒性的神经保护肽。抑制APP、PS1、PS2突变诱发的神经元死亡,拮抗Aβ完整肽链以及Aβ片断诱导的神经毒作用[3]。HN的作用机制还不清楚,但随着科学研究的逐步深入研究发现,HN可以拮抗NMDA所致的兴奋毒[4],拮抗缺氧所致的皮层神经元损伤[5],拮抗OA通过诱导tau蛋白过度磷酸化所致的神经毒[6]。提示HN具有广泛的神经保护作用,我们前期实验已经证实STZ对离体培养的神经细胞有损伤作用,本实验旨在探讨HN是否对STZ的神经损伤有保护作用。
1 材料与方法
1.1 实验动物和试剂 神经细胞培养应用新生1 d~3 d的Wistar大鼠,雌雄不限。STZ、Calcein-AM 购于Sigma公司,HN由上海生工合成胎牛血清(FBS)购于杭州四季青公司,将STZ溶于D-Hanks溶液中,配成 10 mmol/L的母液,由于STZ溶液的半衰期在生理pH值条件下为19 min[7],需要溶解后立即使用。HN溶于三蒸水,配成 1 mmol/L的溶液,0.2 μ mol/L滤器过滤除菌,分装,-20℃保存待用。
1.2 原代皮层神经细胞培养 用新生1 d~3 d的Wistar大鼠,将大脑皮层神经细胞分离成单细胞悬液,经1 000 r/min离心5 min,按细胞的浓度为1×106/L接种于96孔板或培养皿中,放在37℃,5%CO2培养箱中培养。
1.3 实验分组 神经细胞培养到第7天时,将培养的神经细胞随机分组:由于中枢的胰岛素主要来自两方面,由胰岛产生即外周血浆中的胰岛素透过血脑屏障进入中枢和神经组织自身合成的胰岛素[5],为了更好的模拟在体的情况,所以在实验中都加入胰岛素15 μ U/mL。对照组、STZ组以全培液培养;HN组加入终浓度分 别为 0.1 μ mol/L、1 μ mol/L、10 μ mol/L、100 μ mol/L 的HN,16h后除了对照组以外,其他组都加入STZ(100μ mol/L)。在他们共同作用 36 h后观察细胞的活力以及活细胞数目(LDH,CCK-8和Calcein-AM染色)。
1.4 细胞活力分析 在96孔板中培养的皮层神经细胞经提前16 h加入 HN,再经STZ诱导36 h后,换新的全配液,每空加入10μ L的CCK-8,37℃避光培养2 h,到酶标仪上测定450 nm吸光度值。
1.5 LDH释放的检测 将皮层神经细胞培养在培养皿中,经提前16 h加入HN,再加入STZ诱导36 h后,收集细胞培养液进行LDH活性的检测。
1.6 Calcein-AM染色 将神经细胞培养在有玻片的培养皿中,经提前16 h加入 HN,再加入STZ诱导 36 h后,用 PBS液冲洗3次,加入终浓度为10 μ mol/L的 Calcein-AM,37℃避光培养20 min,再经PBS避光洗涤3次后,在激光共聚焦显微镜(Olympus,FV-1000)下观察细胞,激发波长为490 nm,发射波长为515 nm拍片。
1.7 统计学处理 由SPSS13.0统计软件进行统计分析,数据用均数±标准差(±s)表示,进行单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 CCK-8的测定 STZ组与对照组比较,细胞活力明显下降,STZ组由对照组的 100%降至45.56%(P<0.01);提前16 h加入HN(0.1μ mol/L)不能抑制STZ引起的细胞活力下降(P>0.05),1 μ mol/L HN可以拮抗由STZ引起的细胞损伤,细胞活力升高了 28.47%(P <0.05),10 μ mol/L 、100 μ mol/L HN细胞活力升高了48.47%、53.04%(P<0.01)。详见图1。
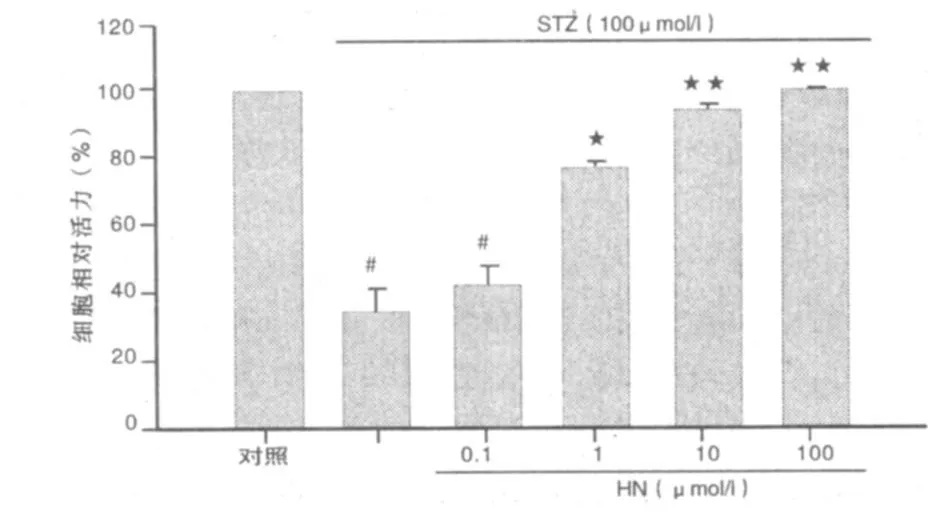
图1 HN保护STZ诱导皮层神经细胞的损伤作用(CCK-8检测)
2.2 Calcein-AM染色 STZ处理后,活细胞的数量明显减少,伴有突起的数目明显减少;提前加入 HN(0.1 μ mol/L)不能抑制STZ引起的活细胞数目减少;提前加入 HN(1 μ mol/L)可以减少STZ引起的活细胞数目减少,和突起数目有所增加,HN(10 μ mol/L、100 μ mol/L)明显的抑制STZ引起的活细胞数目减少,而且突起数目更加明显。
2.3 LDH释放的检测 STZ组与对照组比较,LDH的含量明显增加,释放量增加52.75%(P<0.01),0.1 μ mol/L HN不能抑制STZ引起的细胞损伤,使LDH的释放减少9.36%(P>0.05);1 μ mol/L HN可以降低有 STZ引起的细胞损伤,使LDH的 释放减少18.76%(P<0.05);10μ mol/L、100μ mol/LHN可以明显降低由STZ引起的细胞损伤,使LDH的释放减少21.05%和23.65%(P<0.01)。详见图2。
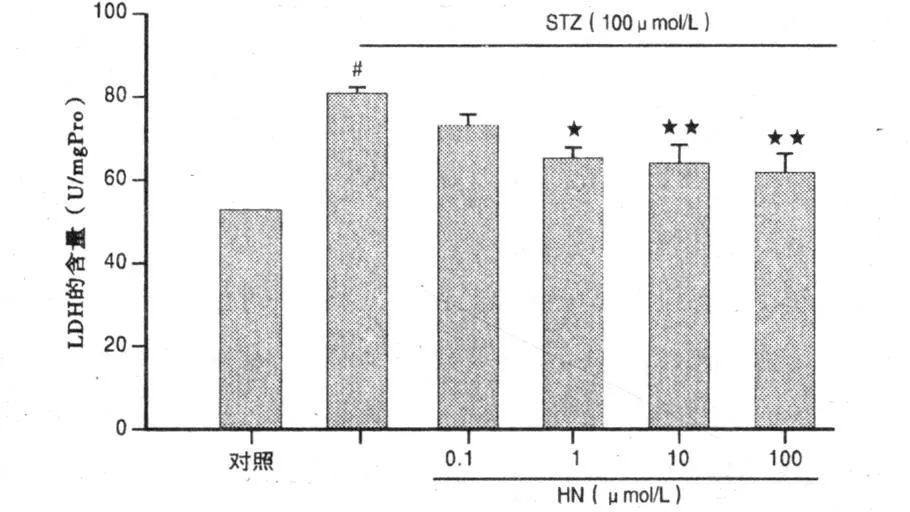
图2 HN保护STZ诱导皮层神经细胞的损伤作用(LDH释放水平检测)
3 讨 论
中枢胰岛素主要由胰岛产生即外周血浆中的胰岛素透过血脑屏障进入中枢,然而研究发现神经组织自身也可以合成胰岛素并参与代谢调节而发挥作用[8]。此外研究显示胰岛素受体在脑内皮层、海马等与认知功能密切相关的区域分布较密集。胰岛素通过它与细胞膜上的胰岛素受体(IR)相结合,通过胰岛素信号转导过程激发细胞内特定的生理生化反应。
研究证实,糖代谢紊乱和AD发病机制有密切的联系,尤其在晚发性AD中,糖代谢紊乱可能是重要的始动因子。多种证据显示脑内糖代谢障碍可以引起认知功能受损,而认知功能障碍为主的AD常伴有脑内糖代谢障碍。由于糖代谢紊乱(糖尿病)与AD间有着非常密切的联系,有可能存在同样的发病因素和病理过程,因而有专家提出AD可能是一种大脑特异的神经内分泌疾病或者称“3型糖尿病”[9]。
HN是一个由24个氨基酸组成的线性多肽,在AD病人未受损的脑区发现,具有很强的神经保护作用。初始认为HN是AD特异性的神经保护因子,因为研究发现HN主要抑制与AD发病和病理变化密切相关的一些毒性因素,如HN可以抑制APP、PS1、PS2突变诱发的神经元死亡,拮抗Aβ完整肽链及Aβ片断诱导的神经毒作用。但随着研究的深入发现,HN可能具有较广泛的神经保护作用。我们前期的实验观察也证实HN可以拮抗缺氧导致的神经损伤,拮抗NMDA引起的神经损伤。因此HN可能不像研究者提出的那样,只是一种特异的针对AD损伤的神经保护因子,而有可能是一个广谱的神经保护因子。本实验以离体神经细胞培养的方法证实HN可拮抗STZ对培养的神经细胞产生的毒性作用,包括细胞活力的逐渐增加,LDH的释放逐渐增少,以及活细胞数目的逐渐增加,并有剂量依赖性的保护作用。本实验结果为HN作为广谱神经保护因子提供了新的证据。由于HN具有的强大的和较为广泛的神经保护作用,因而可能在神经退行性疾病包括AD的防治都具有重要意义。HN可拮抗STZ诱导的培养神经细胞损伤,发挥神经保护作用。
[1] Steen E,T erry BM,Rivera EJ,et al.Impaired insulin and insulinlike growth factor expression and signaling mechanisms in Alzheimer’s disease is this type 3 diabetes[J].J Alzheimers Dis,2005,7:63.
[2] Hashimoto Y,Niikura T,Tajima H,et al.A rescue factor abolishing neuronal cell death by a wide spectrum of familial Alzheimer’s disease genes and Aβ[J].Proc Natl Acad Sci USA,2001,98:6336-6341.
[3] Hashimoto Y,Ito Y,Niikura T,et al.M echanism of neuropretection by a novel rescue factor humanin from Swedish mutant amyloid precursor protein[J].Biochem Biophys Res Commun,2001,283:460-468.
[4] 崔爱玲.Humanin拮抗NMDA诱导的兴奋性神经毒的作用观察[D].山西医科大学博士学位论文,2007.
[5] 赵珅婷.Humanin保护培养皮层神经元缺氧性作用损伤作用的观察[D].山西医科大学硕士学位论文,2006.
[6] 赵晋枫.Humanin拮抗冈田酸通过诱导T au蛋白过度磷酸化所致神经毒的作用研究[D].山西医科大学硕士学位论文,2007.
[7] Muller D,Nitsch RM,Wurtman RJ,et al.Streptozotocin increases free fatty acids and decreases phospholipids in rat brain[J].J Neural Transm,1998,105:1271-1281.
[8] 盛树力.老年性痴呆及相关疾病[M].北京:科学技术文献出版社,2006:226-266.
[9] Sun M K,Alkon DL.Links between Alzheimer’s disease and diabetes[J].Drugs Today(Barc),2006,42:481.

