补肾健脾方对AD大鼠AchE、ChAT及海马神经元凋亡的影响
杨 帆,张 洪,许 旌,刘莹露
阿尔茨海默病(AD)是一种中枢胆碱能神经系统退行性疾病,目前确切病因尚不清楚,但β淀粉样肽诱导的乙酰胆碱酯酶(AchE)、胆碱转移酶(ChAT)的活性改变及神经细胞凋亡的病理机制被广泛接受。乙酰胆碱酯酶抑制剂(AchEIs)通过抑制AchE的活性,恢复乙酰胆碱(Ach)的正常水平,提高胆碱能神经元的兴奋性,从理论和临床均已证明是有效的。而可减少神经元凋亡的中药制剂脑灵汤[1]及葛根素[2]已证明能显著改善AD大鼠的学习及记忆能力。本实验通过检测血清及脑组织中AchE及ChAT活性以及对海马神经元凋亡形态、调控蛋白的观察,探讨补肾健脾方对阿尔茨海默病的治疗机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康清洁级SD雄性大鼠60只,3月龄~4月龄,体重250 g~300 g。由南京大学医学院动物实验中心提供。饲养条件:清洁级,室内温度18℃~22℃,相对湿度 50%~70%,自由摄取水、食物。购入后适应性饲养1周后进行实验。1.1.2 药物 补肾健脾复方制剂的主要成分是薏苡仁、淫羊藿等。采用不含赋形剂的浸膏,由江苏省中医院制剂室制备,批号20060721,每毫升含原药0.9 g,药物4℃保存。
1.1.3 主要试剂和仪器 乙酰胆碱酯酶、胆碱转移酶的测定试剂盒及双缩脲蛋白测定试剂盒购自南京生兴生物公司,UV-722紫外分光光度计购自上海第三分析仪器厂,80-1型离心沉淀机由上海手术器械厂提供。
1.2 方法
1.2.1 阿尔茨海默病模型的制备 腹腔注射氯胺酮25 mg/kg麻醉大鼠后,固定头颅,以前囟为基点,后移 0.5 mm,旁开 2.8 mm,以牙科钻钻开颅骨,双侧各注射鹅膏蕈氨酸(IBO)1 μ L(每侧注射时间5 min,留针5 min)。假手术组同样方法注射同体积生理盐水。
1.2.2 分组及给药 注射IBO后存活大鼠共27只,随机分为模型组、补肾健脾复方制剂小剂量组(小剂量组)、补肾健脾复方制剂大剂量干预组(大剂量组)。假手术组9只大鼠全部存活,正常组预留大鼠8只。大剂量组灌服药物浓度为7.2 g/(kg◦d),小剂量组灌服药物浓度为3.6 g/(kg◦d),假手术组、模型组及正常组灌服同体积生理盐水,连续4周。
1.2.3 取材及标本采集 各组大鼠以2%的戊巴比妥60 mg/kg麻醉,取血后断头取海马组织,部分液氮速冻后-80℃保存,部分用多聚甲醛固定后行冠状切片,剩余组织用戊二醛固定后行电镜检查。
1.2.4 行为学实验方法 采用Morris水迷宫。包括定位航行试验:分别从池壁四个起始点将大鼠面向池壁放入池中,测其120 s内成功进驻平台所需时间,如在120 s内大鼠不能成功进驻平台,则实验者将其引上平台并令其停留10 s,记录逃避潜伏期为120 s。空间探索试验:试验最后1 d撤除平台,从原平台象限对侧池壁中点将大鼠放入水中,记录大鼠120 s内跨越原平台位置的次数。
1.2.5 AchE、ChAT活性的检测 将血清及海马组织匀浆后稀释,测定总蛋白浓度。按试剂盒步骤设定空白对照管及测定管,检测样品反应体系混匀后用412 nm波长测定吸光度。按公式测得AchE、ChAT的活性。
1.2.6 Bax、Bcl-2蛋白的检测 免疫组化用 SP法。1∶400稀释一抗,按SP试剂盒进行操作,行DAB染色。阴性对照采用抗体稀释液代替一抗进行顺序操作,未见细胞着色。每只实验大鼠取10张切片,光镜下每张切片分别计数4个视野的阳性细胞。取平均数作为阳性细胞计数。
1.2.7 细胞凋亡形态学观察 通过电镜对各组大鼠的细胞器结构,尤其是细胞核的变化进行观察。
2 结 果
2.1 各组大鼠的行为学改变(见表1) 模型组大鼠平均逃避潜伏期较正常组及假手术组明显延长(P<0.05);大、小剂量组平均逃避潜伏期较模型组明显缩短(P<0.05)。撤除平台后的空间探索试验中,模型组大鼠多在平台所在的象限外游泳,而其他大鼠运动轨迹多位于原平台所在象限。模型组大鼠跨越原平台位置次数较正常组及假手术组明显延长(P<0.05);大、小剂量组跨越原平台位置次数较模型组明显缩短(P<0.05),大剂量组的平均潜逃时间明显短于小剂量组。
表1 各组大鼠的行为学改变( ±s)

表1 各组大鼠的行为学改变( ±s)
组别 鼠数 平均逃避潜伏期s跨越原平台位置次数次正常组 8 4.31±0.68 7.33±0.33模型组 9 21.50±11.001) 3.75±0.481)假手术组 9 2.25±1.30 7.00±1.00小剂量组 9 5.31±1.402) 7.14±0.402)大剂量组 9 2.41±0.322)3) 6.67±0.672)与正常组及假手术组比较,1)P<0.05;与模型组比较,2)P<0.05;与小剂量组比较,3)P<0.05
2.2 各组大鼠血清及海马匀浆中AchE、ChAT活性的比较(见表2) 与对照组及假手术组比较,模型组大鼠海马匀浆及血清中AchE的活性显著升高,但ChAT活性明显下降(P<0.05)。与模型组比较,大、小剂量组大鼠血清及海马匀浆中AchE活性下降,ChAT活性上升(P<0.05)。大剂量组对ChAT的作用优于小剂量组。
表2 各组大鼠血清及海马匀浆中AchE、ChA T活性的比较( ±s)
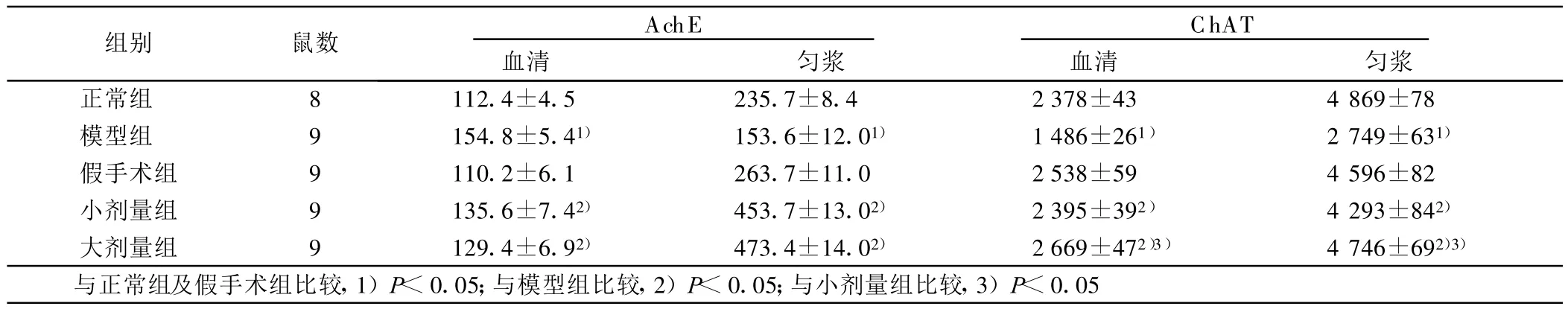
表2 各组大鼠血清及海马匀浆中AchE、ChA T活性的比较( ±s)
组别 鼠数 AchE血清 匀浆ChAT血清 匀浆正常组 8 112.4±4.5 235.7±8.4 2 378±43 4 869±78模型组 9 154.8±5.41) 153.6±12.01) 1 486±261) 2 749±631)假手术组 9 110.2±6.1 263.7±11.0 2 538±59 4 596±82小剂量组 9 135.6±7.42) 453.7±13.02) 2 395±392) 4 293±842)大剂量组 9 129.4±6.92) 473.4±14.02) 2 669±472)3) 4 746±692)3)与正常组及假手术组比较,1)P<0.05;与模型组比较,2)P<0.05;与小剂量组比较,3)P<0.05
2.3 各组大鼠海马中Bax、Bcl-2蛋白表达的比较(见表3)AD大鼠海马中Bax阳性神经元数量较正常组及假手术组增加(P<0.05),而Bcl-2阳性神经元数量则有所减少(P<0.05)。与模型组比较,大、小剂量组Bax阳性神经元数量显著减少(P<0.05),Bcl-2阳性神经元数量明显增加。大、小剂量组之间无统计学意义。
表3 各组大鼠海马中阳性神经元数量的比较( ±s)
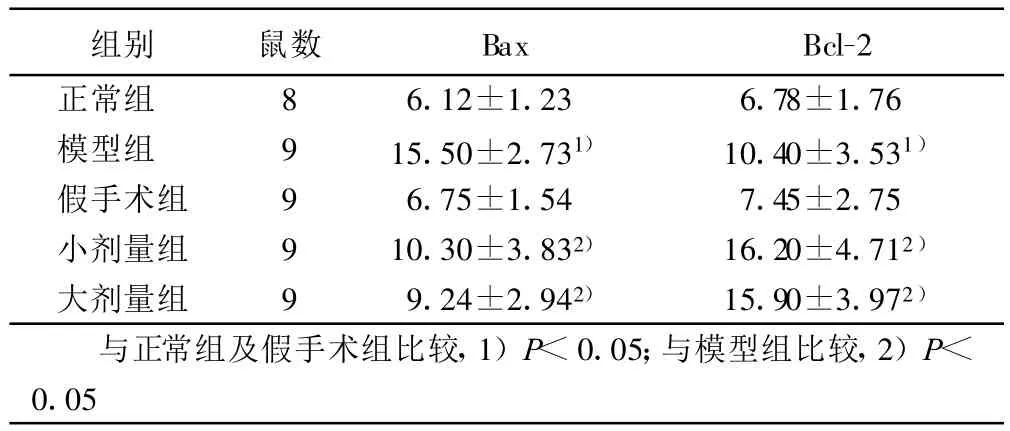
表3 各组大鼠海马中阳性神经元数量的比较( ±s)
组别 鼠数 Bax Bcl-2正常组 8 6.12±1.23 6.78±1.76模型组 9 15.50±2.731) 10.40±3.531)假手术组 9 6.75±1.54 7.45±2.75小剂量组 9 10.30±3.832) 16.20±4.712)大剂量组 9 9.24±2.942) 15.90±3.972)与正常组及假手术组比较,1)P<0.05;与模型组比较,2)P<0.05
2.4 电镜观察 模型组大鼠海马中细胞核膜增厚,核形态不规则,核内染色质浓缩,高尔基复合体和尼氏体减少,脂褐素沉着,部分线粒体肿胀或呈空泡样变性。而正常组、假手术组、大剂量组、小剂量组大鼠的海马细胞中均未见以上细胞凋亡的形态学改变。
3 讨 论
近年来研究表明,AD病人早在出现临床症状或典型病理改变之前数年,脑组织中即开始出现β淀粉样蛋白(Aβ)的蓄积[3]。Aβ是由淀粉样蛋白前体蛋白裂解产生的一个片段,含有39个~43个氨基酸,对神经元具有毒性作用。是诱发AD各种病理生理机制中的共同通路,是AD形成和发展的关键因素。其神经毒性包括激活细胞自身基因程序引起神经元凋亡[4]、影响生物酶导致胆碱能神经元退化两个方面。
胆碱能系统以Ach为主要神经递质,其生理作用主要通过两种生物酶起作用。其中ChAT是Ach的生物合成酶,存在于胆碱能神经元中,是衡量胆碱能神经元功能的标志[5];而AchE可水解Ach,在AD病人脑组织中的总体活性下降,但在Aβ板块内及周围组织中的AchE活性却异常增加。其机制可能为Aβ的直接刺激,或是高浓度 Aβ诱导细胞凋亡表达了过多的AchE所致[6]。病人脑内ChAT活性下降及AchE活性增高是引起胆碱能神经元功能退化的主要原因之一,因此被认为是AD的标志性生化特征[7]。
除改变ChAT和AchE的活性外,Aβ还可以通过调节原癌基因、死亡受体、细胞色素酶及增加细胞内Ca2+的浓度等多种因素激活细胞凋亡引起神经元的功能减退[8,9]。其中对原癌基因Bcl-2及Bax的调节为最主要的途径之一。Bcl-2基因广泛存在于大脑皮层和海马组织中,其表达产物Bcl-2具有抗凋亡作用,其在AD脑中的表达较高,是通过抗氧化作用对细胞起保护作用。而Bax基因的表达产物具有促进凋亡的作用,在体内与Bcl-2形成二聚体而失活,从而抑制细胞凋亡。在正常人脑组织中Bax/Bcl-2形成平衡体系,而AD病人脑组织中则Bax表达上调,Bcl-2表达下降,可促进神经元凋亡,加速神经纤维缠结的形成。
本实验结果提示 AD大鼠模型大脑海马组织中 AchE、ChAT的活性改变,Bax/Bcl-2的表达失调及大量细胞凋亡,这可能由于Aβ在海马部位沉积较多有关,与AD病人死后大脑海马凋亡神经元凋亡明显增高的研究[10]相符。补肾健脾复方制剂大、小剂量干预组AchE活性下降、ChAT活性上升及Bax/Bcl-2表达趋向平衡,提示这三种调节方式可能为补肾健脾方对阿尔茨海默病的治疗机制。
[1] 何明大,刘运林.脑灵汤对阿尔茨海默病模型鼠凋亡调控基因的影响[J].中国现代医学杂志,2005,15(22):3398-3401.
[2] 鲁国,闫福岭.葛根素对Aβ25-35所致阿尔茨海默病模型大鼠脑内神经元凋亡的影响[J].江苏中医药,2005,26(4):53-55.
[3] Smith-Swintosky VL,Mattsion MP.Glutamate β-amyloid precursor proeins,and calcium mediated neurofibrillary degenerationg[J].J Neural T ranusm,1994,44(suppl):29-44.
[4] Pereira C,Ferreiro E,Cardoso SM,et al.Cell degeneration induced by amyloid-beta peptides:Implications for Alzheimer’s disease[J].J M ol Neurosci,2004,23(1-2):97-104.
[5] Gil-Bea FJ,Garcia-Alloza M,Dominguesz J,et al.Evaluation of cholinergic markers in Alzheimer’s disease and in a model of cholinergic deficit[J].Neurosci Lett,2005,375(1):37-41.
[6] Sbema G,Saezvalero J,Li QX,et al.A cety lcholinesterase is increased in the brain of transgenic mice expressing the C-teminal fragment of the beta-amyloid protein precursor of Alzheimer’s disease[J].J Neurochem,1998,71(2):723-731.
[7] 李晓光,郭玉璞.阿尔茨海默病的最新研究进展[J].中国实用内科杂志,2000,20(12):708-709.
[8] Stankov B,Reiywe RJ.Melatonin receptors current status,facts,and hypothese[J].Life Sci,2001,46(14):971-973.
[9] Yuan J,Yankner BA.Apoptotic in the nervous system[J].Nature,2000,407:802-809.
[10] 许浩,胡详友,秦松,等.阿尔茨海默病脑海马凋亡神经元发生率增高[J].中国神经科学杂志,2002,18(1):462-465.

