安心颗粒对心力衰竭大鼠血清一氧化氮及心肌JAK蛋白表达的影响1)1
江 雪,方显明
一氧化氮合酶(nitric oxide synthase,NOS)是催化一氧化氮(nitric oxide,NO)合成的关键酶。有研究表明[1],NO与慢性心力衰竭(chronic heart failure,CHF)的发生发展有关。Junus激酶-信号转导子与转录激活子通路(Junus kinnases-signal transducer and activators of transcription,JAK-STAT)是CHF发病的重要机制之一。而目前JAK1被认为是JAKs家族中激活STAT通路的主要激酶[2]。但NO与JAK1关系的研究鲜见报道。本研究拟通过动物实验,探讨CHF过程中NO与JAK1的关系及安心颗粒干预的作用。现报道如下。
1 材料与方法
1.1 材料
1.1.1 动物 清洁级SD大鼠72只,雌性,体重(180±20)g,由广西医科大学实验动物中心提供(许可证号:SCXK桂2003-0003)。
1.1.2 药物与试剂 药物:安心颗粒[每包3.5 g,含生药4.5 g,由培力(南宁)药业有限公司提供,批号 060301];卡托普利片(每片25 mg),由湖南湘雅制药有限公司生产,批号0710104;盐酸阿霉素(adriamycin,ADR)粉针,由浙江海正药业有限公司生产,批号071101A。试剂:JAK1多克隆抗体(一抗),羊抗兔多克隆抗体(二抗)均购于美国 SANTA CRUZ公司。NO、NOS试剂盒购于南京建成生物工程研究所。
1.1.3 仪器 BL-420E+生物信号采集系统(成都泰盟科技有限公司);高速冷冻离心机5810R型(德国 Eppendorf公司);凝胶成像分析系统(美国ALPHA公司);基础电泳仪、垂直电泳槽、可编程高压电泳仪Power3000、电转槽153BR53477(美国BIO-RAD公司);全自动酶标仪(奥地利CliniBio公司)。
1.2 方法
1.2.1 动物模型制备 参照文献[3]方法,将注射用阿霉素粉针用灭菌生理盐水5 mL溶解,生理盐水稀释配成每l mL生理盐水含药0.8 mg溶液,1周~3周按3 mg/kg剂量给模型组和用药组大鼠行腹腔注射,4周~6周以2 mg/kg剂量,1次/周;正常对照组注射等量的生理盐水,1次/周。均连续注射给药6周。造模过程中观察并记录大鼠表征及行为改变情况。
1.2.2 动物分组与给药 72只SD大鼠随机分为6组:正常对照组(A组)、模型组(B组)、卡托普利组(C组)、安心颗粒小剂量组(D组)、安心颗粒中剂量组(E组)、安心颗粒大剂量组(F组)。每组12只。C组、D组、E组、F组分别给予卡托普利剂量6.25 mg/(kg◦d)、安心颗粒 0.8 g/(kg◦d)、安心颗粒1.2 g/(kg◦d)和安心颗粒1.6 g/(kg◦d)灌胃(药物剂量按动物与人体表面积等量换算),A组、B组予等容生理盐水灌胃,每日1次,共 6周。实验中,室温控制在(20±2)℃,大鼠饮食自由,饮水不限。
1.2.3 心功能指标测定 末次灌胃给药24 h内,大鼠用4%戊巴比妥钠腹腔内注射麻醉,取颈前正中切口,分离颈总动脉,用肝素抗凝的导管经右颈总动脉插入左心室并固定,经压力换能器将导管与微机相连,通过BL-420E+生物机能实验系统进行监测。分别测定心率(HR)、动脉收缩压(SAP)、动脉舒张压(DAP)、左室收缩压(LVSP)、左室舒张期末压(LVEDP)、左室内压变化速率(±dp/dtmax)等指标。然后剖胸取出心脏,PBS液冰浴清洗,用滤纸拭干后称取整个心脏。称重后-80℃保存。心脏质量指数(heart mass index,HMI)按公式计算:HMI=心脏重量(HW)/体重(BW)[4]。
1.2.4 血清NO、NOS测定 于大鼠股动脉取血,经4℃4 000 r/min离心15 min,分离出血清,置于-80℃冰箱中备测。NO和NOS测定用化学比色法,按试剂盒说明书操作。
1.2.5 心肌蛋白质测定 采用Western Blot法,将心肌组织剪碎,加入裂解缓冲液,冰浴下匀浆,4℃12 000 r/min离心15 min,取上清,加入上样缓冲液,用酶标仪测定 A562,根据标准曲线计算出样品蛋白质浓度。总的蛋白提取物经8%SDS-PAGE电泳、将蛋白转移至PVDF膜,然后按照标准蛋白质印迹法与1∶300稀释的抗JAK1多克隆抗体冰上孵育1.5 h后,洗脱,5%脱脂奶粉冰上封闭 1 h,漂洗后加入1∶5 000稀释的二抗,室温下孵育1 h后,洗脱,予化学发光试剂增强反应,X光压片曝光,漂洗显影,用薄层扫描仪测定条带的密度值。
2 结 果
2.1 各组大鼠行为学变化 实验观察到,A组大鼠毛色光泽,双眼灵活有神,行动敏捷,对周围变化灵敏。B组从第2次腹腔注射ADR后出现活动减少、蜷缩、纳食减少、皮毛松软、脱毛、体重减轻等,第4次注射后出现程度不一的腹水,尿少便溏,呼吸减弱,口唇及双耳发绀等,并开始出现死亡。C组、D组、E组、F组从第 3次腹腔注射ADR后逐渐出现活动减少、蜷缩、纳食减少、皮毛松软、体重减轻等,但较B组轻;第5次注射后少数大鼠出现腹水、呼吸减弱,口唇发绀等。实验过程中,存活大鼠共66只。
2.2 各组心功能指标改变 造模6周后,与正常对照组比,模型组 HR、SAP、DAP、LVSP、LVEDP、HMI均增高(P <0.01),而±dp/dtmax均降低(P<0.01),提示左心室后负荷增加、心肌肥厚和心肌收缩力下降已存在,心力衰竭模型造模成功。与模型组比较,各用药组 HR、SAP 、DAP 、LVSP、LVEDP 、HMI均降低(P<0.05或 P<0.01),±dp/dtmax显著升高(P<0.01)。提示安心颗粒与卡托普利相似,有改善心功能的作用。详见表1、表2。
表1 各组大鼠 HR、SAP、DAP、HM I的比较( ±s)

表1 各组大鼠 HR、SAP、DAP、HM I的比较( ±s)
组别 n HR(bp/m) SAP(mmHg) DAP(mmHg) HM I A组 11 347.5±17.7 120.6±7.6 76.2±8.0 3.7±0.2 B组 11 393.7±12.42) 150.2±7.02) 93.7±4.42) 5.1±0.42)C组 11 368.1±12.44) 131.9±7.14) 83.5±7.14) 4.3±0.14)D组 11 369.6±8.34) 135.9±5.04)7) 85.3±4.34)7) 4.3±0.24)8)E组 11 366.2±8.54) 128.0±6.34) 76.9±8.04)5) 3.9±0.24)6)F组 11 389.4±5.26)8) 136.9±5.14)8) 84.9±4.04)7) 4.8±0.43)6)8)与A组比较,1)P<0.05,2)P<0.01;与B组比较,3)P<0.05,4)P<0.01;与C组比较,5)P<0.05,6)P<0.01;与E组比较,7)P<0.05,8)P<0.01
表2 各组大鼠LVSP、LVEDP、±dp/dtmax比较( ±s)

表2 各组大鼠LVSP、LVEDP、±dp/dtmax比较( ±s)
组别 n LVSP(mmHg) LVEDP(mmHg) +dp/dtmax(mmHg/s) -dp/dtmax(mmHg/s)A组 11 158.0±9.4 3.4±2.8 3 352.7±514.1 2 626.4±509.5 B组 11 185.6±15.01) 11.7±3.31) 1 176.2±231.01) 861.9±91.71)C组 11 174.4±8.22) 8.1±2.43) 2 119.7±395.83) 1 830.5±258.03)D组 11 173.2±12.62) 6.6±2.33) 2 401.7±581.93) 2 230.1±486.83)4)5)E组 11 171.3±11.82) 6.8±2.23) 2 102.3±392.63) 1 761.0±443.33)F组 11 170.2±10.02) 5.8±2.13)4) 1 870.1±315.53) 1 428.5±548.83)与A组比较,1)P<0.01;与B组比较,2)P<0.05,3)P<0.01;与C组比较,4)P<0.05;与E组比较,5)P<0.05
2.3 各组血清 NO、NOS浓度比较 B组 NO、NOS血清浓度均高于A组(P<0.01);而C组、D组、E组及F组 NO、NOS浓度均低于 B组(P<0.05或P<0.01),各用药组之间无统计学意义(P>0.05)。详见表3。
表3 各组给药后血清NO、NOS浓度比较( ±s) mmol/L
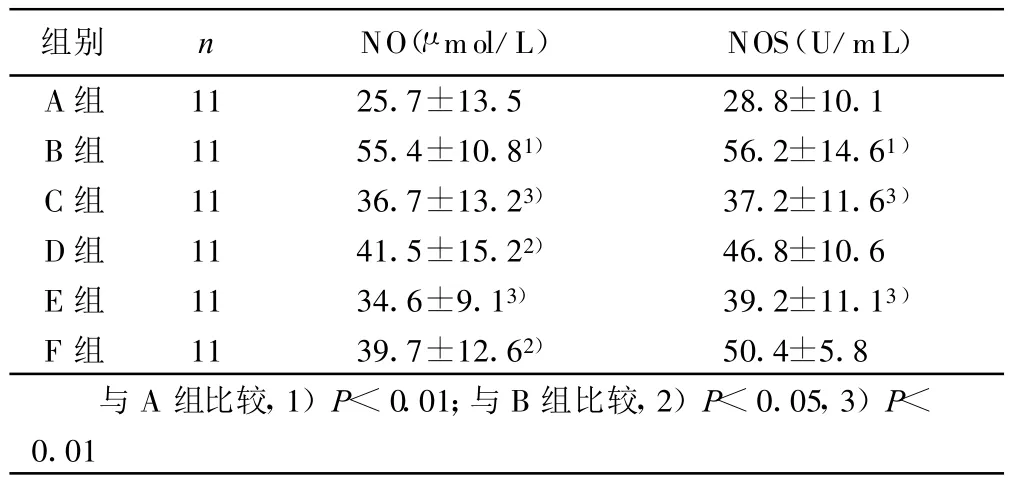
表3 各组给药后血清NO、NOS浓度比较( ±s) mmol/L
组别 n NO(μ mol/L) NOS(U/mL)A组 11 25.7±13.5 28.8±10.1 B组 11 55.4±10.81) 56.2±14.61)C组 11 36.7±13.23) 37.2±11.63)D组 11 41.5±15.22) 46.8±10.6 E组 11 34.6±9.13) 39.2±11.13)F组 11 39.7±12.62) 50.4±5.8与A组比较,1)P<0.01;与B组比较,2)P<0.05,3)P<0.01
2.4 各组大鼠心肌JAK1蛋白表达及灰度(见图1、表4) B组JAK1蛋白表达均高于A组(P<0.01);C组、E组、F组蛋白表达均低于B组(P<0.05或 P<0.01),各用药组之间无统计学意义(P>0.05)。

图1 各组大鼠心肌JAK1蛋白表达
表4 各组大鼠心肌JAK1蛋白灰度值表达(±s)

表4 各组大鼠心肌JAK1蛋白灰度值表达(±s)
组别 n JAK1/GAPDH A组 11 8.2±2.0 B组 11 19.0±4.61)C组 11 13.6±2.83)D组 11 17.0±4.6 E组 11 15.2±3.82)F组 11 14.7±3.42)与A组比较,1)P<0.01;与B组比较,2)P<0.05,3)P<0.01
3 讨 论
已往的研究表明,CHF患者有血管内皮功能异常。心力衰竭时血管内皮细胞分泌NO增多,NO过度增多可对心肌造成直接损害,降低心肌收缩力[5]。心力衰竭时有广泛的心肌细胞凋亡存在,在CHF的发生发展中起重要作用[6]。本实验结果中,B组血清NO、NOS浓度均增高,提示大鼠在CHF形成的过程中,血管内皮细胞NO、NOS代偿性的分泌增多。给予安心颗粒,可降低血清 NO、NOS浓度,与卡托普利作用相似,提示安心颗粒有抑制NO、NOS和心肌细胞凋亡作用。
CHF发病与多种致病机制共同参与有关,其中JAK-STAT信号通路是一个重要的发病机制。目前已知JAKs家族成员有4 个(JAK1、JAK2、JAK3、TyK2),JAK1作为 JAKs家族成员之一,在各种细胞因子及其受体作用下,经酪氨酸磷酸化后活性增强,从而激活其下游的STAT信号分子,使JAK1-STAT3传导通路持续活化。STAT3酪氨酸磷酸化后发生核转位,结合特定的DNA序列,激活介导心肌肥厚相关基因,引发心肌重塑[7]。本实验结果表明,给予安心颗粒,可使心力衰竭大鼠心肌JAK1的表达活性受到抑制,其作用与卡托普利相似。NOS分为原生型(cNOS)和诱生型(iNOS)。后者可在多种细胞中表达,如炎性中性粒细胞、血管内皮细胞、平滑肌细胞、心肌细胞等。有研究发现[8],JAK/STAT活化可使iNOS及NO合成增加,大量生成的NO最终引起血管病理性舒张塌陷、对血管收缩剂反应性下降以及降低心肌收缩力等一系列病理改变。iNOS和NO的大量合成与多种机制有关,其中JAK途径有着非常重要的作用,抑制JAK1的活性可下调细胞iNOS的表达。本实验结果显示,B组心肌JAK1蛋白表达增强时血清NO、NOS浓度亦升高,提示CHF形成过程中血清中NO、NOS水平与 JAK1活化有关。给予安心颗粒,可使心肌 JAK1蛋白表达下调及血清NO、NOS浓度降低。安心颗粒是由人参、桂枝、瓜蒌壳、水蛭、茯苓等药组成,具有补气通阳、化痰逐瘀、强心利尿之功。以往的实验研究证实该药有抑制心力衰竭大鼠心肌细胞凋亡、改善心功能的作用[9]。本次实验结果提示该药可通过抑制JAK1蛋白表达,降低 NO、NOS的活性,阻断JAK-STAT信号通路,抑制细胞凋亡和心肌重塑,改善心肌舒缩功能,从而达到防治CHF的目的。至于其作用机制,尚有待进一步研究。
[1] 方永辉,施志雄,刘伶.充血性心力衰竭患者内皮素、肿瘤坏死因子-α、一氧化氮的变化及卡维地洛对其影响[J].中国现代医学杂志,2006,16(13):2064-2065;2067.
[2] 金丰.心肌营养素-1的心血管作用及其信号通路的研究进展[J].中国药业,2006,15(17):61-62.
[3] 施新猷.现代医学实验动物学[M].北京:人民军医出版社,2000:464-465.
[4] 任亚丽,虞珏,徐济良,等.苯那普利及厄贝沙坦对心衰大鼠心脏指数及血流动力学的影响[J].南通大学学报(医学版),2008,28(1):25-27.
[5] Giannessi D,Del RY,Vital RL.T he roles of endothelins and their factors in heart failure[J].Pharmacol Res,2001,43:111-126.
[6] Peter MK,Seigo I.Apoptosis and heart failure:A critical review of the literature[J].Circ Res,2000,86:1107-1113.
[7] Dimerman JL,Lowenstein CJ,Snyder SH.M olecular mechanisms of nitric oxide regulation[J].Cir Res,1993,73:217-222.
[8] Dell'Albani P,Santangelo R,Torrisi L,et al.JAK/STAT signaling pathway mediates cytokine induced iNOS exp ression in primary astroglial cell cultures[J].J Neurosci Res,2001,65(5):417-424.
[9] 方显明,韦斌,郎中云,等.安心颗粒对阿霉素性心衰大鼠心肌细胞凋亡的影响[J].第四军医大学学报,2007,28(14):1326-1328.

