急性冠脉综合征早期静脉应用美托洛尔对心肌标志物和心功能的影响
王益民,孙 蕊,杨风雨,田临芳,郭丽焱,乔海英,吕吉元
近年来,随着对急性冠脉综合征(ACS)病理生理过程认识的深化和循证医学的研究,β受体阻滞剂已成为ACS二级预防的常用药物。但是很多研究显示,β受体阻滞剂通常使用不及时或应用不足,限制了β受体阻滞剂在ACS中的应用。目前在溶栓、强化抗血小板治疗甚至急诊经皮冠状动脉介入治疗(PCI)广泛应用的情况下,ACS早期应用β受体阻滞剂能否使患者获得额外的益处值得临床医生关注。
ACS后的死亡率和再梗死率与心肌损伤标志物,包括心肌肌钙蛋白I(cTnI)、肌酸激酶同工酶(CK-MB)以及左室射血分数(LVEF)相关,心肌损伤标志物和 LVEF是评价ACS预后的强的独立的重要的危险因素。因此本试验观察在ACS早期静脉应用美托洛尔对心肌损伤标志物和心功能的影响,研究ACS早期静脉应用β1受体阻滞剂是否能够进一步有效缓解临床症状和改善预后。
1 资料与方法
1.1 临床资料 2004年1月—2004年12月确诊的发病均在12 h以内的 ACS患者 72例,男50例,女22例,年龄36岁~75(57.4岁±9.5岁)。不稳定型心绞痛(UA)19例,急性心肌梗死(AMI)53例,其中ST段抬高的急性心肌梗死(STEMI)29例,非ST段抬高的急性心肌梗死(NSTEMI)24例。将72例ACS患者随机分为治疗组和对照组。治疗组35例,男26例,女9例;年龄36岁~73岁(56.9岁±9.8岁);其中 STEMI 15例,NSTEMI 11例,UA 9例。对照组 37例,男24例,女13例;年龄 37岁 ~75岁(57.8岁±9.3岁);其中 STEMI 14例,NSTEMI 13例,UA 10例。两组性别、年龄、血压、心率等一般资料比较差异无统计学意义(P>0.05)。
1.2 入选标准 AMI患者的诊断均符合WHO诊断标准:持续典型的胸痛30 min以上;典型心电图动态变化;心肌酶动态变化;具有以上任何两项确诊。UA患者的诊断均符合2000年中华医学会心血管病学分会《不稳定型心绞痛诊断和治疗建议》诊断标准[1]。
1.3 排除标准 排除伴有支气管哮喘;心动过缓(心率<60/min);Ⅰ度以上房室传导阻滞;低血压(收缩压<100 mmHg);Ⅲ级或Ⅳ级严重心力衰竭;周围循环灌注不良;严重的周围血管疾病以及难以控制的胰岛素依赖型糖尿病的ACS患者。
1.4 给药方法
1.4.1 治疗组 于入院后在给予ACS的常规治疗的同时,立即给患者静脉注射美托洛尔(商品名:倍他乐克注射液,阿斯利康制药有限公司生产)5 mg连续3次,速度为平均1 mg/min,每静脉注射5mg需观察2min~5min,如果心率下降至50/min以下或收缩压小于90 mmHg,则停止后续剂量的静脉注射。静脉注射完成后15 min,若患者的收缩压在90 mmHg以上,心率不低于50/min,则开始口服美托洛尔片剂,每6 h一次,每次 50 mg,共 200 mg,持续2 d,以后每次 100 mg,每日2次,进行维持治疗。
1.4.2 对照组 于入院后给予ACS的常规治疗的同时,给患者口服美托洛尔片剂,每次100 mg,每日2次。
1.3 观察指标 全部患者在入院后进行心电监护并记录血压和心率。在入院当时及发病第12 h、24 h、48 h、96 h、168 h抽取静脉血做cTnI检测进行观察;入院当时及发病第12 h、24 h、48 h、96 h抽取静脉血做CK-MB检测。
全部患者在发病后两周及四周时应用美国 Agilent公司SONOS 5500型彩色多普勒超声心动图仪行经胸心脏超声(T TE)检查,由专人操作,经胸变频探头为 2.5 MHz~3.0 MHz,采用双平面Simpson法测定左心室收缩末容积(LVESV)和左心室舒张末容积(LVEDV),计算LVEF。以上数据均连续测定3个心动周期,取平均值。
1.4 统计学处理 应用SPSS 11.0统计软件包进行分析,计量资料均以均数±标准差(±s)表示,主要统计指标均进行正态性及方差齐性检验,正态分布数据组间比较采用t检验;非正态分布数据组组间比较采用Kruskal-Wallis H检验。计数资料以百分比表示,采用χ2检验。相关性采用直线相关分析。
2 结 果
2.1 治疗组完成治疗情况 35例患者中有29例(82.8%)完成了15 mg美托洛尔的注射,5例(14.3%)完成了10 mg的注射,有1例(2.9%)急性下壁心肌梗死患者在注射美托洛尔3 mg时心率下降至45/min而停止注射。治疗组在注射美托洛尔后心率收缩压乘积明显降低(9 764±1 055vs7 896±967,P<0.05)。
2.2 两组不同时间cTnI比较(见表1) 治疗组在发病12 h及24 h较对照组明显下降(P<0.05),但在发病 48 h、96 h、168 h差异无统计学意义。
表1 两组不同时间cTnI比较(±s)ng/mL
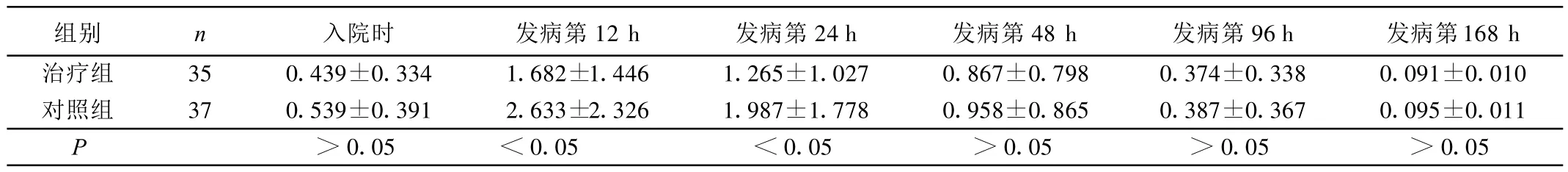
表1 两组不同时间cTnI比较(±s)ng/mL
组别 n 入院时 发病第12 h 发病第24 h 发病第48 h 发病第96 h 发病第168 h治疗组 35 0.439±0.334 1.682±1.446 1.265±1.027 0.867±0.798 0.374±0.338 0.091±0.010对照组 37 0.539±0.391 2.633±2.326 1.987±1.778 0.958±0.865 0.387±0.367 0.095±0.011 P>0.05 <0.05 <0.05 >0.05 >0.05 >0.05
2.3 两组不同时间CK-MB比较(见表2)
表2 两组不同时间CK-MB比较(±s)

表2 两组不同时间CK-MB比较(±s)
组别 n 入院时 发病第12 h 发病第24 h 发病第48 h 发病第96 h治疗组 35 37.3±33.4 117.1±68.2 83.4±49.4 51.5±25.1 26.3±10.7对照组 37 40.2±33.7 156.4±114.3 92.9±64.9 50.1±24.2 26.7±10.8 P>0.05 <0.05 >0.05 >0.05 >0.05
2.4 两组超声心动图指标比较(见表3)
表3 两组超声心动图指标比较(±s)

表3 两组超声心动图指标比较(±s)
组别 n LVEDV(mL) LVESV(mL) SV(mL) LVEF(%)治疗组 发病2周 35 126±16 55±10 69±11 53±13发病 4周 35 120±18 51±91) 68±10 56±9对照组 发病2周 37 129±15 59±12 68±12 51±10发病 4周 37 124±14 58±10 66±13 52±9与对照组同时间比较,1)P<0.05
2.5 直线相关分析 将全部患者发病12 h的cTnI与CK-MB水平与LVEF做直线相关分析,相关系数分别为-0.316(P<0.01)、-0.251(P<0.05)。提示 cTnI与 CK-MB水平与LVEF呈显著负相关。
3 讨 论
在ACS早期,交感神经系统(SNS)和肾素-血管紧张素-醛固酮系统(RAAS)处于过度激活状态,神经体液因子的过度释放,尤其是去甲肾上腺素、儿茶酚胺等浓度升高,结果使全身动脉压升高,左室后负荷增加,引起心脏和血管重构;同时,机体的代偿功能又将产生大量儿茶酚胺,使心肌代谢增加,心率加快,心肌耗氧量增加,加重左室重构,最终使心脏明显扩大,导致心力衰竭。这成为一种恶性循环。β受体阻滞剂可以有效拮抗SNS、RAAS及过度激活的神经体液因子,在心血管疾病的恶性循环链中起到重要的阻断作用,不仅通过降低血压,减慢心率,降低心肌耗氧量来保护心脏,而且通过对儿茶酚胺的抑制,把儿茶酚胺引起的心脏和外周恶性循环导致的不良后果降至最低。因此在ACS的药物治疗中β受体阻滞剂占有重要的地位。本研究观察在静脉注射美托洛尔后心率收缩压乘积明显降低(P<0.05),说明在ACS早期应用β受体阻滞剂可以通过竞争性抑制心肌上的β1受体活性,降低心肌收缩力,降低心脏指数、心率和动脉血压从而显著减少心肌耗氧,有效改善梗死和缺血心肌的氧供需平衡,明显减轻心肌缺血,改善ACS患者的胸痛症状。AMI时梗死面积与发病时间成相关性,研究证实冠状动脉闭塞 6 h之内,相应区域50%梗死面积形成,闭塞 12 h,相应区域75%梗死面积形成,闭塞18 h~24 h,相应区域几乎100%的梗死面积形成[2]。因此AMI时要求在最短的时间内达到完全的β受体阻断作用。所以为取得明显的β受体阻断作用,应该首先使用静脉注射β受体阻滞剂,迅速起效,然后用口服片剂维持有效的血药浓度。
人们对β受体阻滞剂对ACS的治疗作用在溶栓治疗和介入治疗广泛开展以后有些忽视。但近年的研究使β受体阻滞剂对治疗ACS的重要性重新为人们所重视。TIMI-IIB(Throm-bolysis In Myocardial Infarction Trial IIB)研究结果显示经过溶栓治疗估计冠脉已再通的患者早期静脉注射β受体阻滞剂可使6 d内非致命性再梗死发生率降低48%[3],在溶栓和抗血小板的基础上,如果早期合并使用静脉加口服的美托洛尔比单用口服,不仅能显著减少AMI的致死和非致死性再梗以及复发性缺血的发生,同时还能显著降低溶栓后出血性脑卒中的发生。
随机对照研究已经证实,肌钙蛋白升高是心血管事件独立预测因子。GUSTO IIA研究发现,入选的801例非ST段抬高型ACS患者中,289例基线肌钙蛋白水平高的患者其30 d死亡率明显高于低水平肌钙蛋白ACS患者(11.8%vs3.9%,P<0.001)。因此心肌损伤标志物能够反映ACS时心肌梗死面积和缺血程度,能够评估急性期的疗效,并与预后直接相关;LVEF的大小可以对ACS的长期预后和心源性猝死作出评价。心肌损伤标志物的水平可以反映心肌梗死面积的大小和心肌缺血的程度,cTnI和CK-MB水平高则表明梗死面积大,心肌缺血程度严重。本研究观察到治疗组在发病12 h、24 h的cTnI水平及发病12 h的CK-M B水平比对照组明显下降,说明在ACS早期给予静脉β受体阻滞剂可以有效减少心肌酶的释放,缩小梗死面积,改善心肌缺血程度,改善患者临床症状。
左室重构是ACS发生心力衰竭的主要因素,尤其是AMI早期(24 h内)就已开始,心肌缺血、心脏超负荷、去甲肾上腺素、血管紧张素等为其始动或促发因素[4]。因此在ACS早期给予干预,可以抑制左室重构的发生发展。本研究显示ACS早期予静脉美托洛尔继之口服可以明显降低左室收缩末容积,有增加LVEF的趋势。β受体阻滞剂通过降低心率,延长舒张期充盈和冠状动脉舒张期灌注时间;降低心肌耗氧量;抑制儿茶酚胺引起的脂肪组织释放游离脂肪酸而改善心肌能量代谢;抑制β肾上腺能通路介导的心肌细胞凋亡[5]等机制减少梗死心肌延展及心腔扩大而抑制和逆转左室重构。既往研究多为β受体阻滞剂与安慰剂比较,本研究两组在发病4周时LVEF无统计学意义,可能与对照组入院后口服美托洛尔,在4周时已发挥其β受体阻滞效应相关,也可能与本研究样本量小及观察时间短有关,可进一步随访以观察长期疗效。但两组在4周时LVESV仍有统计学意义,说明早期静脉美托洛尔干预可有效改善左室收缩功能。同时本研究提示如果ACS患者入院时发病时间已较长,错过早期干预时机,如无使用β受体阻滞剂禁忌症仍然应长期口服治疗,也可从中受益。另外本研究观察时间短,仅为4周,故无法提供在ACS早期静脉注射美托洛尔对ACS长期预后的分析。但本研究明确在ACS早期应用美托洛尔注射液可以显著降低心肌标志物的水平,而且本研究提示ACS患者cTnI和CK-MB水平与LVEF呈负相关关系,且cTnI水平更为显著,与国外研究结果一致[6-8],提示ACS早期干预降低cTnI可以改善左室功能。cTnI和CK-MB水平高则发生心力衰竭的几率增高,在ACS早期应用美托洛尔后可明显降低cTnI和CK-MB水平,使ACS进展成为严重心力衰竭的风险明显下降。
1997年,英国学者通过对76个有关β受体阻滞剂影响AMI死亡率的随机对照试验进行荟萃分析[9],评价β受体阻滞剂的四个特性,即β1受体选择性、内源性拟交感活性、脂溶性及膜稳定性与AMI疗效之间的关系,结果发现有β1受体选择性和脂溶性、无内源性拟交感活性者能更有效地降低1周死亡率、远期死亡率及再梗死率。斯德哥尔摩美托洛尔试验入选301例AMI,48 h内随机分组,分别接受安慰剂和美托洛尔治疗,随访3年,结果显示美托洛尔组较安慰剂组心脏性猝死的危险降低57%,美托洛尔组的生存曲线在服用药物即刻即与安慰剂组生存曲线分离,说明应用美托洛尔越早,受益也越多[10,11]。美托洛尔作为选择性β1受体阻滞剂,因具有高度脂溶性和无内在拟交感活性,在ACS治疗中发挥更为重要的作用。
虽然在目前,ACS的溶栓治疗和经皮冠状动脉介入治疗(PCI)已广泛应用,但是溶栓药物滴注后至少需要1 h才能发挥作用,PCI的准备工作也需要较长的时间,而且在大多数医院并不具备开展急诊PCI乃至常规PCI技术,而静脉注射美托洛尔在病人到达医院后很短的时间内就可完成。但是有资料显示静脉应用β受体阻滞剂在国内十分有限[12]。因此在ACS患者入院后立即静脉注射美托洛尔与随后的溶栓和介入治疗结合起来,可以最大程度地挽救心肌,缩小梗死面积,保护心功能。本研究提示在ACS早期注射美托洛尔可以减少cTnI和CK-M B的释放,早期注射美托洛尔可以使ACS患者在急性期获益更多。
[1]中华医学会心血管病学分会.不稳定性心绞痛诊断和治疗建议[J].中华心血管病杂志,2000,28:409-412.
[2]Yusuf S,Peto R,Lewis J,et al.Beta blockade during and after myocardial infarction:An overview of the randomized trials[J].Prog Cardiovasc Dis,1985,27:335-371.
[3]Steven B,Mihai G.Early intravenous beta-blocker combined with thrombolytic therapy for acute myocardial infarction(TIMI-Ⅱ)trial[J].Progress in Cardiovascular Diseases,1993,3:261-266.
[4]Colucci WS.M olecular and cellular mechanisms of myocardial failure[J].Am J Cardiol,1997,80(11A):15L-25L.
[5]Shizukuda Y,Buttrick PM,Geenen D,et al.Beta-adrenergic stimulation causes cardiocyte apoptosis:Influence of tachycardia and hypertrophy[J].Am J Physiol,1998,275:961-968.
[6]Green GB,Beaudreau RW,Chan DW,et al.Use of troponin I and creatine kinase-MB subnit levels for risk stratification of emergency department patients with possible my ocardial ischemia[J].Ann Emerg Med,1998,31:19-29.
[7]Wager I,Mair J,Fridrich L,et al.Cardiac troponin T release in acute myocardial infarction is associated with scintigraphic estimates of my ocardial scar[J].Co ronary Artery Dis,1993,4:537-544.
[8]Rao ACE,Collinson PO,Anson RC,et al.T roponin T measurement after myocardial infarction can identify left ventricular ejection of less than 40%[J].Heart,1998,80:223-225.
[9]Milton P.Increased survival with beta-blockers:Importance of ancillary properties[J].Prog Cardiovasc Dis,1997,5:445-446.
[10]Olsson G,Rehnqvist N,et al.Long-term with metoprolol after my ocardial infarction:Effect on 3 year mortality and morbidity[J].J Am Coll Cardiol,1985,5:1428-1437.
[11]Olsson G,Rehnqvist N.Reduction in nonfatal reinfarction in patients with a history of hypertension by chronic postinfarction treatment with metoprolol[J].Acta Med Stand,1986,220:33-38.
[12]蒋立新.β受体阻滞剂在心肌梗死中的应用[J].中华心血管病杂志,2004,32:93-94.

