猪蛔虫感染相关基因28A02的表达谱及其全长cDNA的克隆和分析
黄翠琴,廖生钱,王寿昆,黄其春,郑新添,朱兴全
(1.龙岩学院生命科学学院,福建龙岩364000;2.龙岩学院预防兽医学与生物技术福建省高等学校重点实验室,福建龙岩364000;3.福建农林大学动物科学学院,福建福州350002;4.中国农业科学院兰州兽医研究所家畜疫病病原生物学国家重点实验室,甘肃兰州730046)
猪蛔虫病呈世界性流行,猪蛔虫(Ascaris suum)的耐药性问题日趋严重[1-2],其发育具有明显的期特异性[3]。本实验从前期构建的猪蛔虫感染期幼虫差异消减cDNA文库中筛选基因28A02(ES291024)[4],采用半定量RT-PCR方法分析该基因在猪蛔虫不同发育期的表达情况,并采用RACE技术扩增其全长cDNA序列,为寻找猪蛔虫病免疫防治的靶分子奠定了基础。
1 材料和方法
1.1 材 料 猪蛔虫采自福建省龙岩市某屠宰场。
1.2 主要试剂 TRIzol试剂购自北京天根有限公司;ReverTra Ace-α-TM试剂盒购自TOYOBO公司;r Taq酶购自北京百泰克生物技术有限公司;5'-Full RACE试剂盒、3'-Full RACE试剂盒和DNA Ligation试剂盒购自TaKaRa公司。
1.3 猪蛔虫不同发育期幼虫和成虫的收集与总RNA的提取 参照文献[4]的方法对猪蛔虫不同发育期幼虫及成虫进行收集,保存于液氮中备用。
按 TRIzol说明书提取虫体总 RNA,取 5μL RNA溶液于琼脂糖凝胶中检测,剩余的RNA溶液贮存于-70℃备用。
1.4 半定量RT-PCR扩增反应及28A02基因在不同发育期的表达分析 参照ReverTra Ace-α-TM试剂盒说明书进行逆转录反应,RNA初始量均为1μg。内参基因β-actin扩增引物及条件按文献[4]的方法进行。以已知的28A02EST序列为模板设计引物:上游引物5'-ATTGCCGAAAGGAAAGCG-3',下游引物5'-CCACCATTCTAACATAACCACC-3',引物由上海捷瑞生物工程有限公司合成。
优化Mg2+浓度、退火温度和循环数,选择最佳的PCR反应条件对感染期幼虫差异表达基因在不同发育期的表达情况进行检测。在同一次PCR反应中,取5μL PCR产物进行琼脂糖凝胶电泳,用Quantity One软件在波长302nm对电泳条带进行光密度测定,以28A02基因和内参基因β-actin的积分光密度比值(IOD)代表28A02基因的mRNA的含量。RT-PCR产物由上海生工生物工程技术服务有限公司测序,测序结果与已知EST进行比对分析。
1.5 RACE扩增
1.5.13'RACE扩增及序列分析参照3'-Full RACE试剂盒说明书进行反转录合成cDNA。根据已知序列设计上游引物F0:5'-AGACCTCATCCAGGCGGT GTTCC-3'和巢式引物 F:5'-ATTGCCGAAAGGAA AGCG-3'。进行3'端序列PCR扩增,PCR产物由上海生工生物工程技术服务有限公司进行测序。
1.5.25'RACE扩增及序列分析参照5'-Full RACE试剂盒说明书对总RNA进行CIAP、TAP处理,并与5'RACE Adaptor连接,反转录合成cDNA。分别设计引物R:5'-CCACCATTCTAACATAACCACC-3'和巢式引物 R1:5'-GTCTGCTTCCTGACCTCGCTC TTC-3'。进行5'端序列PCR扩增,PCR产物进行测序分析。
1.5.33'RACE和5'RACE序列拼接和验证根据扩增得到的5'端和3'端序列,拼接全长基因,以该全长序列设计引物:F2:5'-GTTTAATTACCCAAGTT TGAG-3'; R3: 5'-TATAAAGAAAACATGGCACTA C-3';使用TaKaRa LA Taq酶,进行PCR扩增,验证5'和3'RACE拼接序列。
1.6 生物信息学分析 将获得的全长cDNA序列在NCBI等数据库进行对比分析和编码蛋白结构功能预测,获得相关的生物学信息。
2 结果与讨论
2.128 A02基因在不同发育期的表达分析 内参基因β-actin和目的基因28A02PCR扩增后进行电泳检测,用Quantity One软件对每条电泳条带进行光密度测定,用目的基因和内参基因的(IOD)代表目的基因在不同发育期的表达量。结果表明,该基因在感染期幼虫呈高丰度表达外,在肺期幼虫有少量表达,在其它发育期均不表达(表1)。
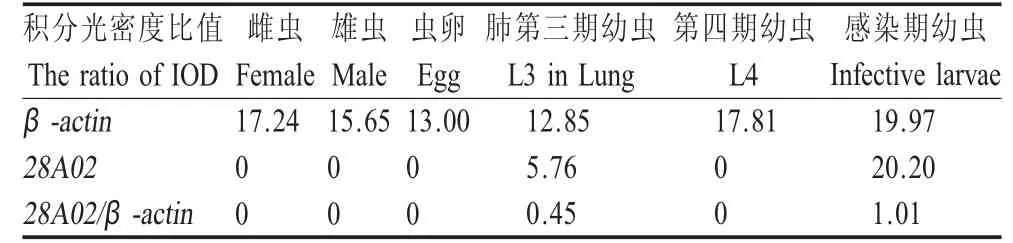
表1 β-actin和28A02PCR产物电泳相应条带的IODTable 1The IOD of the PCR product of 28A02gene and β-actin in different developmental stages of A.suum
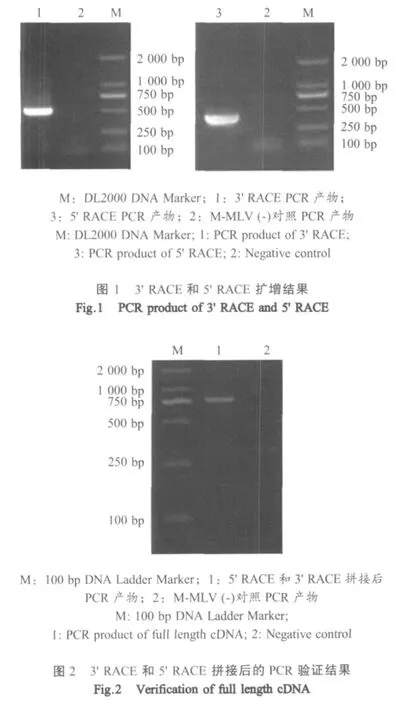
2.23 'RACE和5'RACE扩增结果 经3'RACE和5'RACE扩增后,分别取产物进行琼脂糖凝胶电泳,得到大小约500bp的3'末端片段和大小约300bp的5'末端片段(图1)。
2.33'RACE和5'RACE拼接验证结果及分析将3'RACE和5'RACE所得序列进行拼接,得到长为864bp的序列。根据获得的5'端和3'端已知序列设计拼接引物,PCR扩增后得到其中791bp序列(图2),经测序与拼接的序列相同。该全长序列含一个完整的长为450bp开发阅读框(ORF),序列两端有长为27bp的5'非编码区(UTR)和长为387bp并且带有Poly(A)的3'UTR,编码149个氨基酸,蛋白分子量为16.70ku。将该序列录入GenBank,序列号为HM 147250。
2.428 A02基因的生物信息学分析 该基因编码的氨基酸与Caenorhabditis briggsae的CBR-ATP-4protein具有47%的相似性,与秀丽隐杆线虫(Caenorhabditis elegans)的ATP合酶亚单位家族成员(atp-4)有45%的相似性。该基因编码的蛋白同时存在疏水区和亲水区,有6个保守的模体结构,一个保守结构域,该结构域与线粒体的ATP合酶的偶联因子有关。亚细胞定位分析显示,该蛋白位于线粒体的可能性为73.9%,提示该基因极有可能编码线粒体ATP合酶。
ATP合酶是热休克蛋白90(HSP90)的协同作用蛋白。HSP的表达具有其特异性和温度依赖性,猪蛔虫幼虫在发育移行过程中要经历温度、渗透压等变化,其过程受HSP的调控[6]。ATP合酶B亚基蛋白在能量代谢过程中起着独特的调节作用,能够同时进入细胞核和线粒体,可作为抑制猪蛔虫幼虫发育的关键靶分子[7]。猪蛔虫的感染性虫卵被宿主食入在小肠脱鞘后,经肝、肺等一系列移行,该过程需要大量能量。上述推测提示ATP合酶可能参与幼虫的糖代谢过程,缺少ATP合酶可能使糖原的合成受阻,导致幼虫的发育停止或死亡。本实验为进一步研究ATP合酶基因的功能奠定了基础。
[1]Ho N F,Geary T G,Barsuhn C L,et al.Mechanistic studies in the transcuticular delivery of antiparasitic drugs.II:ex vivo/in vitro correlation of solute transport by Ascaris sunm[J].Mol Biochem Parasitol,1992,52(1):1-13.
[2]Martin R J,Murray I,Rodertson A P,et al.Anthelm intics and ion-channels:after a puncture,use a patch[J].Int J Parasitol,1998,28(6):849-862.
[3]Maung M.The occurrence of the second molt of Ascaris lumbricoides and Ascaris suum[J].Int JParasitol,1978,8:371-378.
[4]Huang C Q,Gasser R B,Cantacessi C,et al.Genom ic-bioinformatic analysis of transcripts specific to the third-stage larva of the parasitic nematode Ascaris suum[J].PLoS Negl Trop Dis,2008,2(6):e246.
[5]Papathanassiu A E,MacDonald N J,Bencsura A,et al.F1F0-ATP synthase functions as a co-chaperone of Hsp90-substrate protein complexes[J].Biochem Biophys Res Commun,2006,345(1):419-429.
[6]Devaney E,Martin S A,Thompsons F J.Stage-specific gene expression in lymphatic filarial nematodes[J].Parasitol Today,1996,12(11):418-424.
[7]周红娟,余新炳,徐劲,等.华支睾吸虫ATP合酶B亚基全长基因的生物信息学分析[J].热带医学杂志,2007,7(4):315-318.

