结核病与BCG疫苗接种个体Taq Man探针荧光定量PCR诊断方法的建立及初步应用
王春雨,杨 莉,王振国,刘金华,宋占昀,周 亮,王宝任,王全凯*
(1.吉林农业大学,吉林长春130118;2.吉林出入境检验检疫局检验检疫技术中心,吉林长春130062;3.长春净月开发区玉潭镇政府畜牧站,吉林长春130322)
世界1/3人口感染过结核杆菌(Tubercle bacillus)[1],结核菌素皮肤试验(Tuberculin skin test,TST)是临床检测T.bacillus的主要方法,该方法使用的结核菌素含有200种以上的抗原蛋白,这些抗原广泛存在于致病性T.bacilla、卡介苗(BCG)和环境中的其他分支杆菌(M ycobacterium)中,使得结核菌素与非致病性分枝杆菌的抗原存在交叉反应,因此检测结果中经常出现假阳性现象[2-3]。
结核病的主要病原菌为人型结核杆菌和牛分枝杆菌(M.bovis)[4-5],因此控制牛分枝杆菌病的流行对人类结核病的防制是十分必要的,传统的人型结核杆菌与牛分枝杆菌的鉴别检测主要依靠生化试验,随着变异株的出现,生化检测的特异性降低,同时由于结核杆菌复合群(MTC)生长较慢,使得MTC物种级鉴定依然存在较大难度[6-7]。因此,分子检测已经成为实验室检查的常规手段之一,本研究根据致病性结核杆菌特有的RD1序列区间、牛分枝杆菌229bp序列以及人型结核杆菌12.7kb插入序列,分别设计合成特异性引物及探针,利用Taq Man探针荧光定量PCR对病原菌进行检测,建立人畜共患结核病快速鉴别诊断方法。
1 材料和方法
1.1 标准菌株 结核分枝杆菌(M.tuberculosis)标准株 H37Rv(ATCC25618)、H37Ra(ATCC25177)、牛分枝杆菌(ATCC19210)、卡介苗(BCG,ATCC27289)、草分枝杆菌(M.phlei,ATCC607)、大肠杆菌O157(E.coli,ATCC607)、耻垢分枝杆菌(M.smegmatis,ATCC607),胃分枝杆菌(M.gastri,ATCC15754)和副结核分枝杆菌(M.paratuberculosis,ATCC43015)均购自北京中原经贸公司(ATCC菌种保存中心中国代理)。
1.2 主要试剂和仪器 Ex Taq酶购自TaKaRa公司;7H10和7H9培养基均购自BD公司;ABI7000实时荧光PCR仪为ABI公司产品;超纯水器M ill-Q Elix 10为M illipore公司产品。
1.3 引物和探针的设计与合成 应用Primer Express2.0软件设计荧光定量PCR探针和引物。根据GenBank登录的TB RD1编码区设计合成引物及探针(MTC1),探针5'端标记FAM荧光基团,引物3'端标记BHQ-1,上游引物:GGCTTCTGACCCGCTA ATAC,下游引物:ACGTGACATTTCCCTGGATT,MTC1:CCGCGAAATTCCACTGCTGC,扩增产物大小为111bp;根据GenBank登录牛分枝杆菌基因组中特有序列(AJ003103)设计合成引物及探针(B1),探针5'端标记HEX荧光基团,引物3'端标记BHQ-1,上游引物:TAATGTGCGAGCTGAGCGA TG,下游引物:GTAGCGAGTCGAGCGTGTAAT,B1: TGAATTCATACAAGCCGTAGTCGTGCA, 扩增产物大小为123bp;根据GenBank登录的人型结核分枝杆菌基因组12.7kb插入序列(BX842576)设计合成引物及探针(M 1),探针5'端标记TET荧光基团,引物3'端标记BHQ-1,上游引物:TCGGAAT AAGATGTCAGGCA,下游引物:CGTCTGAAATC GTTGGACAC,M 1:CGACTCGCGGCATTCAGCAT,扩增产物大小113bp。
1.4 Taq Man探针荧光定量PCR 按常规方法提取细菌基因组DNA,Taq Man 25μL荧光定量PCR反应程序为:95℃ 4min;95℃ 15s、60℃ 30s,40个循环;退火延伸时检测荧光信号。3对扩增引物和相应探针的反应体系及程序相同。
1.5 特异性试验 按照常规方法,分别提取对照标准菌株DNA进行荧光定量PCR扩增和普通PCR扩增,同时设置阳性对照,检测本方法的特异性。
1.6 敏感性试验 提取质控菌株DNA,用灭菌生理盐水稀释,使其浓度依次为109pg/m L、108pg/m L、107pg/m L、106pg/m L、105pg/m L、104pg/m L、103pg/m L、102pg/m L、101pg/m L和1pg/m L,用于灵敏性试验,同时与普通PCR检测方法进行比较[9]。
1.7 标准曲线建立 将阳性质粒稀释成103copies/μL~107copies/μL浓度梯度,在最佳反应条件下同时扩增。反应结束后计算机自动绘制标准曲线。
1.8 重复性试验 同一样品在相同条件下进行3次组内PCR扩增试验,测定该方法的重复性。
1.9 临床样本检测 分别采集PPD试验为阳性、阴性鹿血样本进行荧光定量PCR检测。
2 结果
2.1 特异性试验 经过普通PCR和荧光PCR扩增检测,致病性结核杆菌复合群引物对H37Rv、H37Ra、牛分枝杆菌呈阳性结果,其它样品为阴性;牛分枝杆菌检测对H37Rv、H37Ra呈阴性结果,牛分枝杆菌变现为阳性;结核分枝杆菌引物检测H37Rv、H37Ra出现扩增曲线,牛分枝杆菌和BCG为阴性,研究结果显示,3种荧光探针PCR检测方法都具有较好的特异性(图1、图2)。
2.2 敏感性试验 取结核分枝杆菌H37Rv各稀释度样品3μL进行荧光PCR检测试验,结果显示,致病性结核杆菌复合群荧光PCR的检测灵敏度可达每个反应1pg(图3),分别取结核分枝杆菌H37R v和牛分枝杆菌各稀释度样品3μL,对结核分枝杆菌及牛分枝杆菌荧进行光PCR检测,其敏感度也可达到1个菌细胞。通过实验证明本研究建立的荧光探针PCR检测方法其灵敏度高于普通PCR(灵敏度为10pg/m L)。
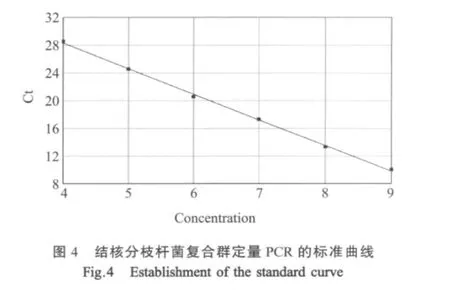
2.3 标准曲线图的建立 分别将克隆的H37Rv和M.bovis的阳性质粒稀释成103copies/μL~108copies/μL浓度梯度,在最佳反应条件下同时扩增,得出准曲线,其中结核分枝杆菌复合群PCR检测的R2值达到了0.9998(图4),牛分枝杆菌PCR检测的R2值达到了0.9988,人型分枝杆菌PCR检测的R2值达到了0.9991,说明本研究制备的标准品符合试验要求,所建立的检测方法是合格的。

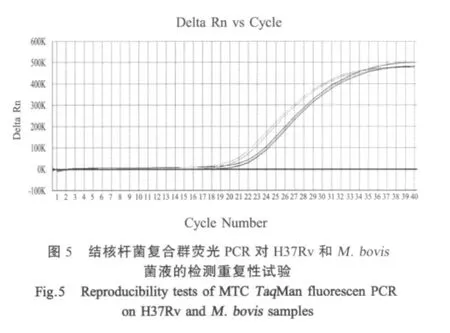
2.4 重复性试验 分别取H37Rv和M.bovis进行3次组内重复扩增实验,检测致病性结核杆菌复合群荧光PCR(图5)、牛分枝杆菌荧光PCR重复性及结核分枝杆菌荧光PCR的重复性,结果表明3种荧光探针PCR检测方法重复性好、稳定可靠。
2.5 临床样品检测试验 在吉林部分鹿场进行PPD检查,采集的鹿血样本进行检测。PPD试验和荧光探针PCR对临床样本检测结果(表1)。结核杆菌复合群荧光探针PCR检测结果中,全部95份样品中阳性样品43份,其中牛分枝杆菌34株,人型结核杆菌9株,未发现BCG疫苗株(图6)。

表1 PPD试验和荧光探针PCR对临床样本检测结果的比较Table 1Comparison of PPD test and Fluorescent Taqman PCR in clinical samples

3 讨 论
本研究建立的荧光Taq Man PCR检测方法的特异性和敏感性均高于PPD检测,对BCG接种和环境中分枝杆菌引起的假阳性能够鉴别检测,并对病原菌直接进行种的鉴定,可以为TB的治疗和流行病学研究提供可靠数据。
目前,TB的检测靶序列主要是32ku、38ku和65ku抗原蛋白的编码基因,以及dnaJ基因、groE1基因和IS6110插入序列等[8],其中IS6110插入序列是研究较为广泛的目的基因,在人型结核杆菌中其含有4个~20个拷贝,但是在大部分牛分枝杆菌中含有0~5个拷贝[9-10],所以基于IS6110位点的PCR检测方法在动物TB的研究较少。近年来研究发现结核杆菌复合群的ESAT-6和CFP-10蛋白的编码序列只存在于致病性结核杆菌中,BCG中缺失该序列[11-12],将该序列作为目标靶序列,开发具有高度敏感性和特异性的TB荧光PCR鉴别检测技术,对TB检疫、控制乃至根除具有十分重大的经济效益和社会效益。此外,本研究建立的方法可以特异性检测牛分枝杆菌和人型结核杆菌,对促进动物结核病与人结核病的相互关系研究具有重要意义。
[1]World Health Organization,The Stop TB Department,WHO Report 2008.Global tuberculosis control-surveillance,planning,financing(2008),1.
[2]Huebner R E,Schein M F,Bass Jr JB.The tuberculin skin test.Clin Infect Dis,1993(17):968-975.
[3]Jasmer R M,Nahid P,Hopewell P C.Clinical practice:latent tuberculosis infection[J].JMed,2002,347:1860-1866.
[4]Acha P N,Szyfres B.Zoonotic tuberculosis,in zoonoses and communicable diseases common to man and animals,second ed.pan American health organization/world health organization,Washington,Scientific Publication.1987.No.503.
[5]Blazquez B,De LosM,Samper L E,etal.Genetic characterization of multidrugresistant M.bovis strains from a hospital outbreak involving human immunodeficiency virus positive patients[J].J Clin M icrobiol,1997,35:1390-1393.
[6]Grange JM,Yates M D,De Kantor I.Guidelines for speciation within the M.tuberculosis complex,second ed.World Health Organization,Geneva,unpublished document.1996,WHO/EC/Zoo/96,4.
[7]Niemann S,Harmsen D,Rusch Gerdes S,et al.Differentiation of clinical M.tuberculosis complex isolates by gyrB DNA sequence polymorphism analysis[J].J Clin M icrobiol,2000,38:3231-3234.
[8]Rattan A.PCR for diagnosis of tuberculosis:where are we now?[J].Ind JTub,2000,47:79-82.
[9]Ieven M,Goossens H.Relevance of nucleic acid amplification techniques for diagnosis of respiratory tract infections in the clinical laboratory[J].Clin M icrobiol Rev,1997,10:242-256.
[10]刘思国,王春来,宫强,等.牛分枝杆菌特异性PCR检测方法的建立及初步应用[J].中国预防兽医学报,2006,28(1):80-83.
[11]Chen Jia-zhen,Su Xiao-di,Zhang Ying,et al.Novel recombinant RD2and RD11-encoded M ycobacterium tuberculosis antigens are potential candidates for diagnosis of tuberculosis infections in BCG-vaccinated individuals[J].M icrobes and Infection,2009,11:876-885.
[12]亓文宝,罗满林,周荣,等.牛TB荧光定量PCR快速检测方法的建立及初步应用[J].中国人兽共患病学报,2007,23(9):883-885.

