浙江地区副猪嗜血杆菌分离株的生物学特性
何海健,陆国林,熊永忠
(1.金华职业技术学院农学院,浙江金华321007;2.浙江地区畜牧兽医局,浙江杭州310029;3.中国农业科学院哈尔滨兽医研究所,黑龙江哈尔滨150001)
副猪嗜血杆菌(Haemophilus parasuis,HPS)病呈世界性分布,健康猪群中也存在HPS,是规模化猪场最常见的条件性细菌病[1]。近年来,HPS感染率呈明显上升趋势,给养猪业造成严重经济损失[2-4]。HPS为革兰氏阴性菌,该菌生长过程严格需要烟酰胺腺嘌呤二核苷酸(NAD或V因子),因此又称NAD依赖型细菌[6]。HPS体外分离培养比较困难,主要侵害断奶后和保育阶段的仔猪,2周龄~4月龄仔猪均可发病,多见于5周龄~8周龄,表现为多发性浆膜炎、关节炎和脑膜炎[5]。本研究针对浙江地区HPS进行分离和生物学特性鉴定,明确浙江地区HPS病的流行特点。
1 材料和方法
1.1 菌株和实验动物 从浙江地区5个地(县)市的疑似多发性浆膜炎和关节炎病猪体内分离到6株细菌,分别命名为HPS1~HPS6;HPS标准菌株和15个血清型HPS标准菌的基因组DNA均由华南农业大学传染病教研室惠赠;200只清洁级昆明小鼠(18g~22g)购自浙江地区实验动物中心;8只清洁级豚鼠(200g~250g)购自浙江地区实验动物中心。
1.2 主要试剂 1kb Ladder DNA Marker购自Gibco BRL公司;Taq酶、1mg/m L NAD、小牛血清、TSA和TSB培养基均购自TaKaRa公司。
1.3 菌株选择与复壮 将分离菌株接种含NAD和小牛血清的TSA(4%)培养基,37℃培养18h后挑取单个菌落接种于含NAD和小牛血清的TSB(3%)培养基中,37℃振荡培养18h,4℃保存备用。
1.4 小牛血清对HPS生长的影响 将含NAD的TSB培养基分装为6管,每管5m L,依次添加小牛血依次为2%~10%,分别加入100μL HPS培养液,37℃培养18h,测定OD600nm值。
1.5 NAD对HPS生长的影响 配制含0.8m L小牛血清的TSB溶液,分装为7管,每管5m L,依次添加NAD至终浓度为1μg/m L~32μg/m L,分别加入HPS培养液100μL,37℃ 180r/min振荡培养18h,测定其OD600nm值。
1.6 培养时间对HPS生长情况的影响 将HPS于TSA培养基37℃培养,测定不同培养时间(12h~48h)对HPS生长情况的影响。
1.7 HPS生长曲线的测定 HPS复壮后,将6×103cfu接种TSB液体培养基,37℃培养12h,将培养液按培养基总体积的1%接种于TSB液体培养基内,37℃振荡培养,每隔2h平板菌落计数并测定培养基的OD600nm值,绘制HPS生长曲线。
1.8 小鼠致病力试验 参照寇式(Korbor)法测定其LD50,分别接种不同剂量的HPS1~HPS6,确定小鼠全部死亡或90%以上死亡的剂量和小鼠不死亡或10%以下死亡的剂量。在确定的最高、最低剂量范围为内,设置5组梯度剂量,腹腔注射感染小鼠,每组5只,同时设空白对照组。根据公式logLD50=∑1/2×(Xi+Xi+1)(Pi+1-Pi)计算 LD50,其中 Xi与 Xi+1及Pi+1与Pi分别为相邻两组的剂量对数以及动物病死率。
1.9 豚鼠致病力试验 将8只试验用豚鼠随机分为3组,设置2个试验组和1个对照组,试验组每组3只,对照组2只,参照文献[7]的方法,试验一组每只豚鼠腹腔注射1m L 1.0×109cfu/m L的HPS,试验二组每只豚鼠注射1m L 1.0×1010cfu/m L的HPS,对照组每只豚鼠注射1m L TSB。连续7d观察豚鼠的发病情况,每日心脏采血涂布TSA平板观察菌落生长情况,同时采用PCR方法检测HPS。一周内死亡的豚鼠,观察剖检变化并采集气管、肺、肝、脾、肾和脑组织直接进行PCR检测,病料经TSB培养基增菌培养后再次用PCR检测病原。7d后迫杀存活的豚鼠,观察脏器的变化,分离病原。
1.10 ERIC-PCR分型试验 参照文献[8],ERICPCR引物为ERIC-1R:5'-ATGTAAGCTCCTGGGGA TTCAC;ERIC-2:5'-AAGTAAGTGACTGGGGTGAG CG。50μL体系ERIC-PCR反应条件为:95℃5min;94℃ 30s、50℃ 30s、72℃ 2m in,35个循环;72℃6min。PCR产物以1%琼脂凝胶电泳分析。
2 结果
2.1 不同浓度小牛血清和NAD对HPS生长的影响未加血清的对照组OD600nm值为0.399;血清浓度为2%~10%时OD600nm值在0.47~0.51之间,分别为0.479、0.481、0.500、0.476和0.510。表明,不同浓度小牛血清对HPS的生长影响较小,HPS培养基加入2.0%的小牛血清即可。
NAD浓度试验组结果表明,空白组中HPS未生长,其它各组OD600nm值与NAD浓度呈正比,NAD浓度大于16μg/m L时,OD600nm值进入平台期(表1)。因此,HPS培养基中加入16μg/m L NAD即可。

表1 NAD对HPS分离株生长的影响Table 1Effects of NAD on the grow th of isolates of H.parasuis
2.2 培养时间对HPS生长的影响 HPS接种TSA固体培养基12h内无肉眼可见的菌落,12h后菌落开始生长如针尖大小,12h~18h菌落大小为0.6mm~0.8mm,24h可长到1mm左右,然后逐渐长大,培养48h后HPS菌落长到最大值2mm左右。
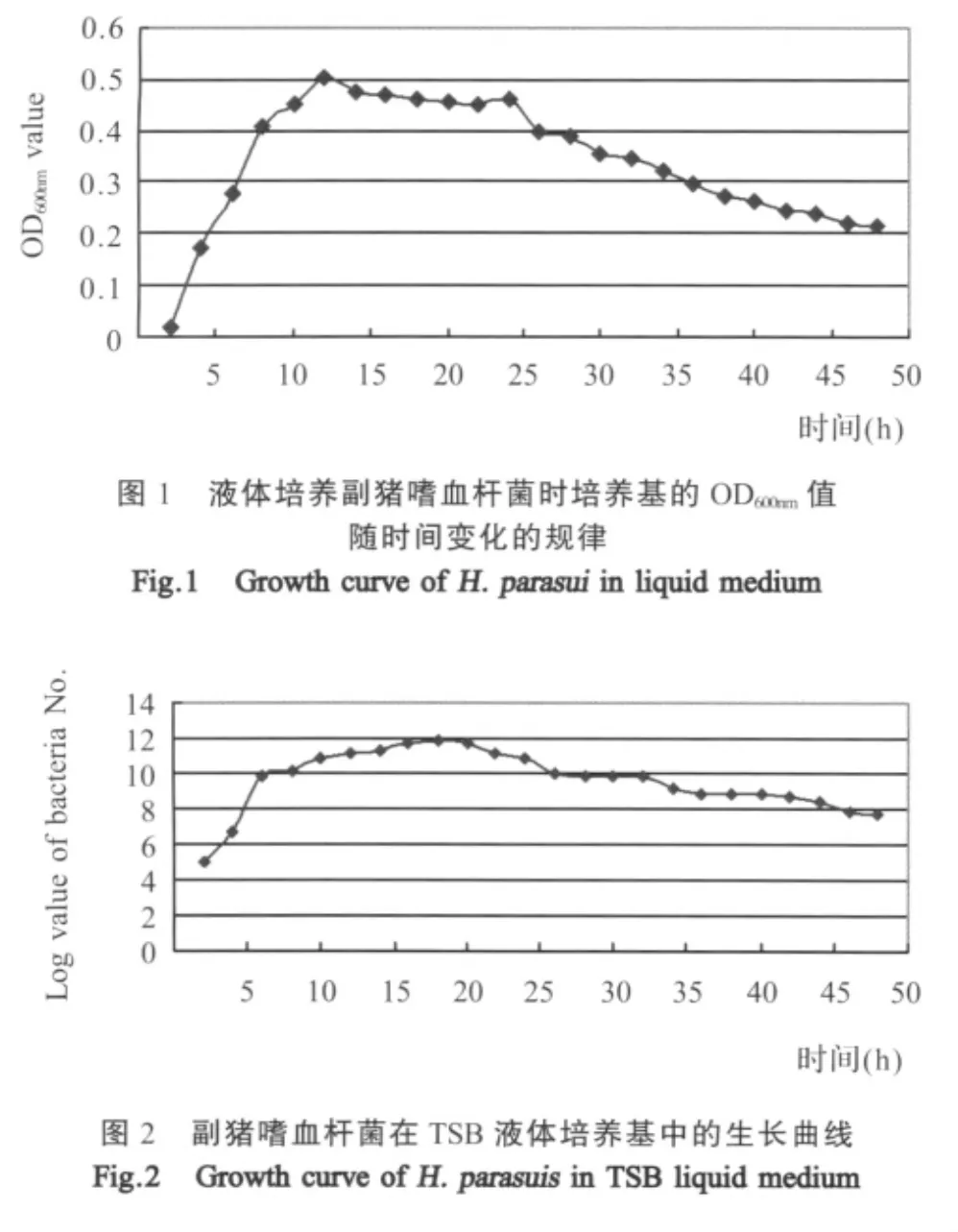
2.3 HPS的生长曲线 HPS初始接种量为6×103cfu,接种于TSB液体培养基中培养,每隔2h进行平板计数、测定培养液的OD600nm值。
HPS在液体培养基接种4h左右,OD600nm值开始上升,在培养12h~24h之间OD600nm值达到峰值,随后呈下降趋势(图1)。
液体培养基中培养HPS,种子液接种后4h左右开始进入对数生长期,培养16h~18h培养基中的活菌数达到峰值,但从20h开始活菌数即下降,到25h~32h活菌数维持在同一个水平,但在32h之后,活菌数呈现下降趋势(图2)。
2.4 小鼠毒力试验 小鼠分别腹腔接种6株分离株后,均出现精神萎顿、被毛松乱和食欲减退等症状。接种12h后小鼠开始死亡,注射后观察14d,统计各组小鼠的病死率,计算LD50,HPS1~HPS6的 LD50分 别 为 2.03×109、5.3×109、1.34×1010、7.0×109、1.17×1010和 1.62×109。结果表明,HPS6的毒力最强,HPS3的毒力最弱。
2.5 豚鼠致病力试验 试验组豚鼠接种HPS6后,表现为被毛蜷缩,精神沉郁,心脏采血经培养表明,试验组5只豚鼠心血中均有细菌生长,对照组豚鼠心血中无细菌生长。试验一组豚鼠接种后,有一只可能因采血不当而死,其余一周内无死亡,试验二组的豚鼠分别于48h和72h各死亡一只。剖检两组死亡豚鼠发现,试验一组豚鼠各脏器病变不明显,只有肺脏有针尖大小出血点。试验二组豚鼠腹腔内有少量积液,胸腔内心包外面有层白色薄膜。其余豚鼠在接种一周后用迫杀,剖检,各脏器无明显病变,取各脏器样品进行PCR检测结果见表2。
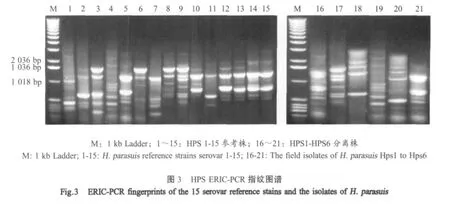
2.6 HPS分离株ERIC-PCR检测结果 对分离到的HPS1~HPS6进行ERIC-PCR指纹图谱分析表明,HPS1和HPS6与血清5型标准菌株图谱一致,HPS2与血清9型标准菌株图谱一致,HPS4与血清4型标准菌株图谱一致,HPS3和HPS5与15个血清型标准菌株图谱不吻合(图3)。
3 讨 论
本实验中,首先预设添加NAD,探讨培养基中加入小牛血清的浓度对HPS生长的影响,结果表明,小牛血清对HPS的生长有促进作用,但受其浓度影响不大;进一步预设添加小牛血清,探讨NAD的浓度对HPS生长的影响,HPS对培养基的要求十分苛刻,一般营养肉汤几乎不生长,选择一种优良的培养基对于细菌的分离培养十分重要[9]。表明NAD是HPS生长的重要营养成分,细菌的生长浓度与NAD含量成正比,到16μg/m L后基本达到饱和。培养到18h左右达到活菌数的高峰,20h后开始下降,因此,以培养16h~18h的菌液为最佳。
研究表明,由于因源抗体的干扰,只有不吮食初乳的仔猪可以作为实验动物模型[10]。本研究测定了6株HPS浙江分离株对昆明小鼠的LD50,结果表明,HPS6的毒力最强,HPS3的毒力最弱。另外,对豚鼠进行了感染实验,两个剂量组6只豚鼠接种后有5只在心血中分离到HPS,高剂量组症状比低剂量组分离率高。结果表明,以小鼠和豚鼠作为HPS动物模型是可行的。Oliveiras证实ERIC-PCR指纹一致的菌株具有相同的血清型[11]。本实验对浙江地区内分离到的6株HPS进行了DNA指纹图谱分析。结果发现,有一株与血清4型标准菌株图谱一致,两株与血清5型标准菌株图谱一致,一株与血清9型标准菌株图谱一致,还有两株与15个血清型标准菌株图谱不吻合。实验结果表明,浙江地区内流行的HPS血清型比较复杂,除了常见的血清5型、4型和9型外,还存在其它不能确定血清型的菌株,提示不确定血清型菌株的存在有可能是HPS在一定地域内散发或者流行的根本原因。
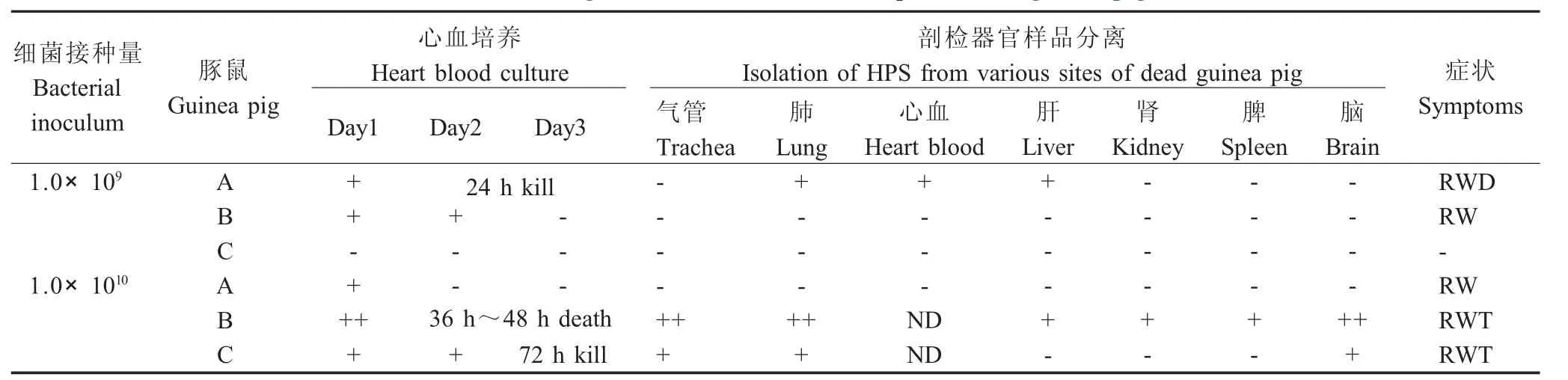
表2 豚鼠致病力试验结果Table 2Pathogenic test of isolates of H.parasuis in guinea pig
[1]Oliveira S,Piioan C.Haemophilus parasuis l new trends Oil Diagnosis epidemiology and control[J].Vet M icrobiol,2004,99(1):1-12.
[2]蔡旭旺,刘正飞,陈焕春,等.副猪嗜血杆菌的分离培养和血清型鉴定[J].华中农业大学学报,2005,24(3):55-58.
[3]周斌,储岳峰.华东地区副猪嗜血杆菌的分离、血清型鉴定与药敏分析[J].畜牧兽医学报,2009,41(11):84-86.
[4]Angen O,Oliveira S,Ahrfens P,et al.Development of an inproved species specific PCR test for detection of Haemophilus parasuis[J].Vet M icrobiol,2007,119(2-4):266-276.
[5]Riising H J.Prevention of Glasser's disease through immunity to Haemophilus parasuis[J].Zentralbl Veterinarmed B,1981,28(8):630-638.
[6]Nedbalcova K,Satran P,Jaglic Z,et al.Haemophilus parasuis and Gla¨sser's disease in pigs:a review[J].Veterinarni Medicina,51,2006(5):168-179.
[7]Rapp Gabrielson V J,Gabrielson D A.Prevalence of Haemophilus parasuis serovars among isolates from swine[J].Am JVet Res,1992,53(5):659-664.
[8]Versalovic J,Koeuth T,Lupski J R.Distribution of repetitive DNA sequences in eubacteria and application to fingerprinting of bacterial genomes[J].Nucleic Acids Res 1991,19:6823-6831.
[9]Simone O.Haemophilus parasuis giagnostics[J].JSw ine Health Prod 2007,15(2):99-103
[10]Oliveira S,Galina L,Blanco I,et al.Naturally-farrowed,artificially-reared pigs as an alternative model for experimental infection by Haemophilus parasuis[J].Can J Vet Res,2003,67(2):146-150.
[11]Macedo N R,Oliveira S R,Lage A P,et al.ERIC-PCR genotyping of Haemophilus parasuis isolates from Brazilian pigs[J].Vet J,2010,24(Epub ahead of print).

