混合5’-核苷酸的分离与检测
李 黎 莫晓燕* 陈雪玉
实验研究
混合5’-核苷酸的分离与检测
李 黎 莫晓燕* 陈雪玉
以核酸酶P1酶解RNA产物为材料,对离子交换树脂分离混合5’-核苷酸的工艺条件进行研究,并通过建立的RP-HPLC检测方法鉴定单核苷酸分离效果。结果表明,阳离子交换树脂NH-1可使4种单核苷酸有效分离,洗脱顺序依次为UMP→GMP→CMP→AMP;最佳分离条件为:色谱柱径高比=1∶20,RNA酶解液上样浓度20g/L,吸附时间8h,洗脱流速0.5mL/min。确定RP-HPLC C18反相柱的色谱条件为:流动相KH2PO4-甲醇,在30mmol/L KH2PO4(pH 5.5)以及0.5mL/min流速条件下,按照KH2PO4∶甲醇=100∶0→97∶3,15min,97∶3→95∶5,1min进行梯度洗脱。通过外标法对混合单核苷酸的分离效果进行检测,证明增加吸附时间是改善分离效果的重要因素。
5’-核苷酸;阳离子交换树脂;反相高效液相色谱;分离和检测
核苷酸及其衍生物是医药、食品、农业和科研领域重要的生化试剂和原料,与国外相比,国内核苷酸工业发展缓慢,尤其是混合核苷酸的分离纯化工艺大多处于分离率差、纯化效率低的状况[1-3]。本文采用阳离子交换树脂对核酸酶P1酶解RNA的核苷酸混合液进行分离纯化研究[4-6],并且探讨4种单核苷酸的RP-HPLC检测方法。
1 材料与方法
1.1 材料和试剂
核苷酸混合液(核酸酶P1酶解RNA产物,自制);NH-1阳离子交换树脂(西安蓝深生物科技有限公司);AMP、CMP、GMP、UMP标准品(美国Sigma公司);甲醇(色谱纯,天津市科密欧化学试剂有限公司);其余试剂均为分析纯。
1.2 主要仪器
DU-640紫外可见分光光度计(美国BECKMAN仪器有限公司);125-168高效液相色谱仪(美国BECKMAN仪器有限公司);BS-100A自动部分收集器(上海精科实业有限公司);HL-2恒流泵(上海嘉鹏科技有限公司)。
1.3 实验方法
1.3.1 树脂的选择与处理
根据待分离核苷酸的电荷特性,选择强酸性苯乙烯系阳离子交换树脂NH-1作为分离介质,该树脂具有上柱量大、分离度高的特点,适合于工业化生产[7-9]。
称取适量NH-1阳离子交换树脂,蒸馏水浸泡2h除去杂质颗粒;加四倍树脂量的1mol/L NaOH溶液浸泡4h,蒸馏水水洗至中性;以四倍树脂量的1mol/L HCl浸泡4h,蒸馏水水洗至中性;再用pH 1.5的HCl浸泡树脂,使树脂转为氢型后置冰箱保存待用。
1.3.2 混合单核苷酸的分离纯化及鉴定
以核酸酶P1酶解酵母RNA获得的核苷酸混合液上样,NH-1强酸型阳离子交换树脂吸附,蠕动泵控制流速,蒸馏水洗脱,使用部分收集器收集洗脱液,每管10~14mL。将收集的洗脱液依次测定254nm吸收值(A254nm)并绘制洗脱曲线。分别考查了上样液浓度、洗脱液流速以及树脂吸附时间与单核苷酸洗脱曲线的关系。
1.3.2.1 上样液浓度
分别采用5g/L和10g/L的RNA酶解液上样,色谱柱径高比为1∶15,在洗脱流速1mL/min的条件下绘制洗脱曲线。
1.3.2.2 洗脱液流速
以20g/L 的RNA酶解液上样,色谱柱径高比为1∶20,分别在洗脱流速0.5和1mL/min的条件下绘制洗脱曲线。
1.3.2.3 树脂吸附时间
以20g/L的RNA酶解液上样分别吸附0、3和8h,色谱柱径高比为1∶20,在洗脱流速05mL/min的条件下绘制洗脱曲线。
1.3.2.4 单核苷酸的鉴定
取0.7mL洗脱液溶于1mL KH2PO4-NaOH缓冲液(pH 7.0)中,混匀后测定其在220~300nm波长范围内的紫外吸收值,根据4种核苷酸的紫外吸收光谱特性(表1)鉴定单核苷酸种类。
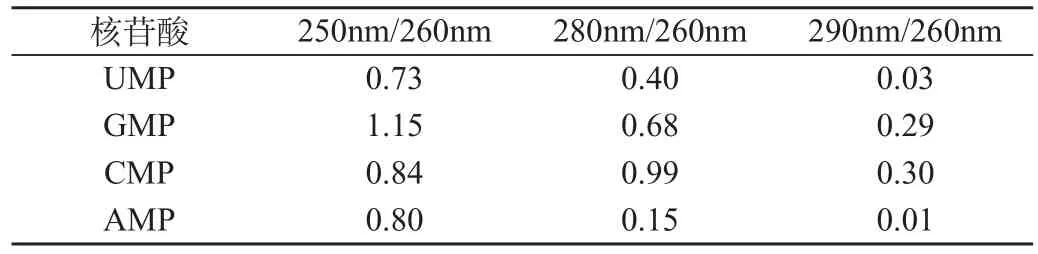
表1 4种单核苷酸的紫外吸收光谱特性
1.3.3 混合单核苷酸的RP-HPLC检测
反相色谱是迄今在高效液相色谱中应用最广泛的技术,主要是因为它适用于分析绝大多数的非极性物质和很多可离子化的化合物[10-12]。本文通过优化色谱条件建立反相高效液相色谱检测核苷酸的方法,并运用外标法对混合5’-单核苷酸的分离效果进行检测。
首先对色谱条件进行优化选择,采用单一标准核苷酸分别进样,流动相为pH 5.5的KH2PO4与甲醇(95∶5),进样浓度为0.1mg/L,检测波长为260nm。
1.3.3.1 盐浓度
分别在流速1和0.5mL/min的条件下,考查了10~30mmol/L KH2PO4溶液浓度对4种标准核苷酸保留时间的影响。
1.3.3.2 流速
在流动相为10mmol/L KH2PO4条件下,改变流速(1、0.8、0.5、0.3mL/min),检测4种标准核苷酸的保留时间。
1.3.3.3 pH
在30mmol/L KH2PO4溶液、流速0.5mL/min条件下,改变KH2PO4溶液的pH(4.5、5.5、6.5),检测4种标准核苷酸的保留时间。
1.3.3.4 梯度洗脱
在30mmol/L KH2PO4溶液、流速0.5mL/min条件下,分别采用KH2PO4∶甲醇=100∶0→95∶5,10min;KH2PO4∶甲醇=100∶0→95∶5,20min;KH2PO4∶甲醇=100∶0→97∶3,15min,97∶3→95∶5,1min不同条件梯度洗脱,考查4种标准核苷酸保留时间。
在选择的最佳色谱条件下,以0.1、0.2、0.3、0.4、0.5mg/L不同浓度的4种标准核苷酸混合液分别进样,根据峰面积和浓度制作标准曲线。将前述阳离子交换树脂分离的4种单核苷酸样品进行RP-HPLC检测,根据峰面积和标准曲线分别计算4种核苷酸的浓度。
2 结果与讨论
2.1 混合单核苷酸的分离条件
2.1.1 上样液浓度对洗脱曲线的影响
不同浓度酶解液上样洗脱曲线如图1。由实验结果可知,NH-1强酸型阳离子交换树脂可将混合核苷酸分离得到4种单核苷酸,但是5g/L上样液时第4个峰峰值偏小;增加浓度至10g/L后4个峰均明显,第4个峰值有所提高。对于一定量的树脂而言,条件相同的情况下,可吸附核苷酸的质量是一定的,所以在一定范围内增加上柱液浓度,有利于更多的样品被吸附,提高分离效率。
2.1.2 流速对洗脱曲线的影响
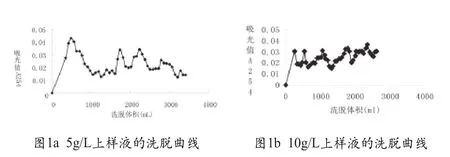
图1 不同上样液浓度对混合核苷酸分离的影响
不同流速的洗脱曲线如图2。由实验结果可知,洗脱流速为1mL/min时,4个峰可以基本分离,但是峰值小,并且杂峰较大;降低流速至0.5mL/min后,各个峰值增加明显,杂峰明显减小。在交换层析时,为了保证有效交换,两相需要有充分的接触时间,若接触时间短则有可能导致吸附不完全,出现洗脱液重叠交叉,不能完全分开的问题,所以适当降低流速有利于增加两相的接触时间,提高吸附效果从而改善分离效率。
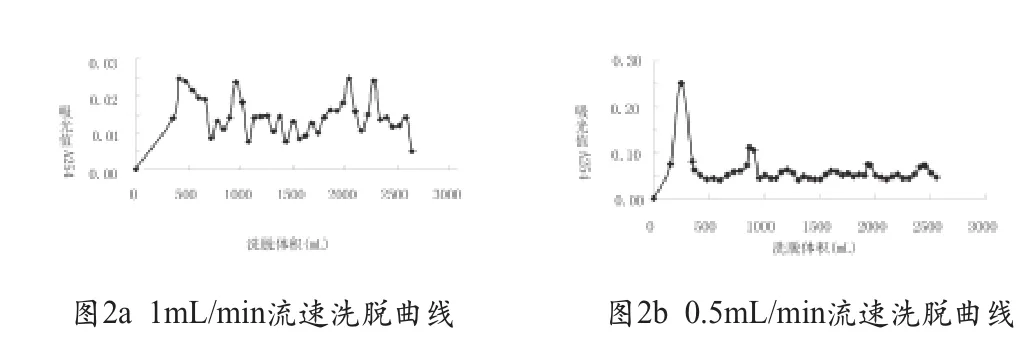
图2 不同流速对混合核苷酸分离的影响
2.1.3 吸附时间对洗脱曲线的影响
相同条件下改变吸附时间的结果见图3。从混合核苷酸洗脱曲线可知,随着吸附时间延长,核苷酸的分离效果有所提高,吸附8h洗脱曲线中4个峰的分离效果明显好于吸附3h和吸附0h。两相的有效吸附是分离的重要条件之一,增加吸附时间,是保证两相充分吸附的最直接简便的方法,可以有效改善分离效果。
2.2 单核苷酸的定性鉴定
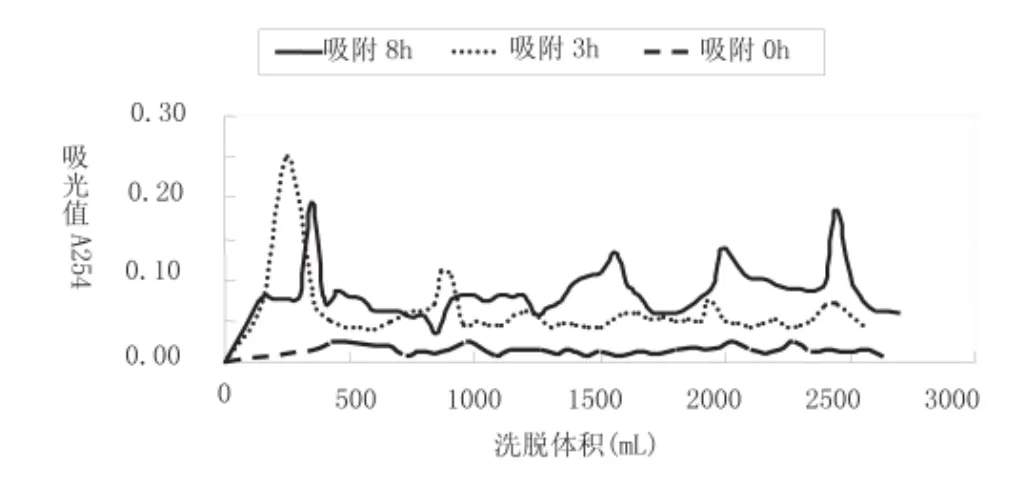
图3 不同吸附时间对混合核苷酸分离的影响
采用分光光度法检测单核苷酸的种类,结果见表2。将得出的数值与表1进行对比,鉴定出4种核苷酸的洗脱顺序为UMP、GMP、CMP、AMP,此洗脱顺序符合分离原理,进一步证实本研究的分离条件和分离方法有效。
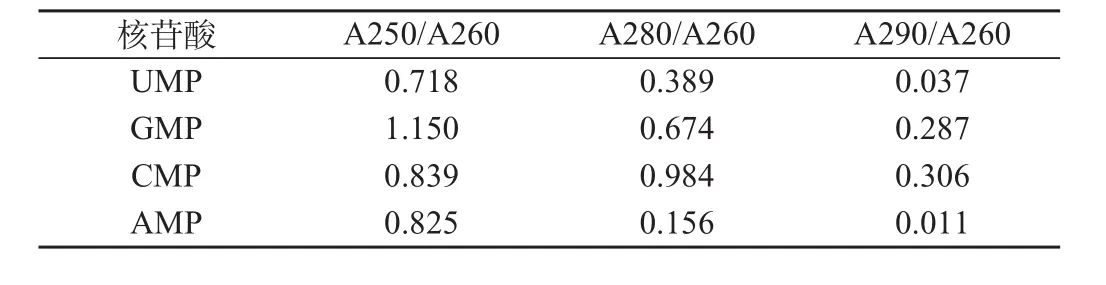
表2 4种单核苷酸定性鉴定结果
2.3 混合单核苷酸RP-HPLC的色谱条件
2.3.1 盐浓度对分离效果的影响
不同流速条件下改变 KH2PO4溶液浓度,检测各标准核苷酸的保留时间,结果见表3。可以看出,相同流速条件下,随着流动相盐浓度的提高,4种样品保留时间不同程度延长,分离度有所提高;而同一盐浓度时,降低流速效果更佳。例如流速为0.5mL/min时,当KH2PO4溶液从20mmol/L 增加到30mmol/L,CMP和UMP的分离度由0.45上升至0.52,因此选定30mmol/L KH2PO4溶液为最佳盐浓度。
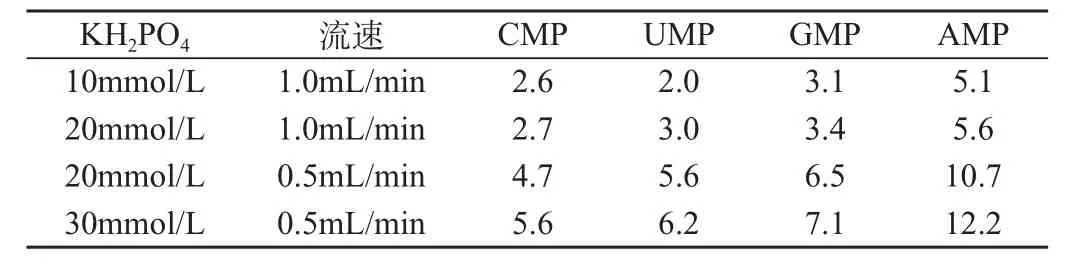
表3 不同盐浓度的单核苷酸保留时间(min)
2.3.2 流速对分离效果的影响
不同流速对各标准核苷酸保留时间的影响结果见表4。结果显示,随着流速减小,单核苷酸的分离度逐渐增加,保留时间也随之延长。当流速为0.3mL/min时,CMP和UMP的分离度为0.31;而流速为0.5mL/min时,4种核苷酸保留时间基本分开,CMP和UMP的分离度为0.29。综合盐浓度考察结果,确定0.5mL/min为流动相的最佳流速。
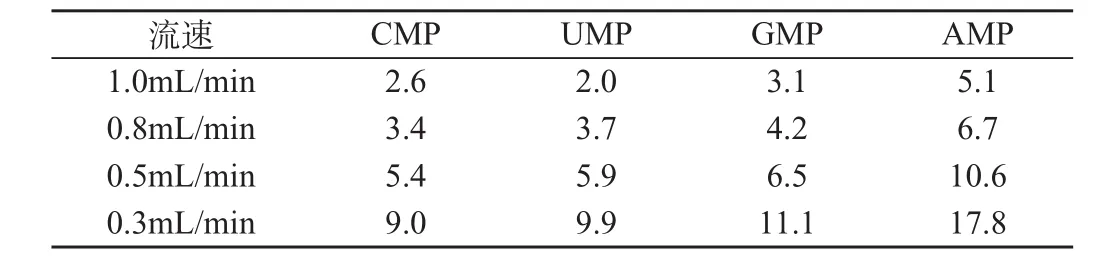
表4 不同流速的单核苷酸保留时间(min)
2.3.3 pH对分离效果的影响
不同KH2PO4溶液pH条件下,检测的各标准核苷酸保留时间结果见表5。由结果可知,流动相的pH变化对单核苷的保留时间有不同程度的影响。当KH2PO4溶液的pH为4.5时,4种核苷酸的保留时间非常接近,几乎无法分开,分析原因是由于核苷酸随流动相pH降低,其有机酸的解离性质被抑制;pH升高至5.5时,随着核苷酸的解离,各单核苷酸的保留时间有所增加,4种核苷酸基本分开;但是pH至6.5时,4种核苷酸的分离程度下降,CMP和UMP的分离度(0.41)<pH 5.5的分离度(0.52)。因此,选择pH为5.5为KH2PO4溶液的最佳色谱条件。
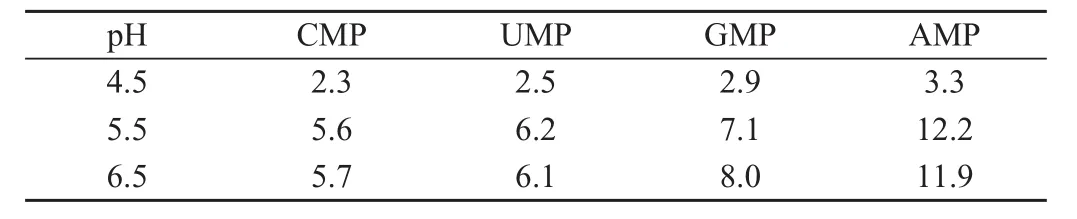
表5 不同pH的单核苷酸保留时间(min)
2.3.4 梯度洗脱对分离效果的影响
分析单一标准核苷酸的检测结果可知,AMP分离效果较好,CMP、UMP和GMP可基本分离但是效果不理想,特别是CMP和UMP保留时间较近,在核苷酸混合液走样时有重叠的可能。因此,进一步探索不同梯度洗脱条件对各标准核苷酸保留时间的影响,结果见表6。KH2PO4溶液与甲醇比例从100∶0降至95∶5的梯度洗脱,4种核苷酸保留时间有所延长,GMP可以分开,但CMP与UMP保留时间仍较为接近。采用15min内KH2PO4溶液与甲醇比例从100∶0降至97∶3,再于1min内将二者比值降至95∶5,避免AMP保留时间过长,此时CMP与UMP分离效果较好。
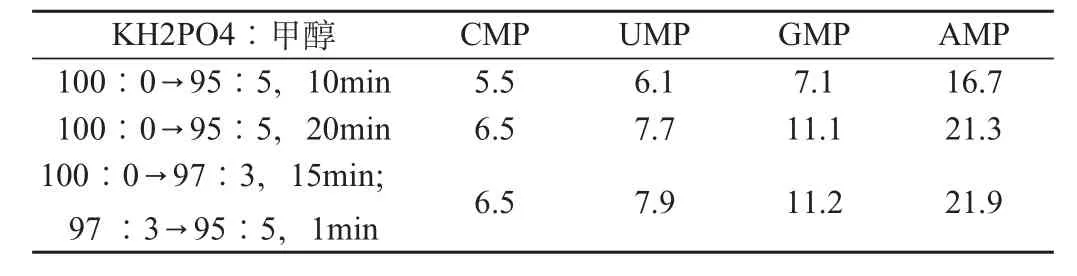
表6 不同梯度洗脱条件的单核苷酸保留时间(min)
最终获得的RP-HPLC色谱条件为:流动相30mmol/L KH2PO4(pH 5.5)-甲醇,流速0.5mL/min,梯度洗脱条件KH2PO4∶甲醇=100∶0→97∶3,15min,97∶3→95∶5,1min,检测波长:260nm。混合单核苷酸检测结果如图4,在此条件下4种核苷酸可以有效分离。
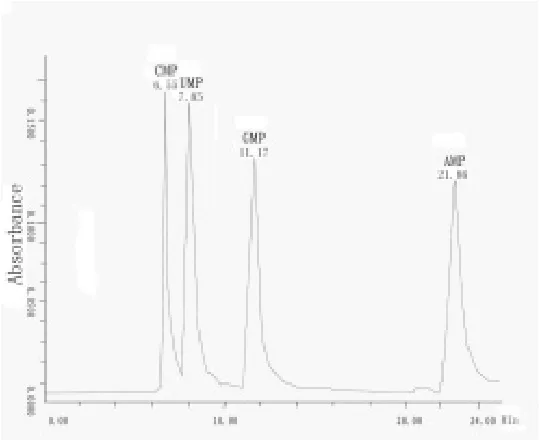
图4 混合单核苷酸RP-HPLC图谱
2.4 标准曲线及核苷酸的定量测定
在选择的最佳色谱条件下制作标准曲线见图5,不同吸附时间条件下分离的4种核苷酸测定结果如图6和图7。由实验结果可知,增加吸附时间,分离得到的单核苷酸浓度有不同程度的增加,进一步说明,两相的有效吸附是分离的重要因素,增加吸附时间是保证两相充分吸附的最直接有效方法。
3 结 论
采用NH-1阳离子交换树脂分离核酸酶P1酶解RNA产物,最佳分离条件为:RNA酶解液上样浓度20g/L,色谱柱径高比1∶20,吸附8h,洗脱流速0.5mL/min,可将混合核苷酸有效分离,分光光度法检测鉴定单核苷酸的洗脱顺序依次为UMP、GMP、CMP、AMP。
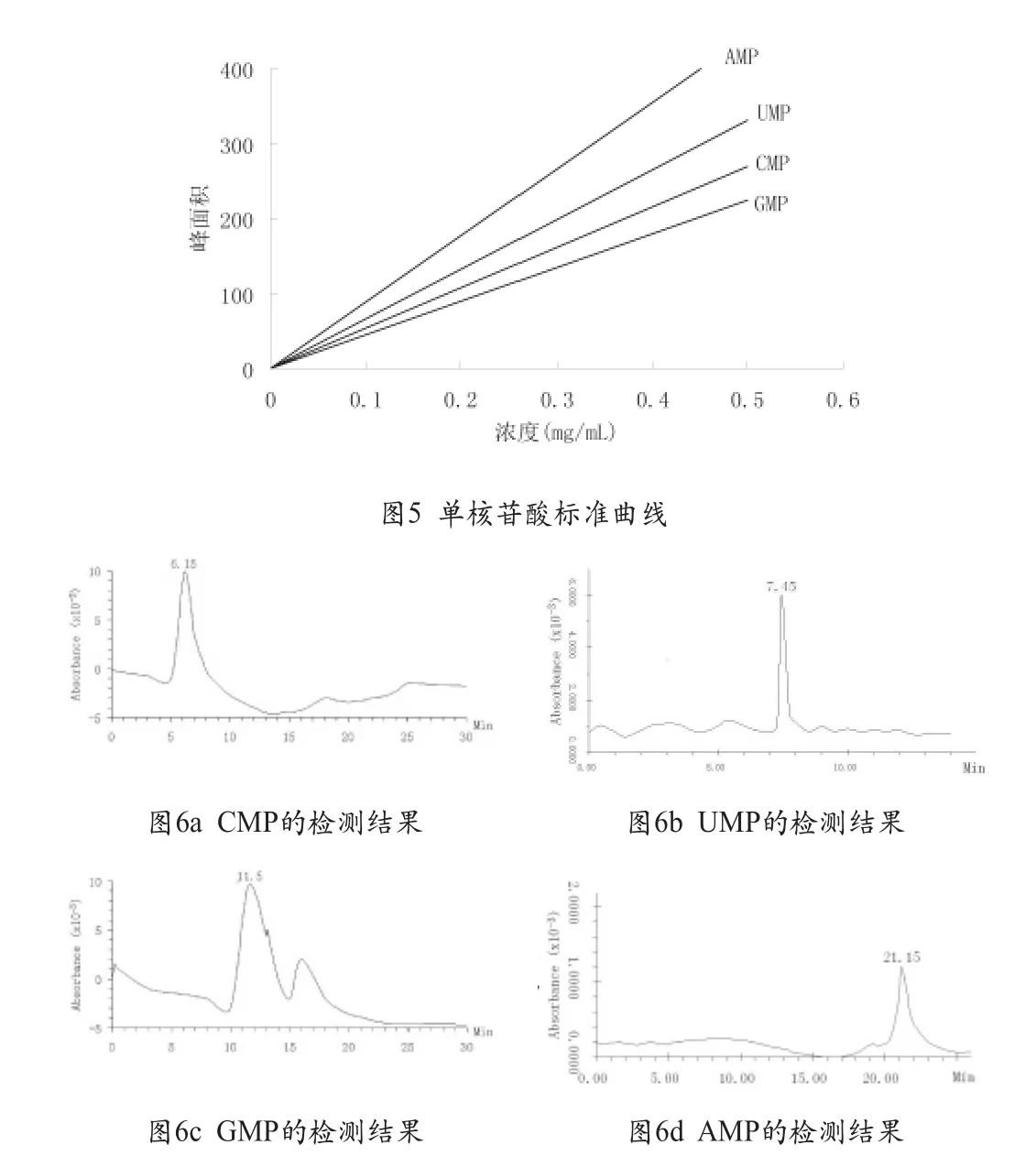
图6 样品单核苷酸RP-HPLC图谱
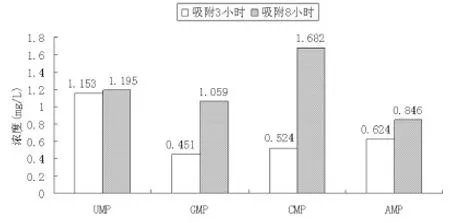
图7 不同吸附时间混合核苷酸的分离结果
建立了反相高效液相色谱检测核苷酸的方法,得到的最佳色谱条件为:流动相KH2PO4-甲醇,在30mmol/L KH2PO4(pH 5.5)以及0.5mL/min流速条件下,按照KH2PO4∶甲醇=100∶0→97∶3,15min,97∶3→95∶5,1min进行梯度洗脱。通过外标法对混合单核苷酸的分离效果进行检测,证明增加吸附时间是改善分离效果的重要因素。
[1] 廖红东,莫晓燕.核酸酶P1研究进展[J].药物生物技术,2004,11(3):190-193.
[2] 钱敏,李关荣,鲁成.核糖核酸研究进展[J].蚕业科学,2004,30(2):185-190.
[3] 张志军,温明浩,王克文,等.核苷酸生产技术现状及展望[J].现代化工,2004,24(11):19-23.
[4] 徐燚.核苷酸制备工艺的研究[D].南京:南京工业大学,2002.
[5] Cihlar T,Rosenberg I.Ef fi cient separation of natural ribonucleotides by low-pressure anion-exchange chromatography[J].J.Chromatog,1993,644(2): 299-305.
[6] 王光柱.5’-混合脱氧单核苷酸分离纯化的工艺研究[D].杭州:浙江大学,2006.
[7] 肖林平,徐正军,何明芳,等.NH-1分离5’-核苷酸的研究[J].离子交换与吸附,2003,19(5):430-436.
[8] Halder A,Sa B.Preparation and in vitro evaluation of polystyrenecoated diltiazem-resin complex by oil-in-water emulsion solvent evaporation method[J].AAPS Pharm SciTech,2006,7(2): 105-112.
[9] Ozawa M,Koyama S,Suzuki T.Innovative separation method for advanced spent fuel reprocessing based on tertiary pyridine resin[J].Czechoslovak J Phys,2006,56(1): 579-587.
[10] 邹耀洪.香菇中5’-核苷酸的高效液相色谱-质谱分析[J].食品科学,2005,26(1):196-198.
[11] Brockstedt U,Pfau W.Reversed-Phase High-Performance Liquid Chromatographic Separation of 32p-Labeled Nucleotlde Adducts Formed by Food-Derived Carcinogenic Aminoimidazoazarenes[J].Chromatographia,1999,50(9):547-552.
[12] Shimelis O,Giese RW.Nuclease P1 digestion/high-performance liquid chromatography,a practical method for DNA quantization [J].J Chromatography A,2006,1117(1):132-136.
Q524
B
1671-8194(2010)21-0045-04
西安交通大学生命科学与技术学院(710049)

