靶向KDR siRNA与5-氟尿嘧啶对PC3细胞增殖的协同抑制
赵京生,缪应业,李 浩,易伟国,李玉玲
前列腺癌是欧美国家重要的男性肿瘤疾病,目前美国前列腺癌的病死率已超过肺癌,成为第一位的危害男性健康的肿瘤疾病,前列腺癌在我国的发病率呈逐年上升的趋势。目前临床上治疗前列腺癌的药物有5-氟尿嘧啶(5-FU)等药物,5-FU为嘧啶类氟化物,属于抗代谢肿瘤药,对增殖性细胞均有杀伤性作用。研究发现5-FU细胞毒性作用迅速减弱,且大多存在耐药性。本研究利用KDR siRNA质粒表达载体转染前列腺癌细胞株PC3,研究其对耐药细胞药物敏感性的影响,为前列腺癌的治疗提供新方法。
1 材料和方法
1.1 材料 pSilencerTM3.1-H1 neo质粒购自美国
Ambion公司;Lipofectamine 2000转染试剂购自美国Invitrogen公司;PC3细胞株为本室保存;小牛血清为杭州四季青公司;四氮唑盐 (MTT)为美国Amresco公司;G418为北京赛泰克公司产品;5-FU为Sigma公司产品。
1.2 siRNA靶序列的设计、质粒重组、转化、测序与纯化 见文献[1]。
1.3 siRNA表达质粒转染PC3细胞 提取测序正确的siRNA表达载体并测定浓度。将PC3细胞按1×105/孔的数量转种于6孔培养板,siRNA表达载体转染PC3细胞按操作说明进行,每孔质粒用量为2 μg,脂质体用量为 5 μl。
1.3.1 siRNA转染后PC3细胞的生长曲线 转染后 24 h,消化下各孔PC3细胞,按5×103/孔的数量转种于 96 孔板,设 6 个时间点(24、36、48、60、72、84 h),每点4孔,培养至各时间点,MTT法检测吸光度 (A)值。以未转染和转染阴性对照质粒pSilencer3.1-NC的PC3细胞为对照。
1.3.2 细胞周期测定 收集转染后72 h的细胞,加预冷的无水乙醇快速混匀(终浓度为60%~70%)4℃固定1 h;PBS洗涤2次,每次加洗液2.5 ml左右, 离心半径 8 cm,1000×g离心 5 min; 加100 μl PBS调整细胞浓度,每份样品为8×105个细胞;加入1 ml PI染色液,室温下避光染色30 min;300目滤网过滤于流式细胞分析样品管,以流式细胞仪检测DNA-PI的荧光强度,结果采用Modit软件系统进行析。以未转染和转染阴性对照质粒pSilencer3.1-NC的PC3细胞为对照。
1.3.3 阳性克隆筛选 转染48 h后按1∶12比例稀释细胞传代培养,加G418(500 mg/ml)筛选阳性克隆,1次/3 d换含抗生素的培养基。14 d后加G418(500 mg/ml)维持阳性克隆,收集细胞分析。
1.4 MTT法检测 用于检测KDR干扰前后5-FU细胞毒性作用的变化。取对数生长期三组细胞(pSilencer3.1-KDR、pSilencer3.1-NC 和 PC3)接种于96孔板,每孔种5.0×103个细胞,接种后24 h每孔加入含不同浓度5-FU,5-FU浓度序列为0.00、1.00 ×102、5.00 ×102、2.50 ×103、1.25 ×104、6.25 ×104、3.13×105、1.56×106nmol/L。培养 48 h 后加 5 g/L MTT 20 μl/孔(调零孔除外),继续 37℃孵育 4 h后,吸取上清液加DMSO 150 μl/孔,紫色结晶完全溶解后,在酶联免疫仪570 nm波长下测吸光度A值。按公式计算药物对细胞生长的抑制率(IR):IR(%)=(1-实验孔 A 均值/对照孔均值)×100%。
1.5 统计学分析 用SPSS12.0统计分析软件进行方差分析。
2 结果
2.1 KDR siRNA抑制PC3细胞的生长 与pSilencer3.1-NC和 PC3对照组相比,pSilencer3.1-KDR组转染的PC3细胞的生长速度明显变慢(图1)。
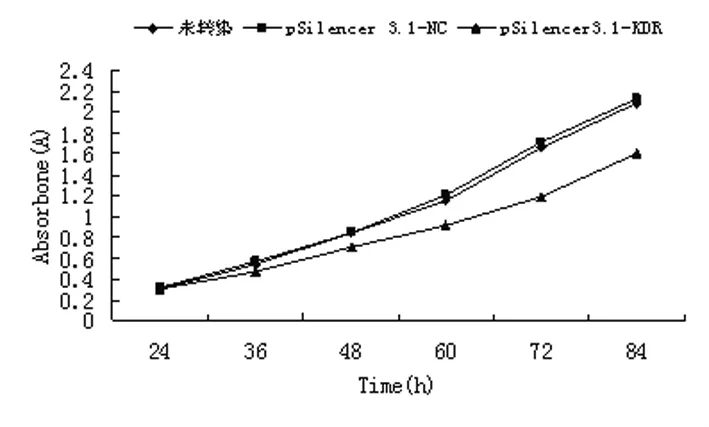
图 1 转染后PC-3细胞生长曲线
2.2 KDR siRNA对PC3细胞周期的影响 pSilencer 3.1-KDR组G0/G1期细胞数较未转染组增加了18.33%,较pSilencer 3.1-NC组增加了11.41%(P<0.01);进入S期和G2、M期的细胞数较未转染组分别减少了12.07%和6.26%,较pSilencer 3.1-NC 组减少了 8.21%和 3.2%(P<0.01,表 1)。
表 1 各增殖周期PC3细胞(±s,%)
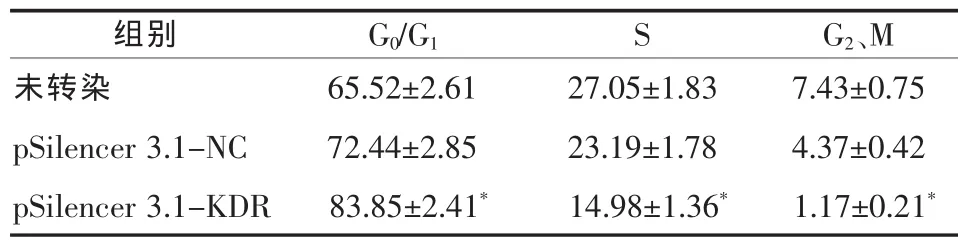
表 1 各增殖周期PC3细胞(±s,%)
与其余组比较,*P<0.01
组别 G0/G1 S G2、M未转染 65.52±2.61 27.05±1.83 7.43±0.75 pSilencer 3.1-NC 72.44±2.85 23.19±1.78 4.37±0.42 pSilencer 3.1-KDR 83.85±2.41* 14.98±1.36* 1.17±0.21*
2.3 KDR siRNA联合5-FU对PC3细胞药物敏感性的影响 5-FU IC50值在pSilencer 3.1-KDR组为 (898.34±44.34) nmol/L, 显 著 低 于 PC3 和pSilencer3.1-NC 组的 (1 692.30±87.33)nmol/L 和(1 688±86.41) nmol/L(P<0.01)。 后两组之间无统计学差异。
3 讨论
VEGF与其受体在肿瘤血管形成中起着关键的调节作用[2,3],能刺激血管内皮细胞分裂、增殖,诱导血管生成,有助于肿瘤的生长和转移。VEGFR家族的成员包括:VEGFR1(Flt-1)、VEGFR2(KDR/Flk-1)、VEGFR3(Flt-4)。 血管内皮生长因子受体Ⅱ,又称激酶功能区受体 (vascular endothelial growth factor Ⅱ,VEGFR2/kinase domain receptor,KDR),KDR是发挥功能的主要受体,KDR不仅表达于肿瘤组织的血管内皮细胞而且表达于肿瘤细胞的胞膜和(或)胞质,提示肿瘤细胞分泌的VEGF不仅以旁分泌方式作用于血管内皮细胞并诱导血管新生,也可通过自分泌途径与自身表面的受体结合而促进细胞生长或迁移、抑制细胞凋亡。研究表明,人前列腺癌细胞中有VEGF和KDR表达,存在VEGFKDR自分泌途径,与前列腺癌细胞的生长和转移密切相关[4,5]。阻断VEGF与KDR的相互作用就能抑制动物体内实体瘤的生长,达到治疗肿瘤、抑制肿瘤生长的目。
RNA 干扰(RNA interference,RNAi)是指双链RNA介导的、序列特异的转录后基因沉默的过程。它作为新兴的基因阻断技术,目前已广泛应用于基因功能及基因治疗的相关研究。
KDR siRNA表达质粒pSilencer 3.1-KDR转染PC3细胞后,抑制PC3细胞的生长,生长速度明显变慢;对PC3细胞周期的影响:pSilencer 3.1-KDR组G0/G1期细胞数较未转染组增加了18.33%,较 pSilencer 3.1-NC 组增加了 11.41%(P<0.01);进入S期和G2、M期的细胞数较未转染组分别减少了12.07%和6.26%,较pSilencer 3.1-NC组减少了8.21%和 3.2%(P<0.01)。
5-FU是影响核酸生物合成的药物,是抗代谢药物之一。这类药物模拟正常代谢物质,如叶酸、嘌呤碱、嘧啶碱等的化学结构,在细胞周期S期与有关代谢物质发生特异性的拮抗作用,从而干扰核酸,尤其是DNA的生物合成,阻止瘤细胞的分裂繁殖。本实验中用pSilencer 3.1-KDR转染PC3细胞,以 IC50(50%inhibition concentration)来表示前列腺癌细胞对化疗药物的敏感性。IC50越小,表示肿瘤细胞对化疗药物的敏感性越大;反之则表示敏感性越小。结果,KDR siRNA转染细胞的IC50明显降低,对5-FU的敏感性增加(P<0.01)。提示化疗药物与KDR siRNA联合用药,既可以提高疗效,还可以降低抗癌药物使用剂量,有助于克服单用化疗药所引起的不良反应大的缺点,并有助于解决单用siRNA治疗难以完全抑制肿瘤的生长且成本较高等问题。
总而言之,KDR siRNA能够具有选抑制PC3细胞增长,可将更多的细胞阻滞在G0~G1期,阻止细胞进入S期,从而抑制细胞增殖。RNAi作为有效治疗方法为癌症提供一种潜在的治疗方式。因此,本研究也可能为前列腺癌提供一种潜在的治疗方法,即将基因治疗与化疗药物相结合,以增强肿瘤细胞对化学药物的敏感性,降低化疗药物的临床用量,减少药物的不良反应。
[1]缪应业,刘 新,李 浩.siRNA沉默PC-3细胞中KDR基因的表达. 第四军医大学学报,2008,29(19):1733.
[2]Suhardja A,Hoffman H.Role of growth factors and their receptors in proliferation of microvascular endothelial cells[J].Microsc Res Tech,2003,60(1):70.
[3]Underiner TL,Ruggeri B,Gingrich DE.Development of vascular endothelial growth factor receptor(VEGFR)kinase inhibitors as anti-angiogenic agents in cancer therapy[J].Curr Med Chem,2004,11(6):731.
[4]Strohmeyer D,Rossing C,Bauerfeind A,et al.Vascular endothelial growth factor and its correlation with angiogenesis and p53 expression in prostate cancer[J],Prostate,2000,45(3):216.
[5]Ferrer FA,Miller LJ,Andrawis RI,et al.Angiogenesis and prostate cancer:in vivo and in vitro expression of angiogenesis factors by prostate cancer cells[J].Urology,1998,51(1):161.

