慢性前脑缺血致痴呆大鼠 IL-1β、IL-6及 TNF-α的研究
金 涛, 吴 江, 邹昕颖, 张海宁, 孙 莉
血管性痴呆(Vascular dementia,VD)是老年期痴呆的重要类型。以往认为血管性痴呆是脑梗死所致。近年来临床研究发现:慢性脑灌注不足尤其是皮质下白质脑血流量慢性持续性下降可能是导致血管性痴呆的主要原因之一,故慢性缺血在 VD发病机制中所起的作用开始引起人们关注。在前期工作中,我们采用双侧颈总动脉永久结扎方法成功制备了慢性前脑缺血动物模型,应用激光多普勒血流仪检测了各组大鼠术后不同时间点额叶、顶叶、海马及皮质下区局部脑血流量,利用 Morris水迷宫法检测各组大鼠的记忆功能,结果显示双侧颈总动脉永久结扎可导致大鼠出现慢性持续性脑血流量下降及持续性认知功能障碍,说明我们的慢性缺血致血管性痴呆大鼠造模成功[1]。长期以来,免疫炎症反应作为脑缺血损伤级联反应中重要的一环一直倍受人们的关注。其中,IL-1β、IL-6及 TNF-α被视为与中枢神经系统缺血相关的最主要炎症反应分子。至今,人们对 IL-1β、IL-6及 TNF-α在缺血方面的研究多集中在急性脑缺血尤其是短暂脑缺血后再灌注方面[2~4],而在慢性脑缺血方面研究甚少,有关慢性脑缺血致血管性痴呆大鼠 IL-1β、IL-6及 TNF-α经时变化的基础研究国内外尚未见报道。
本实验在前期工作基础上,采用双侧颈总动脉永久结扎方法制备慢性前脑缺血动物模型,并采用免疫组织化学方法检测痴呆大鼠海马及颞叶皮质中炎性因子 IL-1β、IL-6及 TNF-α的经时变化,以期阐明 IL-1β、IL-6及 TNF-α在慢性脑缺血致血管性痴呆发病机制中的作用,为临床上防治血管性痴呆提供理论依据。
1 材料和方法
1.1 动物模型制备 选用长春高新医学动物实验研究中心提供的健康雄性 Wistar大鼠 150只,鼠龄 3~5个月,体重 300~350g。随机分为对照组和实验组,实验组又分为手术后 24h组、1w组、半个月组、1个月组、2个月组、3个月组及 4个月组。采用双侧颈总动脉永久结扎方法制备慢性前脑缺血动物模型,具体方法如下:大鼠术前 12h禁食,4h禁水。用 1%戊巴比妥钠(10mg/kg)腹腔注射麻醉,保证手术期间有自主呼吸。仰卧固定,颈部去毛、强力碘消毒后沿颈正中切开,分离双侧颈总动脉,并套以“0”号线。分别结扎双侧颈总动脉的远近端,并从中间剪断,以确保阻断动脉血流。术中大鼠肛温保持在 36.5℃ ~37.5℃,手术后动物送至有通风和空调设备的动物房饲养。对照组(假手术组)除不结扎、不剪断双侧颈总动脉外,其余过程与手术组相同。
1.2 行为学检测 采用 Morris水迷宫法进行大鼠记忆功能的测定[1]。
1.3 脑血流量测定 应用瑞典 Perimed AB公司生产的 PeriFlux System 5000型激光多普勒血流仪(LDP)检测各组大鼠术后不同时间点(术后 24h、1w、半个月 、1个月 、2个月 、3个月 、4个月 )额叶、顶叶、海马及皮质下区局部脑血流量(rCBF)[1]。
1.4 免疫组化检测痴呆大鼠海马及颞叶皮质中 IL-1β、IL-6及 TNF-α的表达 免疫组织化学染色采用链霉素抗生物素蛋白-过氧化物酶连接法(SP法),其步骤如下:(1)石蜡切片常规脱蜡经乙醇脱水;(2)PBS冲洗 5min×3;(3)3%H2O2-蒸馏水阻断内源性过氧化物酶 25min;(4)PBS冲洗 5min×3;(5)将切片置入盛有抗原修复液的容器中,抗原修复液为 0.01mol pH=6.0的枸橼酸盐缓冲液(工作液),置炉上加热至温度达到 92℃~98℃之间,保持5min关火,5min后从炉上移下,待温度冷却至70℃,入 PBS冲洗 5min×3;(6)加山羊血清(1∶20)封闭30min;(7)倾去多余的血清,滴加适当稀释的特异性一抗于切片上,4℃冰箱过夜;(8)PBS冲洗 5min×3;(9)滴加二抗(IgG/Biotin),孵育 40min;(10)PBS冲洗 5min×3;(11)滴加三抗(S-A/HRP)孵育40min;(12)PBS冲洗 5min×3;(13)DAB-蒸馏水溶液显色,显微镜下观察,控制反应时间;(14)Mayer苏木精复染,二甲苯透明,中性树胶封片。结果判定:免疫组化染色阳性结果为棕黄色或棕黑色颗粒。对照:用 PBS代替一抗做阴性对照。定量分析计数方法:在颞叶、海马区的锥体细胞层,在 20×10倍光镜下随机选择 5个视野,做免疫反应阳性细胞数计数,计数方法采用标准网格,以“个 /视野”为单位,结果取 5个视野的平均值。
2 结 果
2.1 痴呆大鼠海马及颞叶 IL-1β的变化 IL-1β免疫阳性细胞胞浆内出现棕黄色颗粒。对照组有少许的 IL-1β免疫阳性细胞,大鼠双侧颈总动脉永久结扎后 24h海马 IL-1β免疫阳性细胞数即明显增高并达高峰,颞叶在 1w时达高峰,以后均逐渐下降,至 4个月时仍明显高于对照组(见表1)。
2.2 痴呆大鼠海马及颞叶 IL-6的变化 IL-6免疫阳性细胞胞浆内出现棕黄色颗粒。对照组有少许的 IL-6免疫阳性细胞,大鼠双侧颈总动脉永久结扎后 24h海马及颞叶IL-6免疫阳性细胞数即明显增高,并均于 1w时达高峰,以后逐渐下降,至 4个月时仍明显高于对照组(见表2)。

表1 痴呆大鼠海马区及颞叶皮质 IL-1β免疫阳性细胞的比较
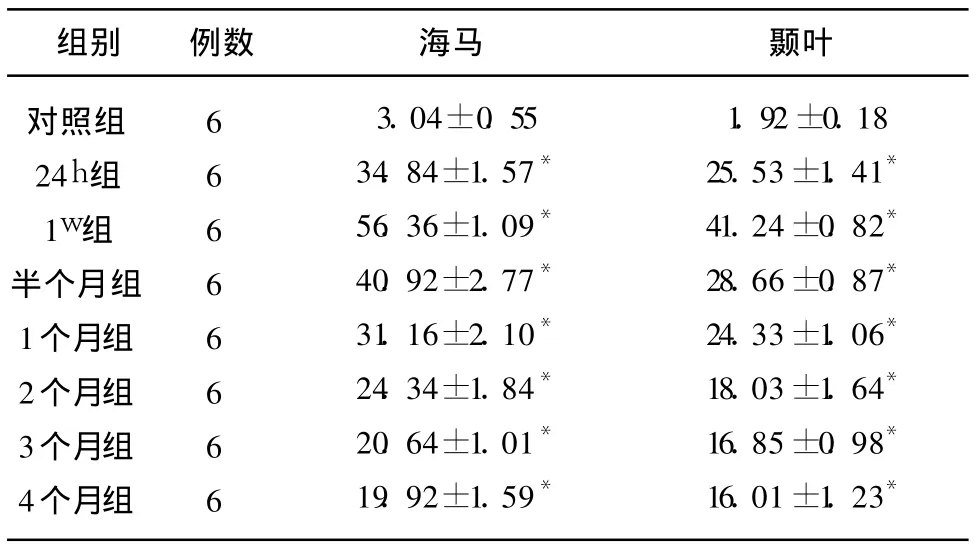
表2 痴呆大鼠海马区及颞叶皮质 IL-6免疫阳性细胞的比较
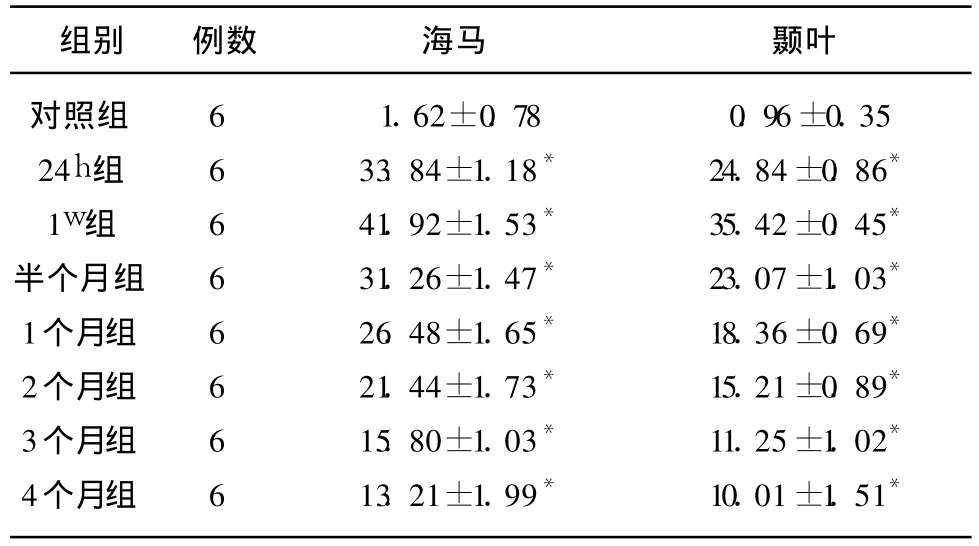
表3 痴呆大鼠海马区及颞叶皮质 TNF-α免疫阳性细胞的比较
2.3 痴呆大鼠海马及颞叶 TNF-α的变化TNF-α免疫阳性细胞胞浆内出现棕黄色颗粒。对照组有少许的 TNF-α免疫阳性细胞,大鼠双侧颈总动脉永久结扎后24h海马及颞叶TNF-α免疫阳性细胞数即明显增高,并均于 1w时达高峰,以后逐渐下降,至 4个月时仍明显高于对照组(见表3)。
3 讨 论
认知功能障碍是一个复杂的病理过程,发病机制有很多学说。与记忆有关的脑内结构主要是大脑皮质联合区、海马及其邻近结构、丘脑等。远事记忆贮存部位主要在大脑皮层特别是额叶、颞叶;近事记忆在边缘系统,其中海马是近事记忆信息转变、贮存的主要部位。前期工作中,我们选择颞叶、海马作为观察点,发现颞叶皮质锥体细胞从术后 24h出现水肿、缺血,以后逐渐发展成凝固性坏死、变性,锥体细胞慢性进行性脱失伴胶质细胞增生;海马区锥体细胞也从最初的水肿、缺血逐步发展成严重脱失、基质疏松、微空泡形成,各实验组均未见明显梗死灶[5]。Sontag等曾报道,将大鼠双侧颈总动脉结扎 60min后处死,并无明显的梗死灶[6],这与我们的研究结果相似。虽然各实验组均未见明显梗死灶,而大鼠的认知功能障碍却持续存在[1],我们认为这与颞叶皮质及海马区的神经元慢性进行性变性、脱失有关。
以往认为,中枢神经系统(CNS)是受血脑屏障保护的“免疫特免器官”,脑组织仅有很低的免疫活性[7],然而近 10年来不断涌现的免疫组织化学与分子生物学证据表明,脑具有一个活跃的内源性免疫系统,脑内的慢性炎症可能在多种神经系统疾病的进行性神经元死亡过程中起重要作用[8]。长期以来,免疫炎症反应作为脑缺血损伤级联反应中重要的一环一直倍受人们的关注。其中,IL-1β、IL-6及TNF-α被视为与中枢神经系统缺血相关的最主要炎症反应分子。至今,人们对 IL-1β、IL-6及 TNF-α在缺血方面的研究多集中在急性脑缺血尤其是短暂脑缺血后再灌注方面[2~4],而在慢性脑缺血方面研究甚少,有关慢性脑缺血致血管性痴呆大鼠 IL-1β、IL-6及 TNF-α经时变化的基础研究国内外尚未见报道。为了进一步探讨慢性缺血致血管性痴呆的炎症机制,本实验采用双侧颈总动脉永久结扎方法制备慢性前脑缺血动物模型,通过免疫组织化学方法检测痴呆大鼠海马区及颞叶皮质 IL-1β、IL-6及 TNF-α的经时变化情况,研究发现对照组大鼠的海马区及颞叶皮质仅有 IL-1β、IL-6及 TNF-α的少量表达,而大鼠双侧颈总动脉永久结扎后海马区及颞叶皮质IL-1β、IL-6及 TNF-α免疫阳性细胞数明显增高,其免疫阳性细胞主要为星形胶质细胞、小胶质细胞和神经元。其中,IL-1β在海马于术后 24h呈现表达高峰,在颞叶则于 1w时达高峰,以后均有所下降,直至4月其表达仍明显高于对照组。而 IL-6及 TNF-α在海马及颞叶均于 1w时呈现表达高峰,以后逐渐下降,至 4个月时表达仍明显高于对照组。我们推测细胞因子 IL-1β、IL-6及 TNF-α在慢性脑缺血大鼠脑内星形胶质细胞、小胶质细胞和神经元中的持续高表达,可能是由于大鼠脑血流量的持续下降引起。脑组织新陈代谢率很高,脑重量只占体重的 2.2%,脑血流量却占心输出量的 15%[6]。当脑灌注压开始降低时,正常组织通过扩张血管,动用循环储备来维持 rCBF不变,当 rCBF进一步下降,因能量供应不足,出现细胞膜电位不稳,Na+-K+泵障碍,细胞膜功能受损。Kanno等研究认为,脑缺血的功能阈值为正常脑血流量的 50%,当脑血流量低于正常的 30%时,将出现梗死灶[9]。本组实验大鼠脑血流量下降程度未达到引起梗死的阈值,所以梗死灶出现较少,而这种脑血流的降低作为一种较弱的刺激,虽不足以引起神经细胞坏死,但可能会刺激星形胶质细胞、小胶质细胞和神经元分泌 IL-1β、IL-6及 TNF-α,并通过一系列免疫炎症级联反应介导脑缺血损伤。结合脑血流量变化、病理学及行为学改变我们推测 IL-1β、IL-6及 TNF-α的慢性持续性高表达在慢性脑缺血致血管性痴呆的病理损伤过程中起重要作用。已有实验证实,应用免疫抑制剂 FK506可以阻止大鼠慢性脑缺血所致的白质疏松及神经元损伤[10]。由此提示我们在治疗慢性脑缺血致血管性痴呆的过程中,辅助抗炎治疗可能会阻断炎性因子所致的炎症级联损伤,从而延缓血管性痴呆的病情进展。
[1] 孙 莉,金 涛,丁艳华,等.慢性前脑缺血致痴呆大鼠脑血流量及行为学对比研究[J].中国老年学杂志,2009,29:920-922.
[2] Liu T,Mcdonnell PC,Young PR,et al.Interleukin-1βmRNA expression in ischemic rat cortex[J].Stroke,1993,24:1746-1751.
[3] Berti R,Williams AJ,Moffett JR,et al.Quantitative real-time RT-PCR analysis of inflammatory gene expression associated with ischemia reperfusion brain injury[J].J Cereb Blood Flow Metab,2002,22(9):1068-1079.
[4] Yang GY,Gong C,Qin Z,et al.Inhibition of TNF-alpha attenuates infarct volume and ICAM-1 expression in ischemic mouse brain[J].Neuroreport,1998,9:2131-2134.
[5] 孙 莉,张 昱,邹昕颖,等.慢性前脑缺血致痴呆大鼠皮质及皮质下白质区病理学变化的对比研究[J].中风与神经疾病杂志,2004,21(5):403-405.
[6] 冯新为主编.病理生理学[M].第 3版:北京,人民卫生出版社,1990.
[7] McGeer EG,Mc Geer PL.The importance of inflammatory mechanisms in Alzheimer disease[J].Exp Gerontol,1998,33:371-378.
[8] McGeer PL,Mc Geer EG.The inflammatory response system of brain:implications for therapy of Alzheimer and other neurodegenerative diseases[J].Brain Res Rev,1995,21:195-218.
[9] Kanno I,Vemura S,Higro S,et al.Oxygen extraction fraction at maxillary vasodilated tissuein theischemic brain estimated from the regional CO2 responsiveness measured by positron emission tomography[J].J Cereb Blood Flow Metab,1998,8:227-235.
[10] Wakita H,Tomimoto H,Akiguchi I,et al.Dose-dependent,protective effect of FK506 against white matter changes in the rat brain after chronic cerebral ischemia[J].Brain Res,1998,792:105-113.

