腺苷预处理对大鼠局灶性脑缺血再灌注损伤的脑保护作用
白建梅 刘宏志 谭 军
1)新乡医学院第三附属医院神经内科 新乡 453003 2)天津市第一中心医院内科 天津 300011 3)新乡医学院第三附属医院神经内科 新乡 453003
脑血管疾病(cerebrovascular disease,CVD)尤其是缺血性脑血管病(ischemic cerebrovascu lar diseases,ICVD)是神经系统常见病及多发病。脑缺血再灌注损伤可导致多种因素引起神经细胞死亡,因此采用神经保护剂减轻脑缺血再灌注损伤日益受到人们的重视。众多实验研究表明,腺苷具有脑保护作用。本实验运用腺苷进行预处理,观察脑缺血再灌注后脑组织病理变化,应用免疫组化方法观察对Bax蛋白表达的影响,进一步揭示腺苷的脑保护作用机制,为临床治疗提供一条思路。
1 材料与方法
1.1 实验动物及分组 健康雄性SD大鼠60只,体质量(270±20)g,由新乡医学院实验动物中心提供。随机分为假手术组(F组)、缺血再灌注组(IR组)、腺苷预处理组(AP组),每组20只,依术后处死动物时间的不同,每组再分为4个亚组:2 h、6 h、24 h 和 72 h 组(F 2、6、24、72 h,IR 2、6、24、72 h,AP 2、6、24、72 h),每个亚组5只动物。假手术组和缺血再灌注组于手术前3 d经腹腔注射生理盐水2 mL,1次/d,共3次。腺苷预处理组术前3 d经腹腔注射腺苷注射液,1.5 mg◦kg-1,生理盐水稀释至2 mL,1次/d,共3次。
1.2 主要药品及主要试剂 腺苷注射液(adenosine injection)主要成分为腺苷(化学名称为 6-氨基-9-β-D-呋喃核糖基-9-H-嘌呤:6 mg/2 mL),批准文号:国药准字H 20030320,生产厂家:沈阳光大制药有限公司。Bcl-2抗体购于Santa C ruz Biotechno logy.Inc;PV-6001免疫组化试剂盒和DAB显色试剂盒均购于北京中杉金桥生物技术有限公司 。
1.3 缺血再灌注模型建立[1]10%水合氯醛(0.3 mL/100 g)麻醉大鼠,暴露并分离左侧颈总动脉(CCA)、颈外(ECA)和颈内(ICA)动脉,电凝颈外动脉的分支甲状腺上动脉、咽升动脉、ICA与ECA间的交通动脉,结扎ICA分支翼腭动脉(PPA)。将前端涂有指甲油的尼龙线由ECA插入,经CCA入ICA。尼龙线插入深度(18.5±0.5)mm。缺血2 h后将栓线拉出至ECA实现再灌注。假手术组除不插线栓外,其余步骤同上。实验中保持大鼠体温(37±0.5)℃至苏醒。
1.4 病理观察 各组大鼠用10%水合氯醛(0.17 mL/100 g)深麻醉后,先以生理盐水再以4%多聚甲醛快速心脏灌注,取视交叉前后各2 mm的脑组织块在多聚甲醛中固定、脱水透明,石蜡包埋后切片,片厚 4μm,行HE染色,光镜观察。其余脑组织切片行Bax免疫组化染色。
1.5 Bax免疫组化检测 步骤:(1)将烤好的切片脱蜡、水化。(2)胰蛋白酶修复液进行抗原修复30 min。(3)3%H2O2,室温孵育10 m in。(4)滴加一抗(Bax 1∶150),4℃过夜。(5)滴加生物素标记的二抗,室温下孵育30 m in。(6)DAB显色。(7)蒸馏水终止反应,封片。Bax阳性细胞的胞浆染成棕黄色。应用HPIAS-2000显微图像处理系统采集图片,每张切片随机取5个高倍镜视野(400×),计数Bax阳性细胞数,取其平均值。
2 结果
2.1 HE染色病理观察 光镜下假手术组脑组织皮层内未见坏死区域,神经元和神经胶质细胞结构、形态正常,间质致密无水肿。缺血再灌注组大鼠脑组织显示大脑皮质有坏死区,坏死区可见大量变性死亡的神经元、神经元层次排列紊乱,较多呈筛状坏死的坏死灶,神经细胞明显减少,残存神经细胞胞体缩小变形,核固缩,神经元纤维疏松,间质水肿明显。腺苷预处理组大鼠右侧脑组织显示病灶皮质染色稍浅,神经元结构完整,形态基本正常,间质水肿较轻。
光镜观察可以看出,假手术组见神经细胞形态正常,无损伤的形态学表现;缺血再灌注组神经细胞损伤严重,腺苷预处理组较缺血再灌注组损伤轻,说明腺苷预处理可以减轻大鼠脑缺血再灌注损伤区神经细胞损伤的程度,对神经细胞损伤有保护作用。

图1 缺血再灌注组6 h Bax阳性细胞×200

图2 腺苷预处理组6 h Bax阳性细胞×200

图3 缺血再灌注组24 h Bax阳性细胞×200
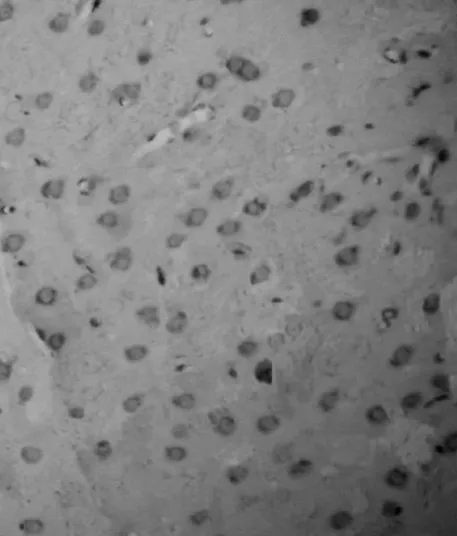
图4 腺苷预处理组24 h Bax阳性细胞×200
2.2 Bax免疫组化结果 阳性结果:Bax阳性细胞胞浆中有棕黄色颗粒表达。阴性对照:在脑组织坏死区及缺血半暗带区均未见有棕黄色颗粒表达的Bax阳性细胞。F组缺血中心区仅见微量的Bax表达。IR组再灌注2 h脑组织缺血中心区可见棕黄色颗粒的Bax阳性细胞明显表达。随后逐渐增多,于24 h表达水平最高;随着再灌注时间延长,Bax表达开始减少,但仍保持较高水平。见图1、2。AP组再灌注2 h脑组织缺血中心区可见棕黄色颗粒的Bax开始表达,24 h达高峰;随后逐渐减弱。见图3、4。各时间点Bax阳性细胞表达均低于IR组。见表1。
表1 不同时间各组大鼠脑组织内Bax的表达(±s)

表1 不同时间各组大鼠脑组织内Bax的表达(±s)
注:与F组比较,●P<0.05;与 IR组比较,□P<0.05;IR和AP组同一组内各时间点比较,■P<0.05
组别 2 h 6 h 24 h 72 h F 组 2.80±0.837 2.40±0.548 2.40±1.140 2.60±1.140 IR 组 12.20±2.387●痫 17.80±3.114●痫 32.40±1.817●痫 23.00±3.536●痫AP 组 6.80±1.483●□痫 11.60±2.702●□痫 23.20±2.280●□痫 15.80±1.643●□痫
Bax阳性细胞胞浆中有棕黄色颗粒表达,主要分布在缺血中心区,且各组大鼠脑组织Bax阳性细胞表达不同,假手术组表达不明显,缺血再灌注组表达较高,腺苷预处理组逐渐较少。同一时间点Bax阳性细胞细胞表达IR组和AP组与F组比较差异有统计学意义(P<0.05);AP组与IR组比较有显著差异(P<0.05);同一组内各时间点比较,F组各亚组之间差异无统计学意义(P>0.05),IR组和AP组组内两两比较差异均有统计学意义(P<0.05)。见图5。

图5 Bax蛋白的表达
3 讨论
缺血再灌注损伤是临床上常见的基本病理生理过程,人们对它进行了大量的相关研究[2-4]。脑缺血可诱导腺苷释放,与A 1受体结合导致K-ATP通道开放可能参与脑缺血预处理(cerebral ischemic preconditioning,CIP)的形成[5]。腺苷能抑制兴奋性氨基酸的释放,降低细胞膜对钙离子的通透性,扩张脑血管,抑制炎性细胞黏附和浸润,抑制血小板聚集,减轻炎性细胞、自由基介导的血管内皮损伤,其作用是受特异性腺苷受体调节,腺苷受体分为 A1、A2、A 3三种。在全脑-全脑模式中预处理时药物阻断A1受体或K-ATP通道能阻断IP的诱导。CIP对大鼠海马神经元的缺血再灌注保护作用接近100%,而应用腺苷A1受体拮抗剂可以完全阻断CIP的保护作用,因此推测CIP通过腺苷A 1受体介导。
腺苷或谷胱甘肽预先注入大鼠静脉可明显增加大鼠心脏、肝脏ATP含量,减少自由基生成,提高动物存活率[6]。心脏和脑缺血预处理的保护作用具有相似性,均为促进内源性腺苷释放诱导CIP样保护作用。本实验光镜观察到预处理组脑部损伤轻,证实局灶性脑缺血再灌注时应用腺苷可明显减轻脑组织的不可逆损害,再次表明腺苷具有确切的脑保护作用。
最新研究表明脑缺血再灌注损伤与细胞凋亡及其调控基因密切相关。在神经系统,现已知与凋亡相关的基因基本上分为两大类[7]:一类是促进细胞凋亡的基因,如 Bax、BalxS、cFos等;另一类是抑制凋亡的基因,如 Bcl-2和 BclxL等。Bcl-2家族中的成员共同调节细胞凋亡[8]。其中两种主要的调节基因即Bcl-2基因和Bax基因表达的变化被众多学者认为是脑缺血后细胞凋亡的主要分子机制[9]。Bcl-2是重要的抗凋亡基因,Bax则是与之拮抗的促凋亡基因,实验发现这两种基因的相应蛋白质产物即Bcl-2蛋白和Bax蛋白表达的变化对凋亡的进程有着直接影响。
Bax是一种由192个氨基酸残基组成的,相对分子质量为21000的蛋白质,与Bcl-2的同源性为21%,但Bax与Bcl-2的作用完全相反,Bax的表达并不立即导致细胞凋亡,而是仅在细胞接受死亡信号之后Bax才开始发挥作用,通过抑制Bcl-2的作用而导致细胞凋亡。Bcl-2属于拮抗细胞凋亡的基因,它既能阻抑坏死又能阻抑凋亡[10-11],而这两种死亡又是脑缺血损伤的主要形式。在本实验研究中,大鼠局灶性脑缺血及再灌注2 h促凋亡基因蛋白Bax开始表达,再灌注6 h明显增高,至24 h达到高峰,几乎在相同的时间和相同的脑区,Bax阳性神经元变性程度重,形态变化大,提示Bax参与了缺血后神经元凋亡的过程。同时我们还可以发现用腺苷预处理后大鼠脑组织促凋亡蛋白Bax明显减少;与假手术组和缺血再灌注组相比,腺苷预处理组各时间点Bax蛋白表达减少显著(P<0.05)。结果表明应用腺苷进行预处理可以明显降低促凋亡基因Bax蛋白的表达,从而发挥脑保护作用,提示腺苷用于脑缺血治疗具有广泛前景。
[1]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):89-91.
[2]Bengisum J,Koksoy C,Bengisum JS,et al.Ischemia and reperfusion injury prevention of pulmonary hy peretnsion and leukosequestration following lower limb ischemia[J].Prostag Land Ins Leukot Essent Fatty Acids,1997,56(2):116-120.
[3]王红梅,张剑龙,腾清蕾,等.大鼠肝缺血再灌注损伤诱导性一氧化氮和酶表达与肝细胞凋亡的关系[J].新乡医学院学报,2006,23(1):42-44.
[4]焦勇钢,孙银平.参麦注射液对家兔缺血再灌注损伤肠微循环的保护作用[J].新乡医学院学报,2005,22(5):213-215.
[5]Heurteaux C,Lauritzen I,Widmann C,et al.Essential role of adenosine,adenosine A1 receptors and ATP-sensitive K+channels in cerebral ischemic precondition[J].Proc Natl Acad Sci USA,1995,92(10):4 666-4 670.
[6]邱氟,吕新生.肝脏缺血预处理研究中的哲学思考[J].医学与哲学,2002,23(254):34-36.
[7]Zhang Z,Sobel RA,Cheng D,et al.Mild hypothermia increases Bcl-2 protein exp ression following global cerebral ischemia[J].Brain Res Mol Brain Res,2001,95(1/2):75-85.
[8]Liu S,Pereira NA,Teo JJ,et al.Mitochondrially targeted Bcl-2 and Bcl-X(L)chimeras elicit different apoptotic resp onses[J].M ol Cells,2007,24(3):378-387.
[9]潘树义,王苏平,钟世镇.神经细胞损害机制和保护治疗的若干进展[J].国外医学◦脑血管疾病分册,2001,9(1):24-26.
[10]Wei MC,Zong WX,Cheng EH,et al.Proapop totic BAX and BAK:a requisite gateway to mitochondrial dy sfunction and death[J].Science,2001,292(5517):727-730.
[11]Zhang YB,Lu GW,Yang MF.Changes in Bcl-2 and Caspase-3 expressions in cortex of hypoxic preconditioning mice[J].Sheng Li Xue Bao,2008,60(2):249-253.

