中脑源性神经干细胞培养过程中pitx3以及凋亡基因的表达
徐 海 陈 斌 金华岭 徐 刚 张新江
江苏扬州市第一人民医院神经内科 扬州 225000
NSCs是指存在于神经系统中特定的前体细胞,其基本的生物学特征为多向分化和自我更新,独特的生物学特性使其较其他细胞更容易在新的环境中生存,发挥生物学作用。神经干细胞一直被认为是细胞替代治疗帕金森病的理想载体,但是神经干细胞如何分化为具有功能的多巴胺能神经元一直是个难题。Pitx3[1-2]称为垂体同源盒家族因子3,是决定中脑黑质多巴胺(dopamine,DA)能神经元表型、终末分化和生存维持的关键性特异性转录因子,TH是DA合成限速酶通常作为DA能神经元的特异性标志,表达情况是神经干细胞能否转化为多巴胺能神经元的关键。因此,本文探讨胚胎大鼠腹侧中脑区域NSCs的培养过程中pitx3,TH以及凋亡基因的表达情况。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:E14.5 d的胚胎大鼠由东南大学实验动物中心提供。
1.1.2 实验试剂:DMEM/F12(1∶1)(Dulbecco's Modified Eagle Medium,F12 Nutrient Mixture,Gibco公司),N2,无血清培养液添加剂B27(B27 Supplement,Gibco公司)。表皮生长因子EGF(epidiermal growth factor,EGF,Gibco公司),碱性成纤维细胞生长因子(fibroblast growth factor-Basic,bFGF,Gibco公司).胎牛血清(fetal bovine serum,gibco)小牛血清白蛋白(bovine serum albumin,BSA,Cat.No.A3156),RNA提取试剂盒(QENGEN),逆转录试剂盒(Product No.205213,Qiagen,Germany),Lightcycler system(Roche Diagnostics,Switzerland)。
1.1.3 实验设备:CO2培养箱(日本三洋)、医用超净工作台(吴江市净化设备总产,净化等级100级)、体视显微镜(OLYMPUS-CK2)等。
1.2 实验方法
1.2.1 原代克隆的培养:取E14.5 d妊娠SD大鼠,严格消毒大鼠的腹部皮肤,在剑突下剪开皮肤至下腹部,取出胚胎,将其放入无菌冰冻D-Hank's液中,小心分离脑组织,在解剖镜下剔除脑膜和血管,钝性分离中脑组织。将分离出来的中脑组织充分剪碎,置于细孔尼龙网中,用玻璃试管底轻轻碾磨,再通过70μm孔径的尼龙网过滤,并用吸管轻轻吹打成细胞悬液。室温1000 r/min离心5 min。弃上清,加入增殖培养基中,按细胞浓度1×105接种于25 cm2的培养瓶内,置于37℃、5%CO2温箱中培养。增殖培养基的基本成分为DMEM/F12(1∶1)1%N2,1%B27,EGF 20 ng/mL,bFGF 20 ng/mL,培养 4~5 d后加入1 mL新鲜培养液,8~9 d后观察生长的悬浮神经细胞球的大小和数目。
1.2.2 细胞克隆实验:将传至第二代的细胞球悬液用毛细吸管从培养瓶中吸出,转入10 mL离心管中,将离心管静置10 min,待细胞球沉入管底后吸去上清液。将细胞球吸出,用吸管吹打成单细胞悬液,用台盼蓝法鉴定细胞活性,用无血清培养液将单细胞悬液的细胞浓度稀释成40个细胞/μL,将上述稀释好的单细胞悬液加入96孔培养板中,每孔50 μL,另加完全培养液100μL,置于37℃、5%CO2温箱中培养,2 h后在倒置显微镜下观察。选取仅有1个细胞的培养孔作标记,每天在倒置显微镜下动态观察所标记的孔中细胞的分裂及克隆形成情况。
1.2.3 细胞RNA的提取并逆转录成cDNA:取传代前的细胞克隆作为对照组。在单细胞克隆形成的7、14、21 d分别收集悬浮细胞,RNA试剂盒按说明步骤提取细胞总RNA。用紫外分光光度计测量RNA在260 nm和280 nm两个波长的吸光度,并根据OD值定量。各个样本分别取10μL RNA,以Oligo(d T)作为引物,按照逆转录试剂盒的标准步骤加入相应底物和酶,将RNA逆转录为cDNA。
1.2.4 Real-time PCR反应:本试验所用为Real-time PCR系统为 Lightcycler系统,β2-Microglobulin为内参。见表 1。Real-time PCR反应所用试剂见表2。

表1 所用的相关引物
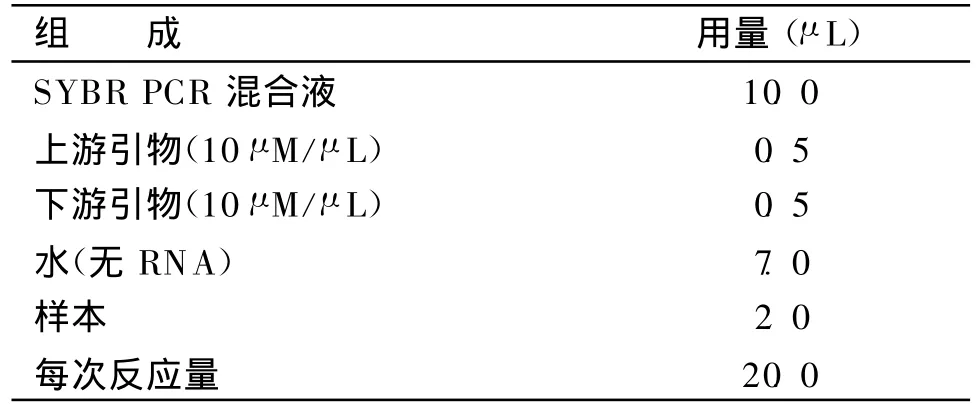
表2 Real-time PCR反应所用试剂及用量
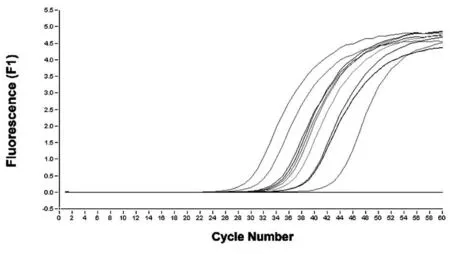
图1 pitx3 Reaal-time PCR结果
1.2.5 数据分析处理:所有实验重复3次以保证结果的可靠性。每个时间点选取3组细胞克隆,Real-time PCR结果取平均值。每个时间点的结果与对照组做比较(以百分数表示),对照组的结果设为1。最后的结果取 3次实验结果的平均数。
2 结果
2.1 单细胞克隆 见图1。原代培养的NSCs在培养最初的3~4 d,可见培养瓶底有许多小圆形死亡细胞及其碎片,大部分存活细胞在培养液中悬浮,10 d左右形成含有上百个细胞的细胞球。体外培养8~9 d后将神经细胞球机械吹散成单细胞悬液,置于同样条件下培养。可观察到悬浮的单个细胞分裂增殖并形成细胞小球。细胞球可以进一步增长,形成近百个无突起、形态和大小基本相似的细胞组成的神经球。
2.2 Real-time PCR反应结果 见图2。

图2 pitx3、Bax和Bcl-2基因表达
3 讨论
目前,在成年哺乳动物中,先后在SVZ区、纹状体、海马齿状回和脊髓中分离得到NSCs。但人们研究发现,不同部位分离得到的NSCs其生长速度、分化方向、迁移特性等生物学特征有很大的不同[3]。关于mNSCs的研究多集中在DA能神经元表型的诱导上,在过去数年的研究中表明它们在分化诱导的遗传学和分子调控及DA能神经元表型成熟等许多方面都具有自己的特征性[4]。研究发现转录因子pitx3和TH在多巴胺能神经元发育过程中发挥着重要作用[5]。因此本文选取胚胎大鼠腹侧中脑区域进行NSCs的培养,观察pitx3、TH以及凋亡的相关基因进行研究,为细胞移植治疗PD的应用研究打下基础。
研究表明,干细胞在脑中所处的部位已经预定其发育特征因而表现出不同的生长和分化特性。例如室管膜周围的NSCs,很早即被决定了特定的发育方向,这也是为何最先发育成型的是脊髓,随后是延髓、脑桥、中脑、间脑、再次是端脑,最后是小脑。由于DA能神经元主要存在于腹侧中脑,因此人们推测在此区域的NSCs更容易分化为DA能神经元,以前的实验结果也证实了这一点。近年来,人们发现和DA能神经元发育密切相关的基因(内源性信号),如Enl、Otx2、pitx3、Nurrl、Lmx1b、Shh、FGF8 等,在大鼠胚胎 E14.5 d时,已经表达在腹侧中脑的NSCs上[5],也就是说,这些NSCs已经含有中脑源性的转录因子和相关的发育信号,能迅速对相关区域性的分子信号作出反应从而分化为DA能神经元。
在本实验中我们选择的培养体系中NSCs生长迅速,状态良好,细胞数量得以大量扩增。实验的结果表明,在培养过程中,pitx3基因的表达从7~21 d呈现逐渐增加的趋势,并且促进凋亡的基因Bax也表现出相同的趋势,并伴随着抑制凋亡的基因Bcl-2表达的下调。结果说明,胚胎大鼠腹侧中脑源性神经干细胞具有分化为中脑多巴胺能神经的潜能,但同时随着培养时间的延长,调亡的细胞也在不断增加[6]。有文献报道在此种培养条件下细胞随着传代次数的增加,细胞的活力逐渐减弱,凋亡的细胞大量增加。因此,在选择培养的NSCs进行移植时,不仅要考虑到细胞高表达pitx3和TH基因,同时也要尽量减少细胞的凋亡以保证移植效果[7]。
[1]Smidt MP,van Schaick HS,Lanctot C,et al.A homeodomain gene Pitx3 has highly restricted brain ex pression in mesencephalic dopaminergic neurons[J].Proc Natl Acad Sci,1997,94(24):13 305-13 310.
[2]van Den Munckhof P,Luk KC,Ste Marie L,et al.Pitx3 is required for motor activity and for survival of a subset of midbrain dopaminergic neurons[J].Development,2003,130(11):2 535-2 542.
[3]须汉鹏,杨浩,王春婷,等.中枢神经系统不同部位来源的神经干细胞在体外生长特性的比较[J].解剖学报,2004,35:358-362
[4]Smidt MP,Smits SM,Peter JH,et al.Molecular mechanisms underlying midbrain dopamine neuron development and function[J].Eur J Pharmacol,2003,480(1/3):75-88.
[5]Peng C,Fan S,Li X,et al.Overexpression of pitx3 upregulates exp ression of BDNF and GDNFin SH-SY5Y cells and p rimary ventral mesencephalic cultures[J].FEBS Lett,2007,581(7):1 357-1 361.
[6]Jovorina M,Alexander S,Johannes S,et al.Spontaneous apoptosis in murinefree-floating neurosp heres[J].Exp Cell Res,2004,294:9-17.
[7]凌松.神经干细胞及帕金森病的细胞治疗[J].北京大学学报(医学版),2002,34:378-381.

