原花青素对大鼠脑缺血再灌注损伤代谢障碍的影响
陈香红 张 艳
1)郑州市第一人民医院 郑州 450004 2)郑州大学基础医学院药理学教研室 郑州 450052
在脑缺血再灌注损伤过程中,脑组织常常伴有代谢障碍,如乳酸含量的增加,能量代谢酶活性的降低,脑细胞水肿等的发生。以上改变最终会导致神经功能障碍、神经元损伤及坏死。原花青素(PC)是一种来源于植物的天然多酚类化合物,具有广泛的药理活性,近年研究表明,它可通过抗凋亡、抗氧化、清除自由基在局灶性脑缺血损伤中发挥脑保护作用[1-4],本文主要探讨原花青素对大鼠局灶性脑缺血再灌注代谢障碍的影响,从而进一步研究其脑保护作用及机制。
1 材料与方法
1.1 药品及试剂 原花青素(安阳晶森天然产物有限公司,批号:07031802);乳酸检测试剂盒和ATP酶检测试剂盒(南京建成生物工程研究所,批号:20070925)
1.2 主要仪器 722紫外分光光度计,电动玻璃匀浆机,手术器械等。
1.3 实验动物及分组 实验采用健康成年雄性SD大鼠,体质量250~280 g,购自河南省实验动物中心。实验前室温下(20~25℃)保持明/暗交替各12 h,环境适应性喂养1周,给予普通饲料和自由饮水。将80只SD大鼠随机分为5组,每组16只,即假手术组、模型组及 3个 PC剂量(50、100、200 mg/kg)组,模型组和各药物组分别在大鼠脑缺血2 h后进行神经功能学评分,再灌注24 h后处死大鼠。
1.4 给药方式 采用腹腔给药的方式,各剂量药物组分别于术前0.5 h注射不同浓度的原花青素溶液,脑缺血后2 h重复给药1次。假手术组和模型组分别给予等量的生理盐水。
1.5 模型制备 将市售尼龙鱼线剪成约50 cm长的线段,用蚊香将线段一端头部烫成光滑圆球(直径约为5 mm),在距头端 20 mm处用红色记号笔作标记,然后将线段置于75%酒精中备用;用10%水合氯醛(0.35 mL/100 g)经腹腔注射麻醉大鼠,仰卧位固定,作颈部正中切口,分离右侧颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA)和翼腭动脉(PPA);结扎ECA主干和PPA,在CCA上近CCA和ICA的分叉处用眼科剪剪一小口,由此切口插入备用线段,经CCA进入ICA,继续缓慢将鱼线向ICA入颅方向推进,微遇阻力时停止进线,表明鱼线头端已经到达大脑中动脉(M CA)起始处,插入深度自颈总动脉分叉处至MCA起始处为17~19 mm,即完成了右侧MCA的阻塞。缺血2 h后提拉线段,实现MCA的再灌注[5-7]。
1.6 神经功能评分 采用Longa[8]评分法对缺血2 h后清醒动物进行神经功能行为学评分。评分标准:0分:无明显神经病学症状;1分:不能完全伸展左侧前爪;2分:向左侧旋转;3分:行走时向左侧倾倒;4分:不能自动行走,意识水平下降。对于评分≥2分且再灌注24 h后仍存活的大鼠筛选入组进行后续的实验。
1.7 脑水肿的测定 在脑缺血再灌注后处死大鼠,取出右侧大脑组织,用滤纸吸干表面水分,立即于电子天平称重(湿质量),120℃恒温烘烤24 h至恒重后再次称重(干质量),采用干湿质量法测定脑组织含水量,按Ellis公式[9]计算脑组织含水量:脑含水量=(湿质量-干质量)/湿质量×100%。
1.8 脑组织匀浆的制备 将大鼠按时断头,取右侧脑组织,称取脑组织块约0.5 g,用预冷的生理盐水冲洗组织表面的血液,滤纸吸干,再次称重放于电动玻璃匀浆器中,按0.1 g∶0.9 mL加入预冷的生理盐水制成脑组织匀浆,再以3 000~4 000 rpm的速度低温离心10 min,取上清液,即为10%的脑组织匀浆,分装,放-20℃冰箱保存备用。
1.9 乳酸含量及能量代谢酶活性的测定 取上述脑组织匀浆,应用722紫外分光光度计,按测试剂盒说明书测定乳酸含量、Na+-K+-ATP酶活性、Ca2+-ATP酶活性。考马斯亮蓝法测定蛋白的含量。
1.10 统计学处理 采用SPSS 11.0统计软件分析处理数据。所得结果以均数±标准差(±s)表示。多组间计量资料比较采用单因素方差分析检验,2组间比较采用LSD检验,检验水准α=0.05。
2 结果
2.1 神经功能行为学评分 与假手术组相比,模型组神经功能行为学评分升高(P<0.05);与模型组相比,PC中、高剂量组神经功能行为学评分降低(P<0.05),而低PC剂量组神经功能行为学评分无显著变化(P>0.05);PC中、高剂量组神经功能行为学评分差异无统计学意义(P>0.05)。见表1。
2.2 脑组织含水量 与假手术组相比,模型组脑组织含水量升高(P<0.05);与模型组相比,PC高、中剂量组脑组织含水量有所降低(P<0.05),而低PC剂量组脑组织含水量无显著变化(P>0.05);PC中、高剂量组脑组织含水量差异无统计学意义(P>0.05)。见表1。
表1 PC对大鼠脑缺血再灌注损伤神经功能评分及脑组织含水量的影响 (±s,n=8)

表1 PC对大鼠脑缺血再灌注损伤神经功能评分及脑组织含水量的影响 (±s,n=8)
注:与假手术组比较,*P<0.05;与模型组比较,▲P<0.05
组别 PC剂量(mg/kg) 神经功能评分 脑组织含水量(%)假手术组 0 0.80±0.34 76.30±0.21模型组 0 3.00±0.31* 80.65±0.19*PC低剂量组 50 2.80±0.33 80.37±0.34 PC中剂量组 100 2.00±0.30▲ 78.23±0.26▲PC高剂量组 200 1.80±0.29▲ 77.95±0.09▲
2.3 脑组织乳酸含量 模型组脑组织乳酸含量较假手术组升高(P<0.05);PC低、中、高剂量组脑组织乳酸含量均较模型组降低(P<0.05)。见表2。
2.4 能量代谢酶活性的改变 Na+-K+-ATPase活性:模型组Na+-K+-ATPase的活性较假手术组降低(P<0.05);PC中、高剂量组较模型组升高(P<0.05);PC中、高剂量组间无显著差异(P>0.05);PC低剂量组与模型组相比无显著差异(P>0.05)。Ca2+-ATPase活性:模型组 Ca2+-ATPase活性较假手术组降低(P<0.05);PC高剂量组Ca2+-ATPase活性较模型组有所增高(P<0.05)。见表2。
表2 PC对大鼠脑缺血再灌注时乳酸含量,Na+-K+-ATPase,Ca2+-ATPase活性的影响 (±s,n=8)
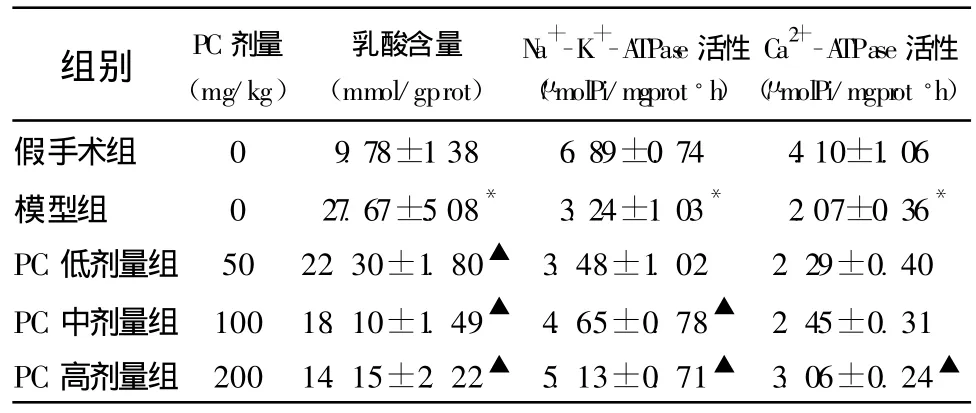
表2 PC对大鼠脑缺血再灌注时乳酸含量,Na+-K+-ATPase,Ca2+-ATPase活性的影响 (±s,n=8)
注:与假手术组比较,*P<0.05,与模型组比较,▲P<0.05
组别 PC剂量(mg/kg)乳酸含量(mmol/gprot)Na+-K+-ATPase活性(μmolPi/mgprot◦h)Ca2+-ATPase活性(μmolPi/mgprot◦h)假手术组 0 9.78±1.38 6.89±0.74 4.10±1.06模型组 0 27.67±5.08* 3.24±1.03* 2.07±0.36*PC低剂量组 50 22.30±1.80▲ 3.48±1.02 2.29±0.40 PC中剂量组 100 18.10±1.49▲ 4.65±0.78▲ 2.45±0.31 PC高剂量组 200 14.15±2.22▲ 5.13±0.71▲ 3.06±0.24▲
3 讨论
大鼠大脑中动脉的解剖分布及基底节的血液供应与人类相似,本实验中使用大鼠局灶性脑缺血模型模拟人类脑缺血时的血流再通情况,并对方法稍加改进,将栓线由颈外动脉插入改为由颈总动脉插入,并将栓线头部用蚊香烧成圆球状,以减少对血管内皮细胞和血管壁的损伤,操作方便,成本低廉,成功率高,更接近于人类局灶脑缺血后的病理状态。实验中对脑缺血大鼠进行神经行为学评分,可作为筛选模型制备的成功与否,又可反映脑缺血损伤的病理生理过程。
在脑组织缺血缺氧时,无氧糖酵解增强,生成大量的乳酸,使组织内的p H值降低或产生酸中毒,导致细胞周围H+增高,后者又可促发 Na+-H+交换,使更多的 Na+流入细胞内,加重细胞水肿。此外,认为高浓度H+可使蛋白质变性,并改变了那些p H依赖性酶的活性,抑制NADH的再氧化和神经递质的再摄取,促使自由基的形成。高浓度的H+还可使溶酶体通透性增加,甚至破裂引起了溶酶体中水解酶的释放,加重了神经元的损伤。有研究表明,脑缺血(再灌注)时组织中乳酸浓度的高低与脑组织损伤的程度呈正相关[10]。
脑的代谢完全依赖于血液中氧供及能量的及时恢复,大脑血流量的中断,能量贮存枯竭能够导致急性代谢紊乱。能量代谢的主要产物ATP的缺失是导致细胞死亡的关键因素。而ATP是维持Na+-K+-ATPase和Ca2+-ATPase离子泵的主要能源,在脑缺血再灌注损伤时,脑组织内ATP含量的不足,使 Na+-K+ATPase和 Ca2+ATPase活性受到严重抑制。现代研究表明,Na+-K+-ATPase对缺血再灌注损伤十分敏感,其损伤与再灌注期间的病理改变有密切的关系,Na+-K+-ATPase活性的降低可导致神经细胞内外Na+和K+梯度不能维持,引起细胞内 Na+增多,使细胞膜除极,从而引起钙内流及谷氨酸受体介导的一系列损伤机制的相继发生,也是再灌注早期脑水肿形成的原因之一;同时细胞外K+增多,可使细胞膜持续去极化而影响兴奋传导、递质释放等,并且与缺血期间所发生的细胞自杀现象相关,影响脑恢复的质量[11]。
Ca2+-A TPase主要调节细胞内外的钙离子平衡,当其活性降低时,细胞内的Ca2+增多,引起钙超载现象,导致神经损伤机制的发生。因此,保护再灌注期间Na+-K+-ATPase和Ca2+-ATPase活性对阻抑脑再灌注损伤的发生和发展有重要意义。
本研究中,在脑缺血期间,大鼠的神经行为学评分值升高,脑水肿加强,乳酸的含量增加,Na+-K+-ATPase和Ca2+-ATPase活性降低,而使用PC能够保护神经功能,降低脑水肿的发生,降低乳酸含量,增加Na+-K+-ATPase和Ca2+-ATPase活性,尤其是使用100、200 mg/kg PC剂量时效果较为显著。以上结果表明,PC可有效减轻大鼠脑缺血-再灌注的损伤,从而发挥神经保护作用,其机制可能与其减轻脑水肿、改善脑组织的代谢障碍有关。
[1]贾玉洁,闵连秋,季占胜,等.原花青素对脑缺血后抑凋亡基因蛋白Bcl-2表达和促凋亡基因蛋白 Bax的影响[J].中国临床康复,2006,10(23):65-72.
[2]A riga T.The antioxidative function,preventive action on disease and utilization of proanthocyanidins[J].Biofactors,2004,21(1/4):197-201.
[3]贾玉洁,闵连秋,季占胜,等.原花青素对大鼠局灶性脑缺血的保护作用[J].中国脑血管病杂志,2005,2(12):558-560.
[4]黄晓瑾,毛峻琴.原花青素抗大鼠脑缺血再灌注损伤的研究[J].中国药师,2005,8(7):541-542.
[5]刘运泉,戴颖.线栓法大鼠局灶性脑缺血模型的改进[J].中国临床解剖学杂志,2005,23(2):222-223.
[6]黄斌,王兴勇,匡凤梧,等.线栓法制备Wistar大鼠局灶性脑缺血模型的实验研究[J].现代医药卫生,2005,21(15):1 935-1 937.
[7]田士强,王任直,李桂林,等.大鼠局灶性脑缺血模型的改进[J].基础医学与临床,2004,24(4):499-451.
[8]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[9]Lo WD,Betz A L,Schielke GP,et al.Transport of sodium from blood to brain in ischemic brain edema[J].Stroke,1987,189(1):150-154.
[10]李强,陆兵勋.脑水肿的发病机制研究进展[J].中国实用神经疾病杂志,2006,9(2):97-98.
[11]M rsi-Pelci J,Zupan G,Maysinger D,et al.The influence of M K-801 on the hippocampal frees arachidonic acid level and Na+-K+-A TPase activity in global cerebral ischemia-exposed rats[J].Prog Neurop sychopharmacol Biol Psychiatry,2002,26(7/8):1 319-1 326.

