Chk1基因沉默增强姜黄素诱导肝癌细胞Huh7凋亡的敏感性
王伟章 金小宝 毛建文 郑敏
广东药学院基础学院生物教研室,*寄生虫学教研室,广东 广州510006
细胞周期检测点激酶1和2 (checkpoint kkii--nase,Chkl和Chk2),是细胞周期检测中最关键的效应蛋白激酶,在药物、电离辐射(IR)和紫外线(NV)等引起的S期和G2/M期检测点调节中发挥重要作用,有可能成为肿瘤放化疗增敏的新靶点[1]。姜黄素是从植物姜黄中提取出来的天然产物,细胞和动物模型实验结果显示姜黄素具有抗肿瘤及预防癌变的药理作用,有望成为新的抗肿瘤药物[2]。然而,以 Chk1/2作为姜黄素治疗肿瘤增敏靶点的研究却很少有报道。我们已报道姜黄素能诱导肝癌细胞Huh7发生凋亡[3],本研究通过检测Chkl/2 siRNA对姜黄素诱导的肝癌细胞Huh7凋亡影响,以探讨Chkl/2作为姜黄素治疗肝癌增敏靶点的有效性。
1 材料和方法
1.1 材料 姜黄素,碘化丙啶(pprroopp--idium iodide,PI)和4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)购自美国Sigma公司。RT-PCR试剂盒购自美国Promega公司。TRIzol和Oligofectamine试剂购自美国Invitrogen公司。Chk1、Chk2、p-Chk2(T68)、p-Chk1(S317)、p-Cdc25C(S216)和p-Cdk1(Y15)多克隆抗体购自美国Cell Signaling Technology公司。β-actin单克隆抗体购自美国Santa Cruz公司。辣根过氧化物酶标山羊抗兔和羊抗小鼠IgG均购自丹麦DAKO公司。ECL购自美国Pierce公司。BCA蛋白定量试剂盒购自申能博彩生物科技有限公司。
1.2 方法
1.2.1 细胞培养 Huh7细胞购自中国科学院上海分院细胞库。细胞培养在含10%胎牛血清(澳大利亚的PAA公司)的DMEM培养液(美国Gibco公司)中,置于CO2体积分数为5%的37 ℃培养箱。
1.2.2 Chk1/2 siRNA转染 Chk1/2及对照siRNA由广州锐博生物科技有限公司合成。Chk1序列:5’-AAGAAGCAGTCGCAGTTGGAAAA--GATTGTAG-3’;Chk2序列:5’-AAGAACCTGAGGACCAAGAACCTGAGG-3’;对照序列:5’-CGUACUGUCGACACUGAAACGGACA-3’。采用Invitrogen公司的转染试剂Oligofectamine进行转染,具体操作如下:转染前1天用胰蛋白酶消化细胞,1 000×g离心5 min后重悬于含有10%FBS的DMEM中,按3×104/孔的密度接种于24孔板,培养24 h后进行转染。转染前1 h将细胞的培养上清液换成200 μL opti-MEM。将0.625 μL siRNA(终浓度50 nmol/L)稀释于40 μL opti-MEM中,轻敲管壁混匀;另外,将1 μL 的Oligofectamine稀释于7.5 μL opti-MEM中,室温放置5 min;5 min后将两种稀释液混合,轻敲管壁混匀,室温放置15 min。15 min后将Oligofectamine/siRNA混合液加入培养孔中,混匀后培养箱中培养;3 h 后加入含有30%FBS的DMEM,使血清终浓度为10%,继续培养48 h。
1.2.3 RT-PCR检测 Chk1/2 siRNA按1.2.2方法转染后分别提取总RNA和总蛋白。总RNA以TRIzol试剂进行提取,经1%琼脂糖凝胶电泳后观察RNA完整性,紫外分光光度计测定RNA的含量。RT使用Promega公司的逆转录试剂盒,以逆转录合成的cDNA为模板,以特异引物进行PCR,检测目标基因mRNA表达水平。PCR反应条件为:94 ℃预变性5 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸45 s,28个循环后于72 ℃再延伸8 min。产物用1.5%琼脂糖凝胶电泳分离,凝胶成像系统分析成像,用Bankscan软件进行灰度分析,Chk1和Chk2基因的表达水平分别用hPBGD和β-actin为内源对照。所用引物序列应用Primer premier 5.0软件自行设计,由上海英骏公司合成。引物序列为:Chk1 F:5’-CCTTTGTGGAAGACTGGGACT-3’,R:5’-GAGGTTATCCCTTTCATCCAAC-3’,产物长度422 bp;Chk2 F:5’-TCGTGATGTCTCGGGAGTCG-3’,R:5’-GAGTTTGGCATCGTGCTGGT-3’,产物长度151 bp;hPBGD F:5’-TCTGGTAACGGCAATGCGG-3’,R:5’-GCAGATGGCTCCGATGGTG-3’,产物长度271 bp;β-actin F:5’-CGCGAGAAGATGACCCAGAT-3’,R:5’-CCTTAATGTCACGCACGATTTC-3’,产物长度295 bp。总蛋白按1.2.4方法进行检测。
1.2.4 Western blot检测 终浓度为25μmol/L的姜黄素处理Huh7细胞2、12、24、和36 h后,收集细胞并提取蛋白,通过BCA试剂盒测定各组的蛋白浓度。0.1%DMSO处理的样品作为溶剂对照组。样品经SDS-PAGE电泳分离,湿电转移至硝酸纤维素膜,膜在室温下用封闭液封闭2 h,加入1%BSA稀释的p-Chk2(T68)、p-Chk1(S317)、p-Cdc25C(S216)、p-Cdk1(Y15)和β-actin抗体(1∶1000),4 ℃过夜,洗膜后加入封闭液稀释的二抗稀释液(1∶5000),室温2 h。用ECL solution 显色,最后进行显影、定影。用Bankscan软件进行灰度分析,分析目标基因的表达水平时用β-actin为内源对照。
2 结 果
2.1 姜黄素对细胞周期检测点信号通路蛋白的影响 为了观察Chk1和Chk2在此过程中的作用,我们首先检测了姜黄素处理Huh7细胞后对Chk2(T68)、Chk1(S317)、Cdc25C(S216)和Cdk1(Y15)蛋白磷酸化的影响。Western blot结果显示(图1),与对照组相比,Chk1(S317)、Cdc25C(S216)和Cdk1(Y15)的磷酸化水平随着姜黄素处理时间的延长而逐渐明显减少(P<0.01),Chk2的磷酸化水平无明显变化。
2.2 Chk1/2 siRNA对Chk1/2表达的影响 为检测Chk1/2 siRNA是否可以有效降低Huh7细胞中Chk1/2的表达,我们对其mRNA转录水平和蛋白表达水平分别进行了分析。RT-PCR 和Western blot结果显示,针对Chk1/2的siRNA可以显著降低Huh7细胞中Chk1/2 mRNA的转录水平和蛋白表达水平(P<0.01,图2A和B)。结果表明,针对Chk1/2的siRNA可以有效沉默Huh7细胞中Chk1/2的转录和翻译。
2.3 Chk1/2 siRNA对姜黄素诱导Huh7细胞凋亡的影响 细胞凋亡检测结果显示,转染Chk1 siRNA 48 h后给予25 μmol/L姜黄素刺激24 h,Huh7细胞凋亡百分数明显高于转染NC siRNA组(P<0.05),表明抑制Chk1表达可显著增强姜黄素诱导Huh7细胞凋亡(图3)。而抑制Chk2后Huh7的细胞凋亡率并无明显变化,表明抑制Chk2表达并不能促进姜黄素诱导Huh7细胞凋亡。
2.4 Chk1/2 siRNA对姜黄素处理后Huh7细胞周期的影响 细胞周期检测结果显示,与转染NC siRNA相比,转染Chk1/2 siRNA 48 h后给予25 μmol/L姜黄素刺激24 h,Huh7细胞周期并无明显变化,表明抑制Chk1/2表达对姜黄素处理后Huh7细胞周期并无显著的影响(图4)。
3 讨 论
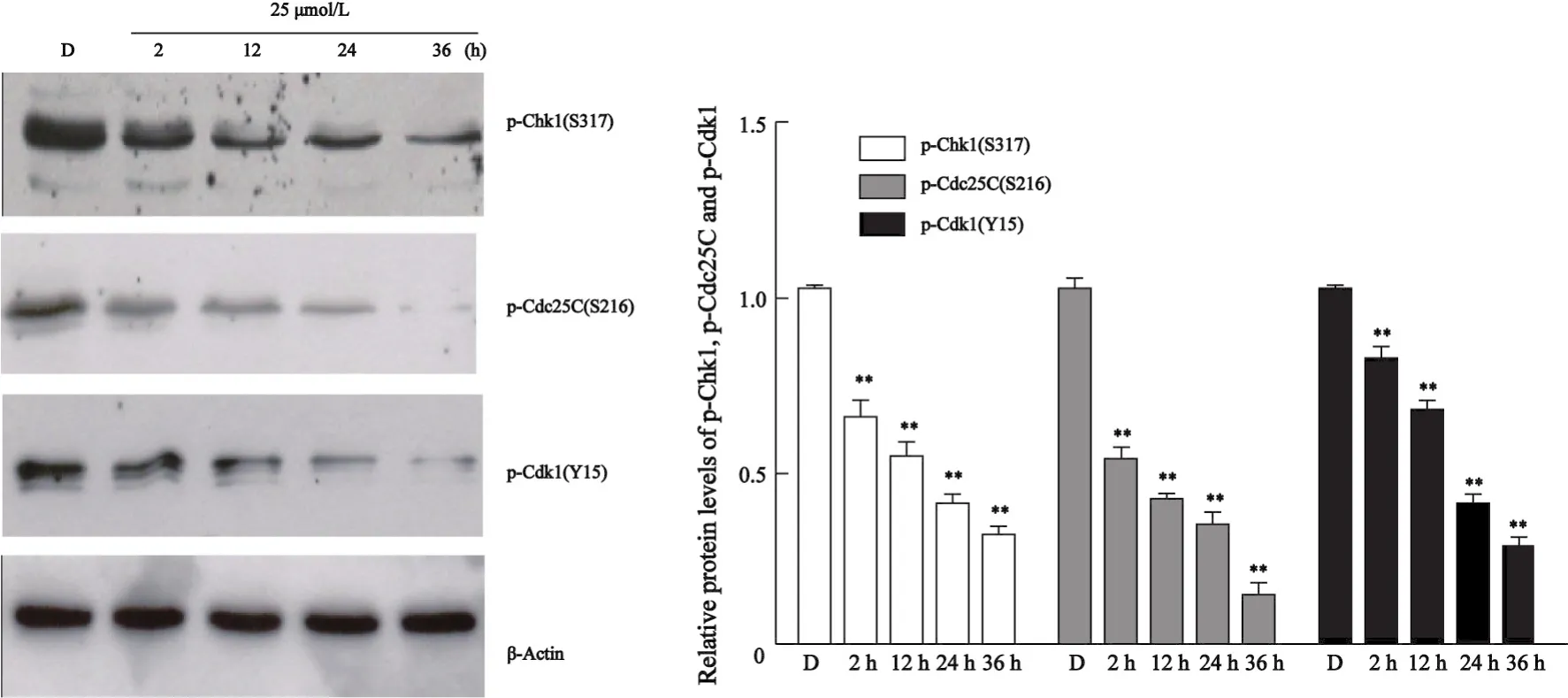
图1 姜黄素抑制Chk1(S317)、Cdc25C(S216)和Cdk1(Y15)蛋白的磷酸化Fig.1 Curcumin inhibited phorsphorylations of Chk1(S317), Cdc25C(S216) and Cdk1(Y15) proteins

图2 Chk1/2 siRNA对Chk1/2 mRNA和蛋白表达的影响Fig.2 Effects of Chk1 (A) and Chk2 (B) siRNA on the expressions of Chk1/2 in both mRNA and proteins
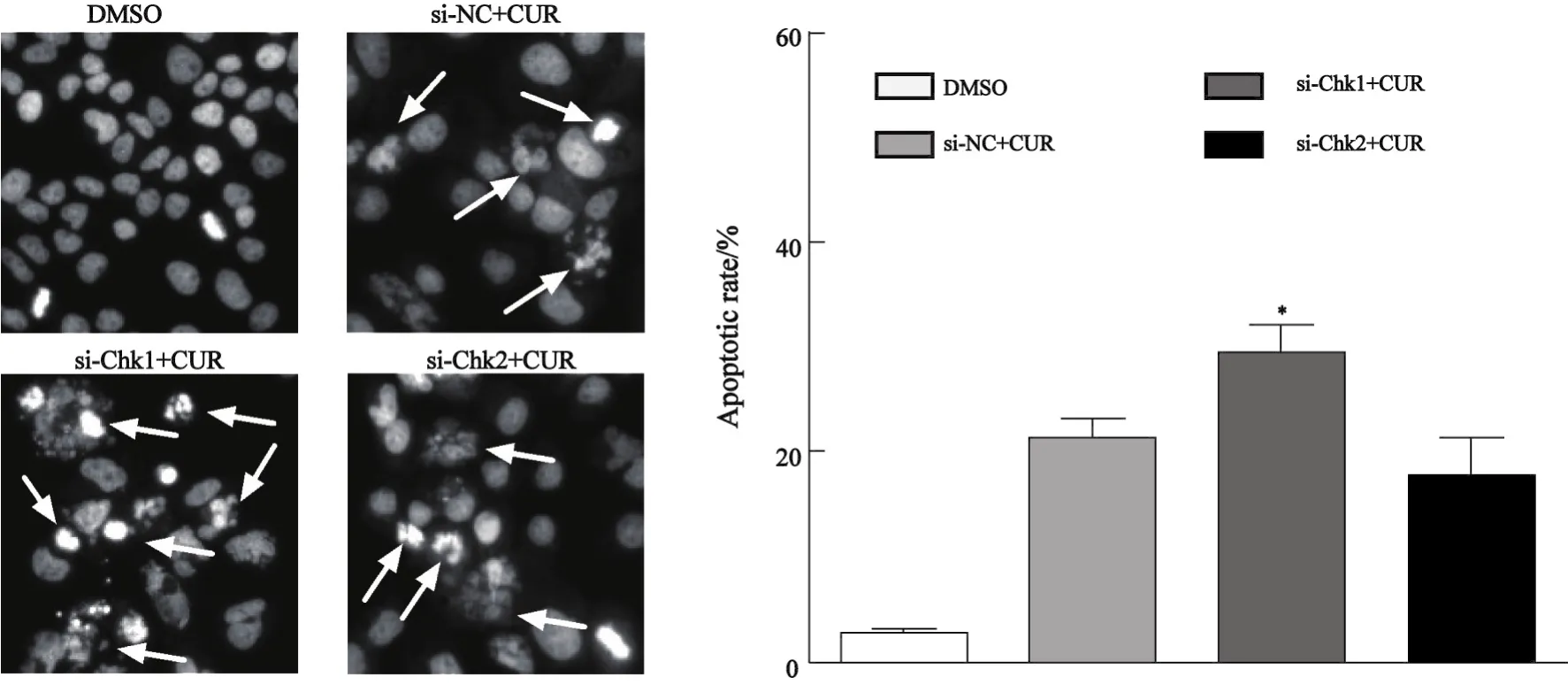
图3 Chk1/2 siRNA对姜黄素诱导Huh7细胞凋亡的影响Fig.3 Effect of Chk1/2 siRNA on curcumin-induced apoptosis in Huh7 cells (magnification, ×200)

图4 Chk1/2 siRNA对姜黄素处理后Huh7细胞周期的影响Fig.4 Effect of Chk1/2 siRNA on cell cycle distribution in curcumin-treated Huh7 cells
耐药性是严重影响抗肿瘤药物疗效和导致肿瘤治疗失败的主要原因之一。肿瘤耐药与肿瘤细胞逃避放化疗诱导的细胞凋亡密切相关,而肿瘤细胞逃避凋亡的机制与细胞周期检测点有关。细胞周期检测点在放化疗作用下被激活,导致细胞周期阻滞和细胞的损伤修复,从而使细胞避免凋亡。因此,灭活肿瘤细胞周期检测点,增强肿瘤治疗敏感性,已成为创新药物研究的热点之一。以往多数研究发现,通过不同方法抑制Chk1活性都是通过消除G2/M期阻滞来增强肿瘤细胞对放化疗的敏感性[4-6]。然而,有研究报道,Chk1的抑制剂可以通过不依赖于消除G2/M期阻滞的方式增强紫杉醇对肿瘤细胞的杀伤作用[7]。本研究也发现,尽管抑制Chk1后姜黄素对Huh7细胞的细胞周期并无明显影响,抑制Chk1同样能够增强姜黄素诱导肝癌细胞Huh7凋亡。由此可见,Chk1可以作为肿瘤放化疗增敏的有效靶点。
Chkl是一种进化上高度保守的丝氨酸/苏氨酸蛋白质激酶。当DNA损伤或复制阻滞后,通过ATR磷酸化Chk1第317位丝氨酸(S317)和第345位丝氨酸(S345)而使Chk1激活,活化的Chk1可磷酸化Cdc25C的Ser216位点,该位点的磷酸化导致14-3-3δ与Cdc25C发生抑制性结合和Cdc25C的核输出,这样Cdc25C就无法去磷酸化Cdk1的Tyr15位点,从而不能活化cyclinB/Cdk1复合物,引起G2/M期周期阻滞[8-10]。本研究结果发现,姜黄素能够明显抑制Chk1(S317),Cdc25C(S216)和Cdk1(Y15)蛋白的磷酸化水平,提示姜黄素可能通过抑制Chk1介导的G2/M期检测点的激活来诱导Huh7细胞凋亡。因此,我们设想通过RNAi技术沉默Chk1蛋白的表达可能进一步促进姜黄素诱导Huh7细胞凋亡。与我们设想一致的是,抑制Chk1的确能够显著增加姜黄素诱导Huh7细胞的凋亡率。但是沉默Chk2并无此作用,这可能与姜黄素处理Huh7细胞后并不影响Chk2的磷酸化水平相关。然而,最近的研究[11]发现姜黄素诱导前列腺癌BxPC-3细胞发生G2/M期阻滞和细胞凋亡,通过RNAi(RNA干扰)的方法抑制Chk1表达能够明显抑制姜黄素诱导的细胞凋亡,表明Chk1是姜黄素诱导BxPC-3细胞凋亡的关键蛋白。这些相反的研究结果可能与Chk1在不同组织中发挥的作用不同所致,有待进一步的研究。
我们以往的研究已经发现,抑制Chk1介导的G2/M期阻滞可以增强姜黄素诱导肝癌细胞Hep3B凋亡[3]。本研究发现,抑制Chk1也可以通过非细胞周期阻滞消除的方式提高姜黄素对肝癌细胞Huh7的作用效果。因此,Chk1可以作为肝癌治疗增敏的有效靶点,Chk1 siRNA与姜黄素联合治疗有望成为治疗肝癌的新途径。
[1] Bartek J, Lukas J. Chk1 and Chk2 kinases in checkpoint control and cancer[J]. Cancer Cell, 2003, 3(5): 421-429.
[2] Hatcher H, Planalp R, Cho J, et al. Curcumin: from ancient medicine to current clinical trials[J]. Cell Mol Life Sci,2008, 65(11): 1631-1652.
[3] Wang WZ, Cheng J, Luo J, et al. Abrogation of G2/M arrest sensitizes curcumin-resistant hepatoma cells to apoptosis[J]. FEBS Lett, 2008, 582(18): 2689-2695.
[4] Hirose Y, Berger MS, Pieper RO. Abrogation of the Chk1-mediated G(2) checkpoint pathway potentiates temozolomideinduced toxicity in a p53-independent manner in human glioblastoma cells[J]. Cancer Res, 2001, 61(15): 5843-5849.
[5] Huang M, Miao ZH, Zhu H, et al. Chk1 and Chk2 are differentially involved in homologous recombination repair and cell cycle arrest in response to DNA double-strand breaks induced by camptothecins[J]. Mol Cancer Ther, 2008, 7(6):1440-1449.
[6] Syljuasen RG, Sorensen CS, Nylandsted J, et al. Inhibition of Chk1 by CEP-3891 accelerates mitotic nuclear fragmentation in response to ionizing radiation[J]. Cancer Res, 2004,64(24): 9035-9040.
[7] Xiao Z, Xue J, Semizarov D, et al. Novel indication for cancer therapy: Chk1 inhibition sensitizes tumor cells to antimitotics[J]. Int J Cancer, 2005, 115(4): 528-538.
[8] Furnari B, Rhind N, Russell P. Cdc25 mitotic inducer targeted by chk1 DNA damage checkpoint kinase[J]. Science, 1997,277(5331): 1495-1497.
[9] Peng CY, Graves PR, Thoma RS, et al. Mitotic and G2checkpoint control: regulation of 14-3-3 protein binding by phosphorylation of Cdc25C on serine-216[J]. Science,1997, 277(5331): 1501-1505.
[10] Sanchez Y, Wong C, Thoma RS, et al. Conservation of the Chk1 checkpoint pathway in mammals: linkage of DNA damage to Cdk regulation through Cdc25[J]. Science,1997, 277(5331): 1497-1501.
[11] Sahu RP, Batra S, Srivastava SK. Activation of ATM/Chk1 by curcumin causes cell cycle arrest and apoptosis in human pancreatic cancer cells[J]. Br J Cancer, 2009, 100(9):1425-1433.

