烟曲霉素抑制小鼠结直肠癌生长及转移的体内外研究
崔晓楠 梁鑫淼 侯力
1.大连医科大学第一附属医院肿瘤科,辽宁 大连 116011;2.中国科学院大连化学物理研究所,辽宁 大连 116023;3.大连医科大学基础医学院病理学教研室,辽宁 大连 116023
结直肠癌是最常见的恶性肿瘤之一[1],虽然其诊断和治疗近年得到很大的发展,但社会依然期待着更加安全有效的治疗药物的不断开发[2]。血管新生与肿瘤的生长和转移密切相关[3],抑制新生血管的形成已经成为肿瘤治疗的重要战略[4]。血管新生是一个多步骤的过程,其完成依赖于内皮细胞的生长及其与周围基质的相互作用。烟曲霉素(Fumagillin)是一种从真菌中提取的药物,它能特异性地抑制血管内皮细胞的增殖[5]。现在已经发现FFuu--magillin的作用靶标为甲硫氨酸氨基肽酶2(type 2 methionine aminopeptidase,MetAP2)[6],但其抑制内皮细胞增殖的机制尚未阐明。Cyclo(Arg-Gly-Asp-D-Phe-Val)是含 Arg-Gly-Asp(RGD)序列的寡肽[7],可通过与整合素结合抑制细胞与细胞外基质的黏附,但两者对结直肠癌生长的影响尚不十分清楚。本研究观察了Fumagillin和Cyclo对小鼠结直肠癌生长及血管新生的影响,以阐明Fumagillin抑制血管新生的分子机制,对Fumagillin处理后脐带静脉内皮细胞(HUVECs)基因表达的变化用基因芯片的方法做了检测。
1 材料和方法
1.1 细胞系及动物 中分化大肠腺癌细胞系WiDr和高分化大肠腺癌细胞系HT-29均得自ATCC(Rockville,MD,USA)。Fumagillin和Cyclo购自Sigma公司。20只SCID小鼠被分为4组,分别为Fumagillin处理组、Cyclo处理组、联合处理组及对照组,每组5只。WiDr或HT-29细胞以5×105/L共计200μL的量接种于小鼠背部皮下,放置4周后,分别从隔日腹腔内注射Fumagillin(0.1 mg/kg)和(或)Cyclo(1 mg/kg),注射持续4周,对照组注射同等体积的二甲基亚砜(DMSO)。药物注射结束后处死动物,测量原发瘤质量。原发瘤制成冰冻切片,并行CD105免疫组织化学染色,计数CD105阳性的微血管数量。CD105多表达于活化的内皮细胞上,更能准确反映新生血管的数量[8]。同时在体外培养WiDr和HT-29细胞,向培养基内加入Fumagillin(0.01 mg/L)和(或)Cyclo(0.1 mg/L),用DNA合成检测试剂盒(Roche Diagnostics,Penzberg,Germany)检测此两种药物对肿瘤细胞增殖的直接影响。
1.2 HUVECs的培养及增殖检测 按照Piao等[9]的方法从脐带静脉分离培养内皮细胞,向培养基内加入Fumagillin(0.01 μg/mL)和(或)Cyclo(0.1 μg/mL),药物作用24 h后用加入5-Bromo-2-deoxy-uridine(BrdU,10 μmol/L)再培养1 h,然后按照DNA合成检测试剂盒(Roche diagnostics)说明书上记载的方法检测HUVECs的增殖情况。RGE肽是与Cyclo序列近似而不具有Cyclo生物学功能的寡肽,在本实验中被用作Cyclo的阴性对照。
1.3 HUVECs的体外微管形成检测 用底面铺了50 μm Matrigel(BD Bioscience,Bedford,MA,USA)的24孔板检测HUVECs形成微管的情况。HUVECs被以104个细胞/cm2的量加入24孔板的孔中,在含体积分数为5%的CO2的培养箱中培养8 h后在光镜下观察微管形成的变化,微管的长度用NIH Image program(HYPERLINK; http://rsb.info.nih.gov/nihimage)测量。
1.4 Human 13K cDNA芯片检测 HUVECs被暴露于Fumagillin(0.01 μg/mL)24 h后,提取Fumagillin处理后和未处理细胞的总RNA,再从RNA中用mRNA纯化试剂盒(Amersham Biosciences, Buckinghamshire,UK)分离mRNA。用CyScribe First-strand cDNA labeling kit(Amersham Biosciences,San Francisco,CA,USA) 逆转录合成荧光标记探针,与Human 13K cDNA芯片竞争杂交。杂交后芯片在ScanArray 4000 laser scanner system(Packard Biochip Tech,Billerica,MA,USA)上扫描定量化。Fumagillin处理后表达上调一倍或下调一半以上的基因被认为基因表达是被改变的。
1.5 定量PCR检测 为验证基因芯片的结果,用实时定量PCR(LightCycler Real-time PCR detection System,Roche Diagnostics,Mannheim,Germany)的方法检测HUVECs的cyclin E2, 白细胞活化黏附因子(activated leukocyte cell adhesion molecule,ALCAM)和 细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1,CD54)3个基因在Fumagillin处理前后的表达变化。PCR引物序列如下:Cyclin E2: forward 5’-CCTGATTTAAGCTGGGGATG-3’; reverse 5’-TGCAAGCACCATCAGTGAC-3’。BC020729.1(358~377 bp,706~688 bp,PCR产物 348 bp)。 ALCAM: forward 5’-GCTAGTAACTGAGGACAACGTG-3’;reverse 5’-GAGCTTCTTATTCCTTCGGGCTG-3’。 NM001627.2(882~903 bp,1424~1402 bp,PCR产物 542 bp)。 ICAM-1:forward 5’-CGACTGGACGAGAGGGATTG-3’;reverse 5’-TTATGACTGCGGCTGCTACC-3’。BT006854.1(1189~1208 bp,1477~1458 bp PCR产物 288 bp)。
以Glyceraldehyde-3-phosphate dehydrogenase(G3PDH)基因作为内参照。
1.5 免疫印迹检测 用免疫印迹法检测ICAM-1和CyclinE2的蛋白表达水平。常规电泳分离蛋白之后,将蛋白质转移至硝酸纤维素膜上,然后分别与Cyclin E2(A-9)和ICAM-1(G-5)特异性抗体4℃过夜反应后(均为鼠抗人的单克隆抗体,Santa Cruz Biotechnology),再与结合了过氧化物酶的(peroxidaseconjugated) 二抗 (兔抗鼠 IgG, Doko cytomation)反应。最后用ECL-增强化学发光试剂盒(ECL-enhanced chemiluminescence kit,Amersham Biosceiences)显色,显色后的硝酸纤维素膜在化学发光检出器上检测(Luminescentt iimm--age analyzer LAS-1000 Plus,Fujifilm,Tokyo,Japan)。Vimentin基因被用作内参照。
2 结 果
2.1 肿瘤质量及瘤内微血管密度的检测结果 本研究使用皮下移植瘤小鼠模型来检测Fumagillin对结直肠癌生长的影响。与对照组相比,Cyclo处理组在肿瘤质量和MVD-CD105上差异无统计学意义,而Fumagillin处理组与对照组相比肿瘤质量和MVD-CD105显著减少(P<0.05)(图1,2)。联合处理组与FFuummaa--gillin处理组相比在肿瘤质量上呈轻度下降的趋势,但这种差异不具有显著性。WiDr和HT-29细胞系在体外也被直接暴露于Fumagillin或Cyclo下,然后用DNA合成试剂盒检测肿瘤细胞的增殖率,处理前后的肿瘤细胞增殖率未见明显变化(图3)。
2.2 HUVECs增殖抑制试验结果 本研究采用BrdU掺入的方法检测HUVECs增殖,与对照组相比,Fumagillin或Cyclo处理后的HUVECs增殖率明显下降,而Fumagillin和Cyclo联合处理后HUVECs的增殖率较单独处理显著下降(P<0.05)(图4)。
2.3 HUVECs体外微管形成抑制试验结果HUVECs可在Matrigel上形成微管样网络,与对照组相比Fumagillin处理后微管长度下降了44.6%;Cyclo处理后微管长度下降了41.0%;而两药联合处理后微管长度下降了78%(图5)。
2.4 Fumagillin处理前后的基因表达变化本研究使用了一含有13 000个基因的基因芯片检测Fumagillin处理前后HUVECs基因表达的变化,结果发现Fumagillin处理后HUVECs有71个基因表达上调和143个基因表达下调,表达变化的基因多与细胞黏附、移动、增殖和基因转录有关。代表性的基因变化见表1。
2.5 定量PCR和免疫印迹法验证基因芯片的结果 为验证基因芯片检测结果的准确性,本研究用定量PCR法检测了CyclinE2,ALCAM和ICAM-1的基因表达水平;用免疫印迹法检测了ALCAM和ICAM-1的蛋白表达水平。定量PCR和免疫印迹法所获结果与基因芯片结果一致:Fumagillin处理后CyclinE2,ALCAM和ICAM-1的表达受到抑制(图6,7)。
3 讨 论
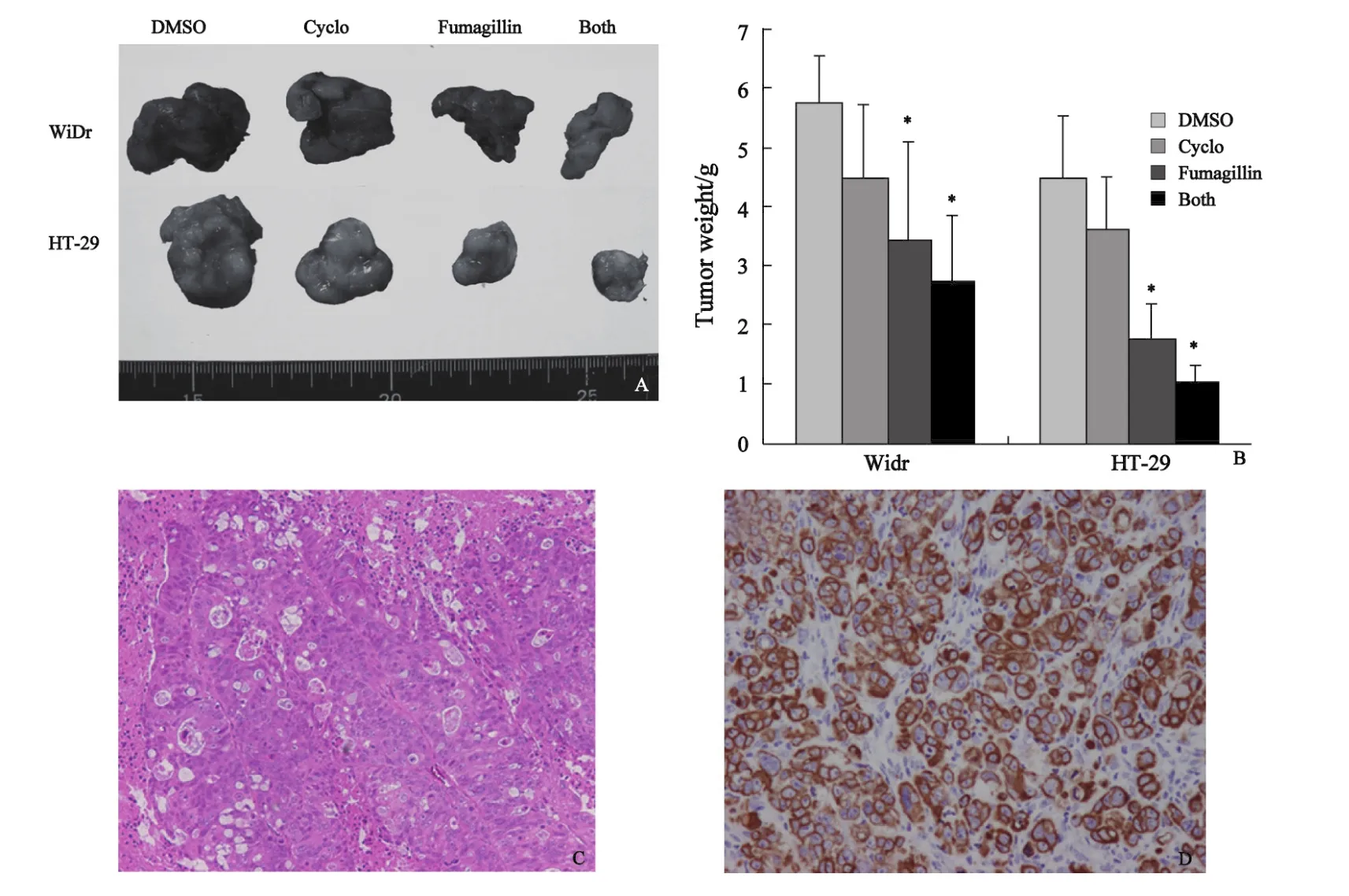
图1 烟曲霉素和(或)Cyclo对结直肠癌生长的抑制作用Fig.1 Effects of Fumagillin and/or Cyclo on colorectal tumor growth
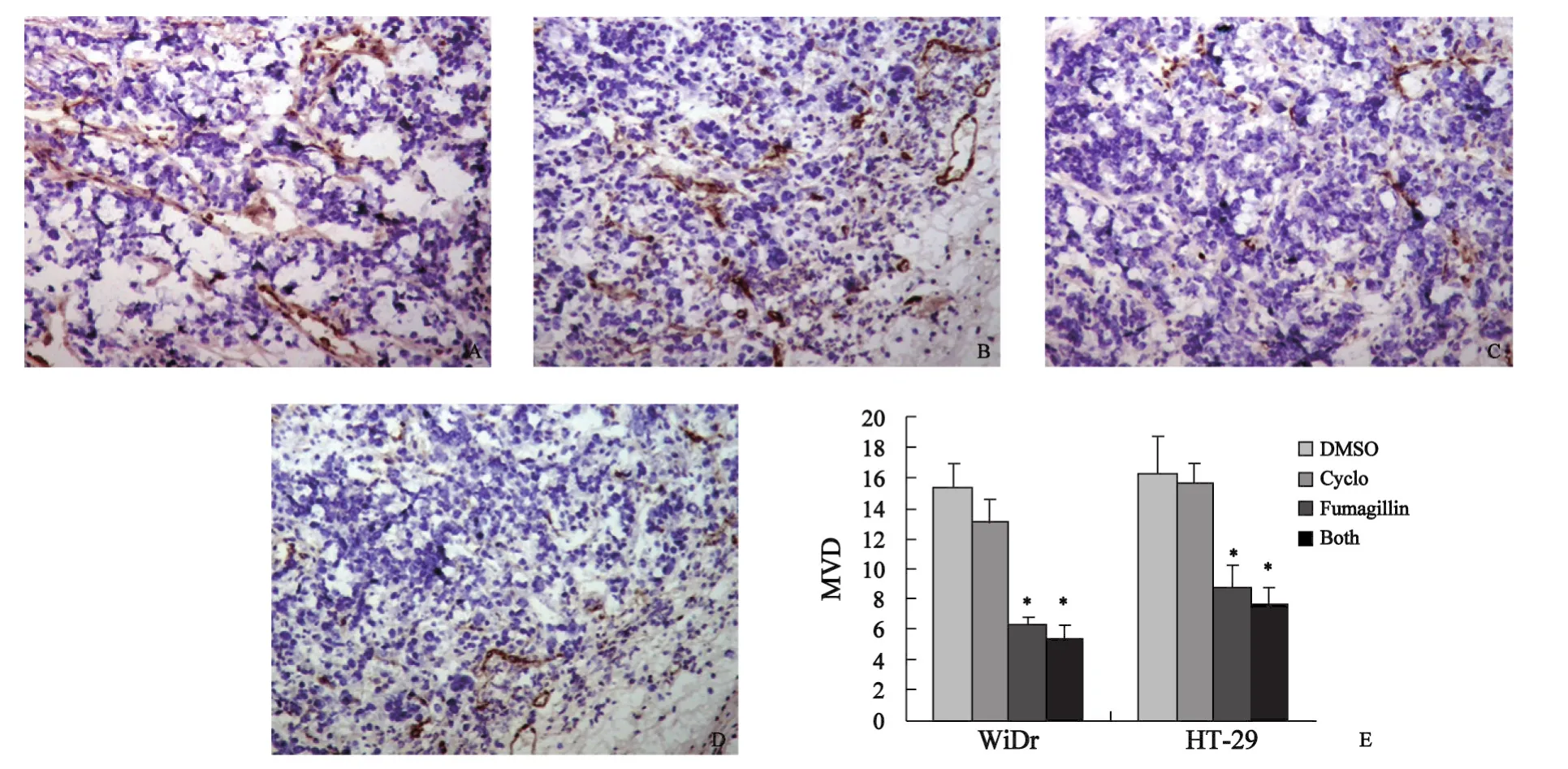
图2 烟曲霉素和(或)Cyclo对结直肠癌血管新生的抑制作用Fig.2 The effects of Fumagillin and/or Cyclo on colorectal tumor angiogenesis
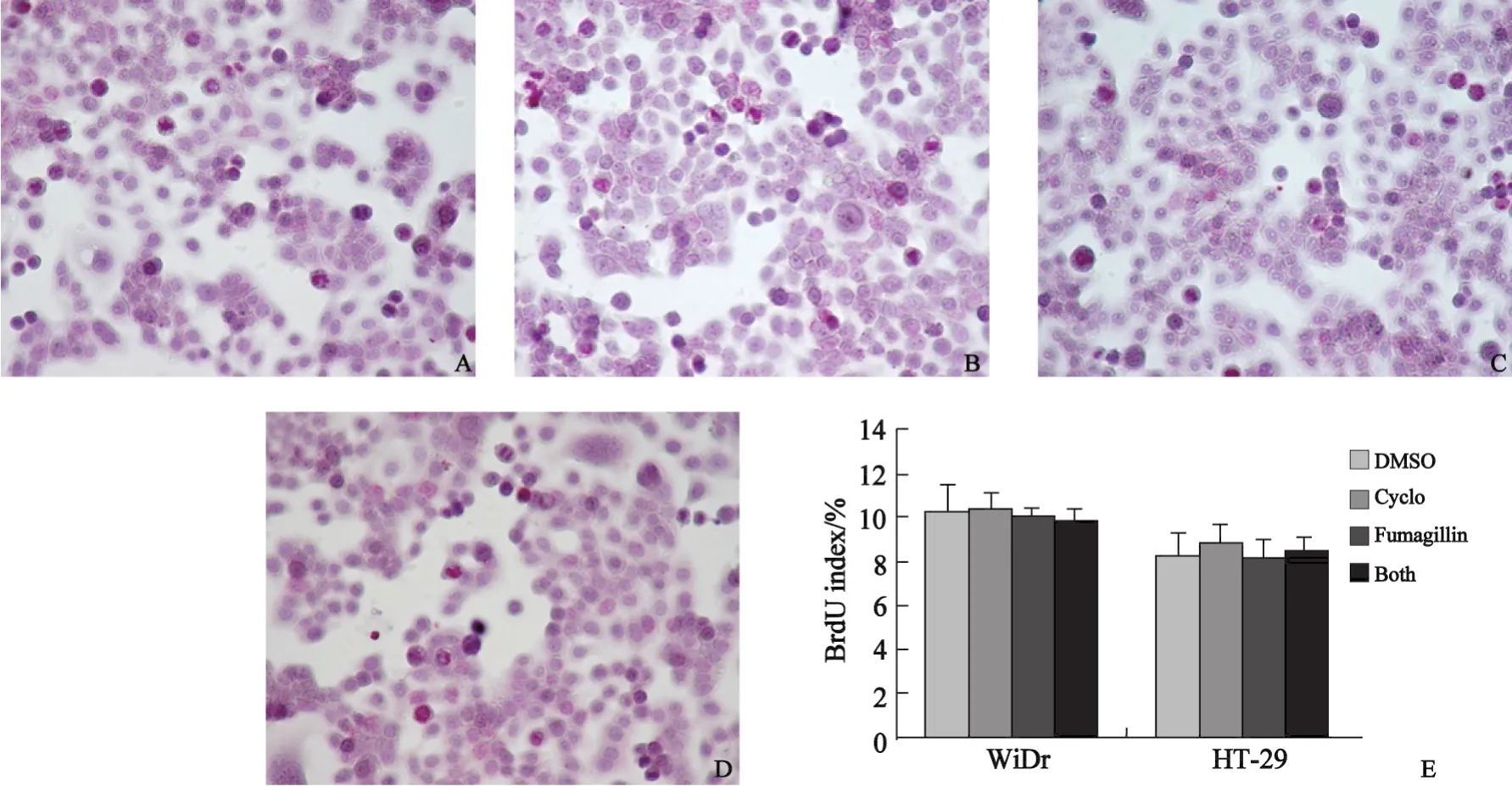
图3 烟曲霉素和(或)Cyclo对结直肠癌细胞增殖的直接影响Fig.3 Direct effect of Fumagillin and Cyclo on proliferation of colorectal tumor cells
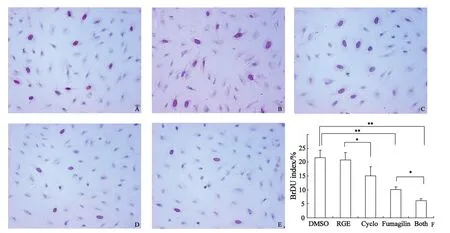
图4 烟曲霉素和(或)Cyclo对脐带静脉内皮细胞增殖的直接影响Fig.4 Suppression of HUVEC proliferation by Fumagillin and Cyclo
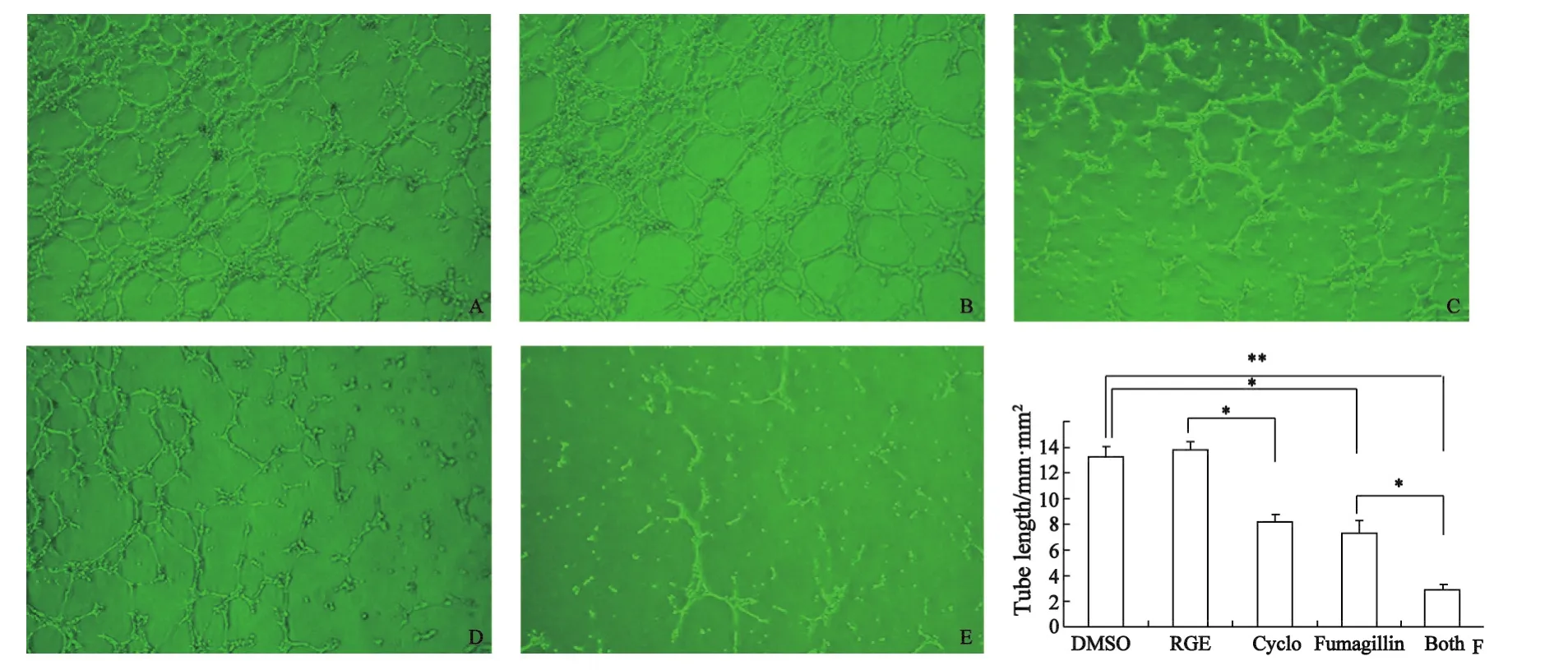
图5 烟曲霉素和(或)Cyclo对HUVECs微管形成的直接影响Fig.5 Effects of Fumagillin and Cyclo on HUVEC tube formation

表1 Fumagillin处理后 HUVECs 的基因表达变化Tab.1 Up- or down-regulated expression gene in HUVECs by Fumagillin
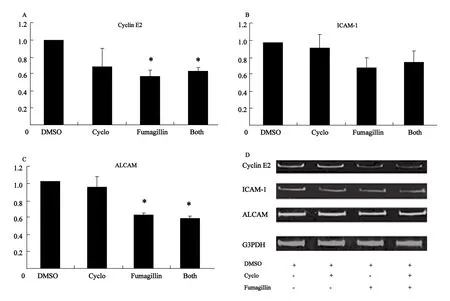
图6 ICAM-1、ALCAM和cyclin E2的定量PCR结果Fig.6 Quantitative real-time polymerase chain reaction (qRT-PCR) results for cyclin E2, ICAM-1 and ALCAM
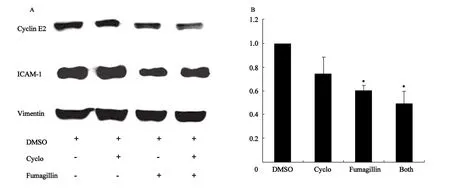
图7 ICAM-1和cyclin E2的免疫印迹检测结果Fig.7 Western blotting result of ICAM-1 and cyclin E2
抗血管新生疗法是肿瘤治疗的新战略之一,Fumagillin及其合成抑制物可以在体内和体外抑制血管新生[10-11]。Fumagillin可使内皮细胞增殖停滞在细胞周期的G1期。MetAp-2可催化N末端蛋氨酸残基的转移,为内皮细胞的增殖是必须[12]。Gervaz等[13]发现TNP-470处理后的DHDK12细胞的增殖和转移受到抑制,他们推测这种抑制是因血管新生和直接细胞毒作用合并的结果。Ogawa等[14]用TNP-470和氟尿嘧啶(5-fluorouracil)联合处理结直肠癌细胞的增殖,获得了明显的细胞毒作用。但他们采用的剂量非常大,而这种剂量是很难应用于临床的。在本研究中,我们使用很低的剂量也明显地抑制了高、中分化结直肠癌细胞系的增殖和肿瘤内CD105阳性新生血管的增加。Fumagillin和Cyclo联合处理组在肿瘤生长抑制上较单独处理组更为有效,但因实验动物数量的限制,这种差异未达统计学意义。在体外HUVECs的增殖和微管形成被Fumagillin或Cyclo明显抑制,而两药联合处理较单独处理更为有效。体外Fumagillin处理结直肠癌细胞并不改变癌细胞的增殖率,这些结果提示Fumagillin可能通过抑制结直肠癌的血管新生来抑制结直肠癌的增殖。
虽然现在已经发现MetAp-2是Fumagillin作用的分子靶标,但以小干扰RNA技术抑制MetAp-2表达后的内皮细胞依然对Fumagillin的生长抑制作用有反应[15]。这些结果说明FFuu--magillin抑制血管新生的分子机制尚不完全清楚。该文作者采用cDNA芯片技术对Fumagillin诱导的HUVECs的基因表达变化做了检测,发现表达被改变的基因多与基因转录、细胞黏附、移动和增殖有关。
表达被下调的一个基因是Cyclin E2。Cyclin E2表达在细胞周期G1期的晚期[16],Cyclin E2与CDK2形成功能复合物,Cyclin E2的表达与细胞通过G1期密切相关。在一个b-catenin诱导的血管新生模型中,内皮细胞的高增殖与内皮细胞高表达Cyclin E2有关[17]。本实验中Cyclin E2的mRNA和蛋白质表达明显被Fumagillin抑制,这可能部分地解释了为什么Fumagillin可以使内皮细胞的增殖停滞在G1期。另外一个表达被下调的基因是ICAM-1,其在内皮细胞上表达,可介导内皮细胞和白细胞的黏附[18]。VEGF-A刺激后内皮细胞的ICAM-1表达上调,提示ICAM-1亦可能参与血管新生的调节[19]。ALCAM(CD166)是一种细胞黏附分子,亦表达在内皮细胞上,并可介导同种细胞间的黏附,近来胚胎发育过程中内皮细胞和造血细胞内ALCAM的表达被检测,并被推测其的表达与血管新生有关[20]。本研究中内皮细胞的微管形成被Fumagillin抑制可能与ICAM-1和ALCAM的表达下调有关。除了Cyclin E2、ICAM-1和ALCAM之外,Fumagillin还抑制了其他一些与内皮细胞增殖和分化有关基因的表达。
总之,Fumagillin可能是结直肠癌的有效治疗药物,Fumagillin通过抑制血管新生抑制结直肠癌增殖,而Cyclin E2、ICAM-1和ALCAM的表达下调可能与Fumagillin抑制血管新生有关。
[1] Dennis LK, Lynch CF, Smith EM. Cancer[M]// Wallace RB, Kohatsu N. Public Health & Preventive Medicine. 15th ed. New York: McGraw Hill Medical, 2008: 1047-1069.
[2] Prabhudesai SG, Rekhraj S, Roberts G, et al. Apoptosis and chemo-resistance in colorectal cancer[J]. J Surg Oncol,2007, 96: 77-88.
[3] Folkman J. Angiogenesis in cancer, vascular, rheumatoid, and other disease[J]. Nat Med,1995,1: 149-153.
[4] Marx J. Encouraging results for second generation antiangiogenesis drugs[J]. Science, 2005, 308: 1248-1249.
[5] Lefkove B, Govindarajan B, Arbiser JL. Fumagillin: an antiinfective as a parent molecule for novel angiogenesis inhibitors[J]. Expert Rev Anti Infect Ther, 2007, 5: 573-579.
[6] Sin N, Meng L, Wang MQW, et al. The anti-angiogenic agent Fumagillin covalently binds and inhibits the methionine aminopeptidase, MetAP-2[J]. Proc Natl Acad Sci USA,1997, 94: 6099-6103.
[7] Sheu JR, Yen MH, Kan YC, et al. Inhibition of angiogenesis in vitro and in vivo: Comparison of the relative activities of triflavin, an Arg-Gly-Asp-containing peptide and antialpha(v) beta3 integrin monoclonal antibody[J]. Biochim Biophys Acta, 1997, 1336: 445-454.
[8] Fonsatti E, Maio M. Highlights on endoglin (CD105): from basic findings towards clinical applications in human cancer[J]. J Transl Med, 2004, 2: 18.
[9] Piao M, Mori D, Satoh T, et al. Inhibition of endothelial cell proliferation, in vitro angiogenesis, and the down-regulation of cell adhesion-related genes by genistein. Combined with a cDNA microarray analysis[J]. Endothelium, 2006, 13:249-266.
[10] Yanase T, Tamura M, Fujita K, et al. Inhibitory effect of angiogenesis inhibitor TNP-470 on tumor growth and metastasis of human cell lines in vitro and in vivo[J].Cancer Res, 1993, 53: 2566-2570.
[11] Ingber D, Fujita T, Kishimoto S, et al. Synthetic analogues of Fumagillin that inhibit angiogenesis and suppress tumour growth[J]. Nature, 1990, 348: 555-557.
[12] Bradshaw RA, Yi E. Methionine aminopeptidases and angiogenesis[J]. Essays Biochem, 2002, 38: 65-78.
[13] Gervaz P, Scholl B, Padrun V, et al. Growth inhibition of liver metastases by the anti-angiogenic drug TNP-470[J]. Liver,2000, 20: 108-113.
[14] Ogawa H, Sato Y, Kondo M, et al. Combined treatment with TNP-470 and 5-fluorouracil effectively inhibits growth of murine colon cancer cells in vitro and liver metastasis in vivo[J]. Oncology Rep, 2000, 7: 467-472.
[15] Kim S, LaMontagne K, Sabio M, et al. Depletion of methionine aminopeptidase 2 does not alter cell response to Fumagillin or bengamides[J]. Cancer Res, 2004, 64: 2984-2987.
[16] Lauper N, Beck AR, Cariou S, et al. Cyclin E2: a novel CDK2 partner in the late G1 and S phases of the mammalian cell cycle[J]. Oncogene, 1998, 17: 2637-2643.
[17] Kim KI, Cho HJ, Hahn JY, et al. Beta-catenin overexpression augments angiogenesis and skeletal muscle regeneration through dual mechanism of vascular endothelial growth factormediated endothelial cell proliferation and progenitor cell mobilization[J]. Arterioscler Thromb Vasc Biol, 2006, 26:91-98.
[18] Sneddon AA, McLeod E, Wahle KW, et al. Cytokine-induced monocyte adhesion to endothelial cells involves plateletactivating factor: suppression by conjugated linoleic acid[J].Bioch Biophys Acta, 2006, 1761: 793-801.
[19] Goebel S, Huang M, Davis WC, et al. VEGF-A stimulation of leukocyte adhesion to colonic microvascular endothelium:implications for inflammatory bowel disease[J]. The Am J Physiol Gastrointest Liver Physiol, 2006, 290: G648-G654.
[20] Ohneda O, Ohneda K, Arai F, et al. ALCAM (CD166): its role in hematopoietic and endothelial development[J]. Blood,2001, 98: 2134-2142.
——水芹主要害虫识别与为害症状

