过滤工艺中颤蚓的迁移分布规律
聂小保,黄廷林,张金松,张爽,李伟,李晓钰
(1.西安建筑科技大学环境与市政工程学院,西安710055;2.长沙理工大学水利学院,长沙410076;3.深圳水务集团,广东深圳 518031)
颤蚓是自然水体中1类常见的底栖类寡毛纲类动物,在全球淡水水域内广泛分布,由于其耐污能力较强,往往是大多数水体中底栖动物的优势种属[1-2]。水体的富营养化使得颤蚓在水库、湖泊类水源水体中大量孳生繁殖[3],进入水厂后,由于其穿透能力较强,可以穿透整个净水工艺,最终进入供水管网对水质造成污染[4-5]。陈旭等[6]在天津3处用户水龙头曾收集到60多条颤蚓,李晓伟[7]等在深圳某水厂现场中试研究中发现,BAC滤池在运行150 d后,出水中有大量颤蚓出现,密度最高可达 200 ind./m3。Mauclaire等[8]进行了砂滤池中无脊椎动物的调查分析,发现包括颤蚓在内的寡毛虫为砂滤池中的优势种属,每升滤料中寡毛虫及其虫卵的数量分别高达200 ind.和50 ind.以上。尽管目前并没有被证实颤蚓等蠕虫会威胁到公众健康[9],但大多数人常常把这些生物的存在和饮用水不卫生联系起来,引起他们对水质信心的下降。颤蚓等无脊椎动物往往能携带大量的细菌,有研究表明,一个无脊椎动物携带的细菌总数达10~4 000个[10]。因此水厂必须采取有效的颤蚓风险控制技术,避免水厂颤蚓及其虫卵的泄漏。
随着给水厂中以臭氧活性炭为代表的深度处理工艺的逐渐推广,颤蚓污染风险有进一步加剧的趋势,首先臭氧接触提高了BAC滤池内的溶解氧浓度,有利于颤蚓生长,其次BAC滤池内丰富的生物膜也为颤蚓的生长繁殖提供了大量食物,颤蚓将大量孳生。目前中国南方湿热地区部分水厂BAC滤池均存在不同程度的颤蚓孳生问题,严重时滤池反冲洗水中甚至有成团的颤蚓出现。利用净水消毒剂对BAC滤池颤蚓进行氧化灭活,虽然能起到明显的灭活效果[11],但滤池内的功能微生物也将被大量杀灭,严重破坏BAC滤池的正常功效。因此充分发挥常规工艺对颤蚓的拦截效果,在颤蚓进入BAC滤池前对其进行拦截,是一条简单有效的风险控制途径。砂滤池作为常规净水工艺中拦截颤蚓的最后一道屏障,其拦截效果显得尤为重要。由于目前尚未见关于过滤工艺对颤蚓的拦截作用的报道,该研究尝试对颤蚓在滤池中的迁移分布规律进行研究,并探讨滤池操作运行条件对颤蚓迁移分布的影响,旨在为给水厂充分发挥砂滤池对颤蚓的拦截效果提供理论依据和技术支持。
1 材料与方法
1.1 试验装置
试验在中试系统中完成。中试系统规模为100~150 L/h,工艺流程为“机械混凝-平流沉淀-石英砂过滤”,流程示意图如图1所示。各净水单元均为有机玻璃制造,其中过滤单元设2组,每组滤柱均为单层均质石英砂滤柱,内径90mm、滤床高度 700mm。滤料规格为细砂:粒径dmin=0.95mm、dmax=1.35mm、不均匀细数k80<1.5;粗砂:粒径 dmin=2.36mm、dmax=3.35mm、不均匀细数k80<1.5。承托层分2层,上层为粒径 4~8mm的粗砂 100mm,下层为粒径10~12mm细鹅卵石50mm。

图1 中试系统流程图
1.2 试验材料
颤蚓采自西安汤峪水库底泥,实验室进行放大培养。培养箱直径500mm,高200mm,基质为汤峪水库表层松软底泥,基质厚度100mm,上覆水为曝气自来水,水深80mm,溶解氧浓度为6~8mg◦L-1,PH为6.5。每天换水1次。每次试验时,从培养箱取出部分底泥,平摊于装有少量蒸馏水的搪瓷托盘,用包裹硅胶的塑料镊子挑取直至所需数量,剩余颤蚓弃用。
原水采用自来水配制,脱氯剂为NaHSO3,脱氯后的自来水按照100mg/L的浓度加入汤峪水库底泥,通过慢速搅拌和进水泵回流方式控制固体颗粒在原水桶中的沉淀,中试系统进水浊度稳定在30~40 NTU之间。
1.3 试验方法
每次试验均在中试系统出水水质稳定后开始进行。在每组滤柱中加入300条颤蚓,滤柱过滤或反冲洗结束后,以5cm长为1段,将滤料分段依次取出,对每段滤料中的颤蚓进行计数,并将各段颤蚓数量视为该段下断面处颤蚓的分布数量,得到颤蚓在滤床中的迁移分布结果。
首先进行不同体长颤蚓在细砂和粗砂滤池中的迁移试验,然后在细砂滤池中分别控制过滤速度、过滤周期和反冲洗强度等操作条件,考察各自对颤蚓在滤床中迁移分布的影响。
2 结果与分析
2.1 颤蚓在滤池中的迁移能力
体长小于2cm和大于4cm的颤蚓分别称之为小虫和大虫(下同),控制滤速为8m/h,过滤时间为12 h,颤蚓在细砂和粗砂滤柱中的迁移分布结果见图2和图3。

图2 不同体长颤蚓在细砂滤床中的迁移分布
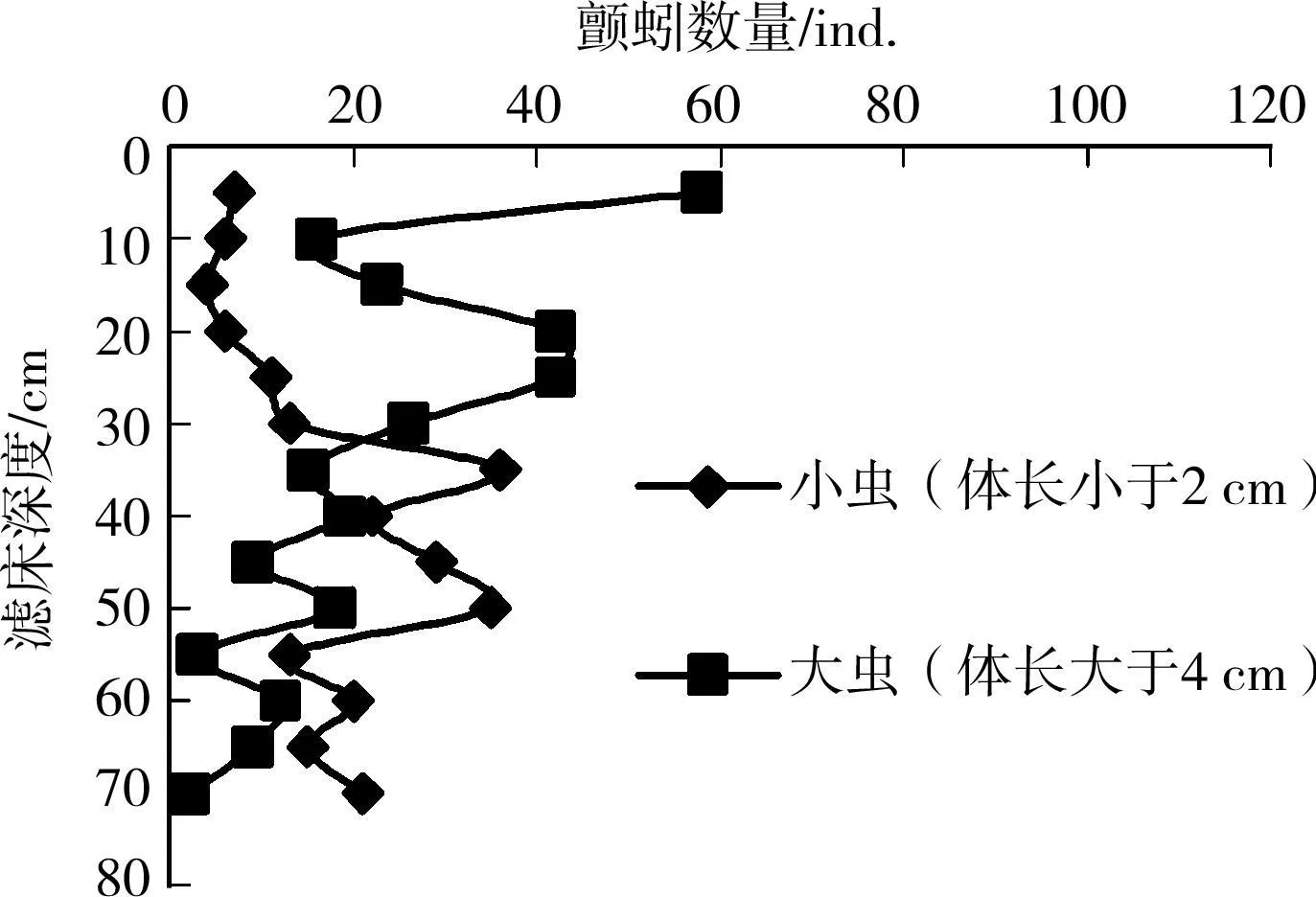
图3 不同体长颤蚓在粗砂滤床中的迁移分布
由图2可知,对于细砂滤池,小虫和大虫在滤床中的分布规律均为随滤床深度的增加,分布数量逐渐减小,只有小虫在25~30cm段要高于20~25cm段,分别为35条和22条。小虫在整个滤床深度范围内均有出现,并有12条穿透了滤池,而大虫的最大迁移深度仅为45cm,且大部分(约为70%)停留在滤床0~5cm段。有研究表明,蠕虫类无脊椎动物的体长和体重关系密切[12-13],诸晖等[14]发现颤蚓体长L和体重W的关系式可用W=a◦Lb来表示,其中a为修正系数,b为相对生长系数。Lazim等[15]研究发现颤蚓体重W 与其第8体节宽度D8th有如下关系:

于是颤蚓体长L h与其第8体节宽度D8th的关系表达式为:

由式(2)可知,随着颤蚓体长的增加,相应的第8体节宽度D 8th也开始增加,这将限制颤蚓在滤床间隙中的迁移能力和范围,图2的结果也表明,体长是决定颤蚓在滤池中迁移和穿透能力的关键因素。陈旭等[6]在研究颤蚓对筛网穿透能力时,也发现体长将影响其穿透能力,7~8cm、2.5~3cm和1~1.5cm长的颤蚓对 100目筛网的穿透率分别为0%、60%和100%。
而在粗砂滤池中(图3),虽然小虫较大虫仍表现出更强的迁移能力,滤床的中下层内小虫的数量更多,但两者随滤床深度的增加其分布已无明显规律,说明在粗砂滤床中,颤蚓体长或者说体宽不再是其迁移的主要限制因素,此时颤蚓既可在水流作用下于滤床中自上之下迁移,也可因觅食等活动发生自下至上的自主迁移,因而在滤床中的分布规律不明显。
对照图2和图3可以看出,20cm以下的滤床中,粗砂滤柱中的颤蚓分布数量要明显高于细砂滤池,这说明滤料粒径的增大有利于颤蚓的迁移。
2.2 滤速对颤蚓迁移分布的影响
分别控制滤速为 7.8m/h、9.4m/h、11.1m/h和12.6m/h,过滤周期为12 h,小虫在细砂滤池中的迁移结果如图4所示。由图4可知,随着滤速的增大,颤蚓在滤床上部的分布数量逐渐减小,中下部分布数量则有增加的趋势。7.8m/h和9.4m/h条件下,颤蚓在滤床中的分布结果较为接近,且均为分布数量沿滤池深度方向有明显递减的趋势;11.1m/h时除20~40cm段外,其余滤床部分颤蚓数量也有自上至下递减的趋势,但不明显;12.6m/h时颤蚓数量分布则随滤床深度表现出比较明显的波浪形,且滤床下层(35cm以下)数量要高于上层(35cm以上)。
Merle等[16]发现颤蚓在自然水体中的迁移主要发生在0~30cm范围内,Tetsuya[17]的研究表明,即使在极端条件下,颤蚓在底泥中的迁移深度也不会超过1m。Merle等[16]研究还表明,底质颗粒粒径对颤蚓的迁移影响显著,颤蚓在石英砂(0.6~2mm)中的迁移能力要明显小于天然底泥。本研究中各滤速下均有颤蚓迁移距离超过70cm,且滤床底层颤蚓数量随滤速的增大而增大,表明滤速是颤蚓在滤床中发生自上向下迁移的主要动力。与其余滤速下颤蚓在滤床中分布规律不同的是,12.6m/h时颤蚓在滤床中沿深度方向呈波浪形分布,经分析,可能是由于此滤速超过了中试系统设计滤速,滤柱拦截的污染物较多,提早发生穿透导致配水不均、滤床中水力条件变得复杂,进而影响颤蚓在滤床中的分布。具体原因尚需进一步深入研究证实。
由于滤速的增大会导致滤床下层颤蚓分布数量的增加,这无疑会增大颤蚓穿透滤池的风险,从试验结果来看,水厂滤池滤速不宜超过9.4m/h。
2.3 过滤周期对颤蚓迁移分布的影响
滤速取9m/h,过滤周期对小虫迁移分布的影响如图5所示。过滤周期较短时(8 h),有超过40%的颤蚓停留在0~5cm处。过滤周期延长至12 h,0~5cm处颤蚓数量明显减小,约占总数的13%左右,同时滤床5cm以下大部分断面处颤蚓数量都要多于过滤周期为8h时,说明过滤周期的延长能够促进颤蚓沿滤床深度方向的迁移。继续延长过滤周期至18 h,除0~5cm除外,其余断面处颤蚓的数量均小于过滤周期为12 h时,但此时颤蚓数量的减小并不意味着迁移规模的降低。进一步分析可以发现,18 h时穿透滤柱的颤蚓数量为128条,而12 h时仅为58条,这也说明了过滤周期延长对颤蚓沿滤床滤床深度方向迁移的促进作用,因此对于水厂而言,适当缩短滤池过滤周期,有助于颤蚓泄露风险控制。图5的结果表明,过滤周期不宜超过12 h。

图4 过滤速度对颤蚓迁移分布的影响

图5 过滤周期对颤蚓迁移分布的影响
2.4 反冲洗后颤蚓在滤床中的迁移分布
在滤柱中投放小虫,进行12 h过滤,滤速9m/h,然后进行反冲洗,反冲洗时间10min,强度分别为15 L/s◦m2、20 L/s◦m2和25 L/s◦m2。反冲洗后颤蚓在滤床中的分布结果如图6所示。经反冲洗后,有较多的颤蚓集中于0~5cm段,5cm以下颤蚓沿滤床深度方向的分布并无明显规律,这可能与反冲洗引起的滤层膨胀有关。对于相同断面处,经反冲洗后颤蚓的分布数量大致随着反冲洗强度的增加而降低。
进一步分析可以发现,15 L/s◦m2、20 L/s◦m2和25 L/s◦m2冲洗条件下,滤床中剩余颤蚓数量分别为139、28和7条,表明反冲洗强度越大,对滤床中颤蚓的去除效果越好。对净水厂过滤工艺而言,滤床对颤蚓的拦截并不意味着去除,被拦截的颤蚓还可能在滤床中二次繁殖,引起新的颤蚓泄漏风险,无脊椎动物的二次繁殖导致的泄漏风险在臭氧活性炭滤池显得尤为突出,因为由细菌组成的生物膜可以为其生长繁殖提供丰富的食物[18]。反冲洗则能实现颤蚓从净水系统真正意义上的去除。由图6可知,保证一定的反冲洗强度是实现颤蚓彻底去除的关键。25 L/s◦m2的反冲洗强度下,颤蚓的去除率可达97.7%,基本可以满足净水工艺对颤蚓风险控制的要求。
常规工艺中单层石英砂滤池单独水冲时的反冲洗强度一般在12~15 L/s◦m2左右[19],与之相比,为达颤蚓去除目的所采用的反冲洗强度要大很多。李小伟等[7]尝试采用加氯水对BAC滤池进行反冲洗,试图利用氯对无脊椎动物的灭活作用来降低反冲洗强度,但效果不明显。因此,研究滤池反冲洗与其它颤蚓风险控制技术有机结合,协同去除颤蚓以达到减小反冲洗用水量,这对于水厂颤蚓风险控制的顺利实施有重要的实际意义。

图6 反冲洗强度对颤蚓迁移分布的影响
3 结论
1)颤蚓在滤池中的迁移能力与颤蚓的体长和滤料粒径有关。颤蚓体长越大,其在滤床中的迁移能力也越小;滤料粒径越大,颤蚓的迁移能力也越强。
2)滤速是颤蚓在滤床中发生自上向下迁移的主要动力,随着滤速的增大,滤床上层颤蚓分布数量逐渐减小,中下部分布数量则有增加的趋势;过滤周期的延长也能促进颤蚓在滤床中的自上向下迁移,适当缩短滤池过滤周期,有助于颤蚓泄露风险控制。
3)反冲洗能够实现颤蚓从净水系统真正意义上的去除,反冲洗强度越大,去除效果越好,反冲洗强度为25 L/s◦m2时,颤蚓的去除率可达97.7%。
[1]MOSLEH Y Y,PARIS-PALACIOS S,BIAGIANTIRISBOURY S.Metallothioneins induction and antioxidativEresponsEin aquatic worms Tubifex tubifex(Oligochaeta,Tubificidae)exposed to copper[J].Chemosphere,2006,64(1):121-128.
[2]MERMILLOD-BLONDIN F,NOGARO G,GIBERT J.Laboratory study highlights thEkey influences of stormwater sediment thickness and bioturbation by tubificid worms on dynamics of nutrients and pollutants in stormwater retention systems[J].Chemosphere,2008,72(2):213-223.
[3]MOSLEH Y Y,PARIS-PALACIOS S,AHMEDM T,et al.Effects of chitosan on oxidativEstress andmetallothioneins in aquatic worm Tubifex tubifex(Oligochaeta,Tubificidae)[J].Chemosphere,2007,67(1):167-175.
[4]何文杰.安全饮用水保障技术[M].北京:中国建筑工业出版社,2006.669-722.
[5]黄廷林,武海霞,陈千娇.水中颤蚓灭活试验研究[J].西安建筑科技大学学报:自然科学版,2006,38(2):263-268.HUANG T L,WU H X,CHEN Q J.Experimental study on killing tubifex in drinking water[J].Jof Xi'an University of ArchitecturE&Technology:Natural SciencEEdition,2006,38(2):263-268.
[6]陈旭,朱琳,王启山,等.红虫生长发育及繁殖的生物学研究[J].给水排水,2005,31(6):38-40.CHEN X,ZHU L,WANG Q S,et al.Pilot study on growth and reproduction of red worm[J].Water&Wastewater Engineering,2005,31(6):38-40.
[7]李小伟.生物活性碳滤池无脊椎动物群落分析及控制技术[D].广州:暨南大学,2007.
[8]MANCLAIREL,SCHURMANN A,MERMILLODBLONDIN F.InfluencEof hydraulic conductivity on communities ofmicroorganisms and invertebrates in porousmedia:a casEstudy in drinking water slow sand filters[J].Aquat.Sci,2006,68(1):100-108.
[9]VAN LIEVERLOO J Hm,BOSBOOM D W,BAKKER G L,et al.Sampling and quantifying invertebrates form drinking water distributionmains[J].Water Res,2004,38(3):1101-1112.
[10]WOLMARANS E,DU PREEZ H H,DEWETcm E,et al.SignificancEof bacteria associated with invertebrates in drinking water distribution networks[J].Water Science&Technology,2005,52(8):171-175.
[11]黄廷林,聂小保,张金松,等.铜对颤蚓的快速灭活作用机制及其在水厂应用分析[J].环境科学,2010,31(2):331-337.HUANG T L,NIEX B,ZHANG J S,et al.Rapid inactivationmechanism of copper to Tubifex tubifex and its application analysis in water plant[J].Environmental Science,2010,31(2):331-337.
[12]FIGUEIREDO-BARROSM P,LEAL JJF,ESTERES F D A,et al.LifEcycle,secondary production and nutrient stockin Heleobia australis(d'Orbigny 1835)(Gastropoda:Hydrobiidae)in a tropical coastal lagoon[J].EstuarinECoastal and Shelf Science,2006,69(1-2):87-95.
[13]KEUN C.ThELifEcyclEand secondary production of cincticostella levanidovae(Tshernova)collected from a headwater stream inm t.Jumbong,Korea[J].J.Asia-Pacific Entomol,2005,8(4):367-374.
[14]诸晖,魏源送,刘俊新.颤蚓在活性污泥中的生长研究[J].环境科学,2008,29(5):1342-1347.ZHU H,WEI Y S,LIU J X.Growth of tubificidaEin activated sludge[J].Environmental Science,2008,29(5):1342-1347.
[15]LAZIMm N,LEARNERm A.ThElife-cyclEand productivity of Tubifex tubifex (Oligochaeta;Tubificidae)in themoat-Feeder Stream,Cardiff,South Wales[J].Holarctic Ecology,1986,9:185-192.
[16]MERLEC,DANIELOPOL D L,WATANAMAHART P.Impact of environmental conditions on thEhabitat selection of interstitial-dwelling tubificids(oligochaeta).An experimental study[J].Geobios, 1997,30(supplement 2):91-97.
[17]TETSUYA N.Seasonal verticalmigration and aestivation of Rhyacodrilus hiemalis(Tubificidae,Clitellata)in thEsediment of LakEBiwa,Japan[J].Hydrobiologia,2006,564(1):87-93.
[18]SCHERIBER H,SCHOENEN D,Traunspurger W.InvertebratEcolonization of granular activated carbon filters[J].Water Research,1997,31(4):743-748.
[19]严煦世,范瑾初.给水工程[M].4版.北京:中国建筑工业出版社,1999.

