苯酚降解菌CN-6的分离及其生长特性
龙腾锐,张 钊,,莊瑞鑫
(1.重庆大学三峡库区生态与环境教育部重点实验室,重庆400045;2.台湾元智大学工程学院化学工程与材料科学系,台湾32003)
苯酚及其衍生物是煤矿开采、石油炼制、炼焦工业、造纸、塑料、纺织等工业废水中的主要排放物质[1-2]。研究表明,苯酚是一种毒性物质,不慎吸、食入,均会对人体健康造成极大伤害,许多酚类更被认为是直接的致癌物质。酚的毒性不仅对人类造成伤害,对水生动植物亦是如此,当水中苯酚含量达到5~25mg/L时,就会造成鱼类的死亡,而酚苯含量大于100mg/L的水若用于灌溉,将会导致农作物的减产和枯死[3-4]。所以,各国水体中苯酚的含量都做出了严格的限制[5],中国对于污水中酚的排放标准最大限值为2mg/L,而生活饮用水含酚的标准更不可超过0.002mg/L。
目前处理含酚废水可采取生物降解、萃取、活性炭吸附、高级氧化等方法[5],其中生物降解法不仅安全、经济,而且不会产生2次污染,因此各国学者在这方面进行了大量研究[6-7]。但生物降解法中的微生物大多是从污泥中驯化得到的菌群,由于菌群内的微生物种类繁多、关系复杂,给降解机理的研究带来不便。
该研究从长期受苯酚污染的土壤中筛选、分离到一株降解苯酚能力较高的细菌菌株。该菌株能以苯酚为唯一碳源和能源生长。通过16S rDNA定序确定该菌的菌属,并对该菌株降解苯酚的生理生化特性和动力学进行了初步研究,旨在找到一些对酚处理效果较好的优势菌株。
1 材料与方法
1.1 微生物
用于研究的菌株分离自台湾桃园县远东纺织厂污水排放口污泥,由台湾元智大学分离技术实验室提供,置于-80℃的冰箱中保存备用。
1.2 化合物及培养基
苯酚、甲醇、甲酸为德国MerckChemicals公司产品,所有药品纯度均超过 99%。实验用水为Millipore公司Milli-Q制备的超纯水。
NB培养(基)液:牛肉浸膏3.0 g/L;蛋白胨5.0 g/L;固态培养基另含琼脂15.0 g/L。
MS培养液:矿物质盐培养液采用 Hutner'smineral Base[8],每1 L培养液中含有KH 2PO45.44 g;Na2 HPO45.65 g;(NH 4)2 SO4 1.00 g;Nitrilotriacetic acid 0.20 g;MgSO40.29 g;CaCl2◦2H2O 0.07 g;(NH 4)6Mo7O24◦4H2 O 0.2mg;FeSO4◦7H2 O 8.3mg;EDTA 3.1mg;ZnSO4◦7H 2O 13.7mg;MnSO4◦7H2O 1.9mg;CuSO4◦5H2O 0.5mg;Co(NO3)2◦6H 2O 0.3mg;Na2B4 O7◦10H2 O 0.2mg。初始pH 值为7.2±0.5。
1.3 分离和降解培养试验
富集培养:将10 g纺织污水排口污泥加入100mL NB培养液中搅拌静置,取上清液作为接种液。在250mL培养瓶中加入100mLmS培养液、2mL接种液、苯酚(100mg/L)作为唯一碳源,将培养瓶置于水浴摇床中(30℃±0.5℃,120 rpm)培养。富集的菌液约每两天转接1次,每次将5mL前次富集的菌液转接到含有100mL新鲜MS培养液的培养瓶中,同时将苯酚的浓度从100mg/L增加到200mg/L,如此转接10次。
菌株分离:将富集得到的培养菌液转接到NB固态培养基上,划线分离纯化,置于30℃±0.5℃下的培养箱中培养,如此重复直至得到纯菌株。
苯酚降解试验:在100mL无菌MS培养液中加入2mL含有纯菌株的磷酸盐缓冲液作为接种菌,将不同浓度的苯酚作为唯一的碳源加入无菌MS培养液,置于水浴摇床中(30℃±0.5℃,120 rpm)培养,研究CN-6在不同初始浓度苯酚条件下的降解特性。PH、温度、溶氧量试验是将300mg/L的苯酚作为唯一碳源加入培养液中,改变PH、温度、水浴摇床晃动速度来了解CN-6在相应环境中对苯酚的降解特性,培养条件同上。每个降解试验做3个平行样品,间隔1 h进行无菌操作取样,测定生物量和苯酚浓度。
1.4 分析方法
苯酚浓度:高效液相色谱(HPLC)法。取1mL样品加入0.25mL HCl(3mol/L),均匀混合后,经孔径为0.2μm的Millipore针筒滤膜过滤后,用高效液相色谱仪在254 nm波长用外标法进行定量。液相色谱仪为日本 JASCO 975型,色谱柱为美国Phenomenex Synergi 4(Polar-RP(150mm×4.6mm,4μm)),流动相为甲醇与水的混合物,按6:4(V/V)配制(含 0.1%的甲酸),流速1.5mL/min,柱温30℃,进样量10μL。
生物量:比浊法,采用JASCO公司V-550型紫外线-可见光光谱仪在 600 nm下测定光密度值(OD600)。
1.5 16SrDNA测序分析和菌种鉴定
将细菌接种于NB培养液中进行12 h培养后,取 1mL培养液,使用 Genomic DNAmini kit Geneaid纯化DNA,采用其标准流程得到genomic DNA,并在-20℃下保存备用。
用于PCR反应的引物为M 13F(-20)5'-GTA AAA CGA CGG CCA GT-3'和M 13R(-24)5'-AAC AGC TAT GAC CAT G-3'。PCR反应体系:50μL PCR混合物中包含细菌DNA 1μL,10 μmol/L引物各 1μL,PCR缓冲液 5μL(PH8.3 Tris-HCl 10mmol/L,KCl 50mmol/L,MgCl2 2mmol/L,0.01%gelatin),2.5mmol/L dNTP1 μL,Taq聚合酶 0.5μL。PCR反应条件:94℃10min,55℃1min,72℃2min扩增35个循环,最后在72℃保温延伸10min。纯化后的PCR产物,由台湾明欣生物科技公司使用ABI Prism 3730型基因分析仪定序。用电子扫描电镜观察菌体形态特征,并用16S rDNA法进行细菌鉴定。
1.6 系统发育分析
将获取的CN-6菌株16S rDNA序列在NCBI上进行 BLAST分析比对,选取相关序列(皆为Pseudomonas属),再利用DNAman进行多重序列比对(Multialignment),然后构建发育树(Distancemethod选取Kimura,BootstraPtrials 1 000次)。
4.2.3 构建统一的联合标准和完善的服务体系。由于图书馆配产业成员来自天南海北的出版社、馆配商及各大高校图书馆和省市地区公共图书馆等,各行业所运用的办公系统和工作标准不一,导致图书信息的传递、转换、利用受限,给图书采访工作带来诸多不便,因此建立高度统一的信息传递标准和完善的联合体系是跨领域的多方合作亟需解决的重要问题。
1.7 生长动力学
利用CN-6在不同初始浓度下的降解数据,作出生长曲线。计算每组实验对数生长期中生长曲线的斜率,推估出不同初始酚浓度下的比生长速率,并用不同比生长速率值对不同初始酚浓度做图,选择合适的动力学模型,在MATLAB 7.0中对数据点进行非线性回归,得出各动力学参数。
2 结果与分析
2.1 菌株的分离鉴定
通过富集培养,从污泥中分离得到1株纯菌种,可利用苯酚为唯一碳源和能源独立生长于培养基中,暂命名为CN-6。CN-6在固态NB培养基上菌落无色透明,菌落中心略高于周围边缘。挑取单菌落,利用扫描电镜进行个体观察,细胞呈杆状(图1),革兰氏染色呈阴性,氧化酶为阳性和过氧化氢酶为阴性。

图1 CN-6扫描电镜图(7 000×)
利用菌株16S rDNA特异引物进行PCR扩增,得到约1.5 kb的扩增产物(图2)。DNA测序后,与GenBank细菌序列库中序列进行同源性比对,CN-6与假单胞菌属的多株细菌相似性均在90%以上,其中与Pseudomonas sp.Hg4-06(EU304252.1)相似系数高达 98%。根据 16S rDNA的序列,Pseudomonas sp.CN-6的系统非根状发育树(图3)。
2.2 Pseudomonas sp.CN-6对不同浓度苯酚的降解
将CN-6菌株接种在PH 7.0,苯酚质量浓度分别为30mg/L,60mg/L,100mg/L,150mg/L,200mg/L,300mg/L,400mg/L,500mg/L,600mg/L和1 000mg/L的MS培养液中,初始接种生物量为0.05~0.08 OD,将其置于水浴摇床中(30℃±0.5℃,120 rpm)培养24 h,持续测定细菌的生长和苯酚降解情况,结果见图4。

图2 16Sr DNA PCR扩增

图3 CN-6系统发育树

图4 浓度对CN-6菌株降解苯酚的影响
从图4中可知,在初始苯酚浓度不大于 500mg/L的培养液中,细菌生长较快,苯酚的小时平均降解速率随底物浓度增大而加快,由图5所示,300mg/L、PH 7.0时,完全降解苯酚耗时9.5 h,平均每小时降解33.05mg/L苯酚,比降解速率大,降解苯酚能力明显高于文献记载[9-11],但迟滞期较长;在400~500mg/L时,细菌生长速度和苯酚降解速率略有下降,但苯酚均能完全降解;当苯酚高于500mg/L,细菌生长受到抑制降解能力迅速下降,在24 h内无法完全降解培养液中的苯酚;当苯酚浓度在1 000mg/L时,细菌生长受到严重的抑制而停滞,48 h内未发现苯酚被降解。

图5 CN-6菌株对300ppm苯酚的降解
2.3 pH
为了掌握pH对菌株降解苯酚的影响,实验将CN-6菌株分别接种于苯酚质量浓度为300mg/L、pH 值为4.5~9.5的mS培养液中,在30℃、120 rpm下水浴摇床培养,持续无菌取样测定苯酚浓度,所得结果见表1。
从表中可知,当PH值低于6.0或高于8.5时,菌株对苯酚的降解速率快速下降;当pH值在7.0~8.5时,菌株均能够快速的降解苯酚。由实验得到的最适降解pH值为8.5,说明碱性环境更利于CN-6的生长,这是由于苯酚在水溶液中为酸性(pH=5.2),根据唐伟等研究[12-13],苯酚对微生物的毒性随pH值的增高而减小,因此碱性环境降低了苯酚毒性从而加快了微生物新陈代谢。

表1 PH对CN-6菌株降解苯酚的影响
试验中MS培养液在30oC时初始生物量0.05~0.08;在PH4.5,5.0,9.5未观测到苯酚的降解。
2.4 温度

图6 温度对CN-6菌株降解苯酚的影响
2.5 溶氧量
水中的溶解氧含量对CN-6降解苯酚速率的影响通过比较细菌在水浴摇床不同晃动速率下对300mg/L的苯酚的降解时间得到。当晃动速率从40 rpm增加到120 rpm,晃动速率与CN-6菌株的生物量(OD600)和对苯酚的降解速率正相关,同时菌株可以稳定持续的生长(图7)。
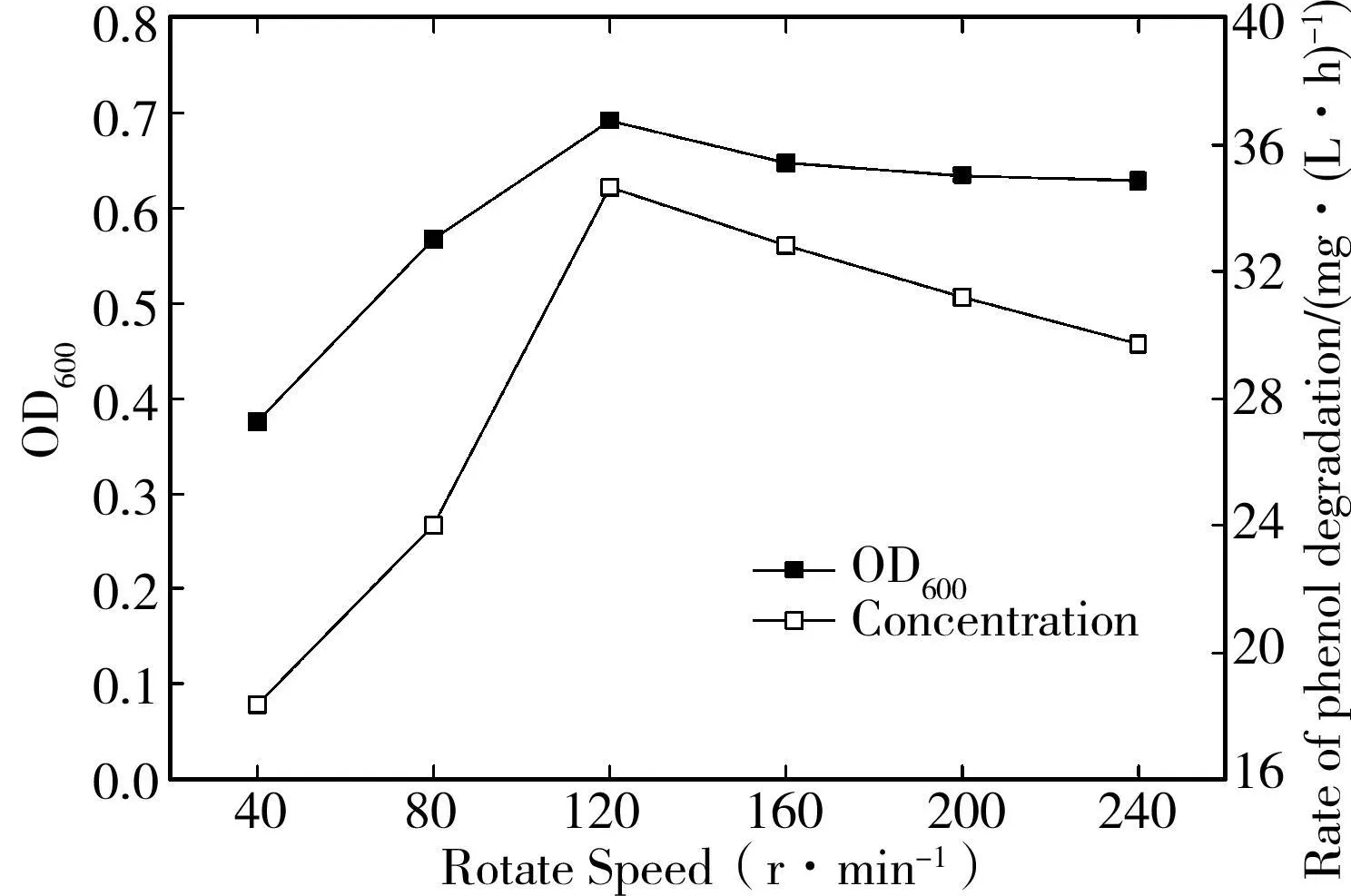
图7 晃动速度对CN-6菌株降解苯酚的影响
这是因为CN-6是兼性好氧菌,溶解氧作为一项重要的电子受体,在微生物的生长中发挥着重要的生理作用[14],摇床的晃动速率越快,质传效率就越高,使得培养基中的溶解氧含量增高。但是,当晃动速率持续增加,细胞浓度和降解速率则维持相对的稳定。因此,120 rpm是细菌生长和降解苯酚的最适条件。
2.6 细胞生长动力学
根据上述试验发现,菌株CN-6对苯酚的降解能力较高,随苯酚初始浓度的增加,苯酚的降解速率提高,但在实验中同时也发现高浓度的苯酚对降解产生了抑制作用。因此,在建立动力学模型时,需要选择底物抑制模型。已经有多种底物抑制模型被建立[15-17],其中Haldane'smodel最为常见,用来描述细胞的比生长速率模式。Haldane'smodel的定义如1式[18]:

式中,比生长速率μ(1/h)和底物浓度S(mg/L)由实验数据得知,而最大比生长速率μmax(1/h)、亲和性常数kS(mg/L)、抑制常数kI(mg/L)则是未知的动力参数。其中,μmax被视为降解能力的指标,数值愈大,代表降解速度愈快;KS值与菌种对底物的化学亲和力成反比,数值愈大,代表菌种与底物亲和力愈差;kI为抑制常数,数值愈大,代表菌种对基质耐受力愈好。由于Haldane'smodel为非线性的方程式,难以直接利用数值技术软件估算其动力学参数,故将原式整理为2式所示:
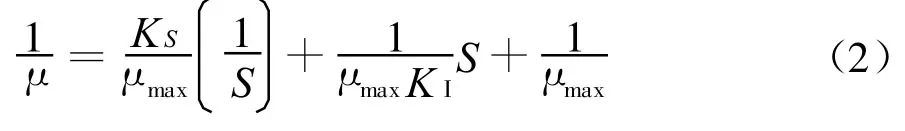
将实验数据代入整理后的Haldane'smodel,利用MATLAB 7.0进行非线性回归计算,如图8所示。

图8 比生长速率的动力学拟合
得到模型参数μmax=0.452 h-1;kS=28.617mg/L;kI=782.4mg/L。曲线拟合的最小标准平方差R2值为0.94。
从获得的模型参数值可知,CN-6菌株的μmax、KS值较大,因此菌株对苯酚的降解速率较快,但对苯酚的耐受性有待提高,蔡尚原等[19-20]利用水杨酸预培养来活化细胞,大幅降低了细胞受酚抑制的影响,使细胞大幅提升对酚基质的抗性,可以获得更高的抑制常数kI。
4 结论
1)从长期受苯酚污染的土壤中经富集培养,筛选分离到1株革兰氏染色阴性的细菌CN-6,经形态观察、16S rDNA序列测定和系统发育分析初步鉴定为Pseudomonas sp.。
2)CN-6能以苯酚为唯一碳源和能源生长,降解效率高,500mg/L的苯酚经过17 h培养可完全降解,在 300mg/L时,平均小时苯酚降解量达到36.57mg/L。
3)CN-6生长和降解苯酚的pH、温度和溶氧量范围较广,最适 PH、温度分别为8.5和30℃;最适水浴摇床晃动速率为120 rpm。
4)由于高浓度苯酚时CN-6菌株的降解过程存在底物抑制现象,采用Haldane非竞争性底物抑制动力学模型,计算确定了模型参数 μmax、kS和kI分别为 0.452 h-1、28.617mg/L 、782.4mg/L,模型拟合度高,为后续生物反应器的设计和模拟提供了实验依据。
致谢:感谢重庆大学国际事务处提供的赴台研究便利。同时感谢台湾元智大学生物科技与工程研究所简志青教授、魏毓宏教授对该研究提出的宝贵意见和指导。
[1]El-NAAEm H,Al-MUHTAEB S A,MAKHLOUF S.Biodegradation of phenol by Pseudomonas putida immobilized in polyvinyl alcohol(PVA)gel[J].J.Hazard.Mater,2009,164:720-725.
[2]PAN G,Kurumada kI,Hybrid gel reinforced with coating layer for removal of phenol f rom aqueous solution[J].Chem.Eng.2008,138:194-199.
[3]LEFEBVREO,MOLETTA R,Treatment of organic pollution in industrial salinEwastewater:a literaturEreview[J].Water Res.,2006,40:3671-3682.
[4]NAIR I C,Jayachandran kand Shashidhar S,Treatment of paper factory effluent using a phenol degrading Alcaligenes sp.under freEand immobilized conditions[J].Bioresour.Technol.2007,98:714-716.
[5]LAKSHMIcm vV,SRIDEVI V.A review on biodegradation of phenol from industrial eff luents[J].Ind.Pollut.Contr.,2009,25(1):13-27.
[6]NUHOGLU A,YALCIN B,Modelling of phenol removal in a batch reactor[J].Process Biochem.,2005,40:1233-1239.
[7]AGARRY S E,DUROJAIYEA O,SOLOMON B O.Microbial degradation of phenols:A review[J].Int.J.Environ.Pollut.,2008,32(1):12-28.
[8]ALIMOVA A,ROBERTSm,et al.Effects of smectitEclay on biofilm formation bymicroorganisms[J].Biofilms,2006,3(1):47-54.
[9]龚斌,刘津,赵斌.一株高效苯酚降解菌的分离、鉴定及其降解特性的研究[J].环境科学学报,2006,12(26):2008-2012.GONG BIN,LIU JIN,ZHAN BIN.ThEisolation an identification of a phenol-degrading strain and study on its degrading characterization[J].Acta Scientias Circumstantiae,2006,26(12):2008-2012.
[10]HAMED T A,BAYRAKTAR EU,MEBMETOGLU T,et al.ThEbiodegradation of benzene,toluenEand phenol in a two-phasEsystem[J].Biochem.Eng.,2004,19:137-146.
[11]JUANG R S,TSAI S Y,Growth kinetics of Pseudomonas putida in thEbiodegradation of singlEandmixed phenol and sodium salicylate[J].Biochem.Eng.,2006,31,133-140.
[12]唐伟,孙晓怡.PH值对酚类化合物生物毒性的影响[J].黑龙江环境通报,2005,(01):45-48.TANG WEI,SHUN XIAO-YI.InfluencEof PH valuEto biologic toxicity of phenol compund[J].J.Heilj.Environ,2005(01):45-48.
[13]于瑞莲,胡恭任.不同 PH值下对发光菌的毒性及QSAR研究[J].环境科学与技术,2005,(04):68-70.YU RUI-LIAN,HU GONG-REN.Toxicity of phenols to photobacterium phosphoreum at different PH and QSAR[J].Environ.Sci.&Technol,2005(04):67-70.
[14]KULKA RNIm,CHAUDHARI A.Biodegradation of p-nitrophenol by P.putida[J].Bioresour.Technol.,2006,97:982-988.
[15]YANO T,AKAHAREN T,KAMIYAMA S,et al.Kinetic studies onmicrobial activities in concentrated solutions.I.Effect of excess sugars on oxygen uptakEratEof a cell-freErespiratory system[J].Agr Biol Chem,1966,30:42-48.
[16]ESSAM T,AMINm A.Kinetics andmetabolic versatility of highly tolerant phenol degrading Alcaligenes strain TW1[J].J.Hazard.Mater,2010,173:783-788.
[17]ABIA S,SHODAm,NAGALANIm.Kinetics of product inhibition in alcohol fermentation [J].Biotechnol Bioeng,1968,10:845-864.
[18]COHEN-BAZIREG,W RSISTROM,R Y STANIER.Kinetic studies of pigment synthesis by non-sulfur purplEbacteria.[J].Cell.Comp.Physiol.,1957,49,25-68.
[19]CHUNG T P,TSENG H Y,JUANG R S.Mass transfer effect and intermediatEdetection for phenol degradation in immobilized Pseudomonas putida systems[J].Process Biochem,2003,38(10):1497-1507.
[20]KUMAR K,kUMAR S.Biodegradation kinetics of phenol and catechol using Pseudomonas putidamTCC 1194[J].Biochem.Eng.,2005,22:151-159.

