H9N2亚型禽流感流行株灭活疫苗种毒的筛选
万晓朋,曾显营,田国彬,李雁冰,邓国华,施建忠,刘丽玲,钟功勋,姜永萍,王彦妮,陈化兰
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/农业部动物流感重点开放实验室,黑龙江哈尔滨150001)
H9N2亚型禽流感(Avian influenza,AI)是持续危害我国及世界养禽业发展的重要禽类传染病之一[1-2],同时 H9N2亚型禽流感病毒(Avian influenza virus,AIV)还可感染人,提供内部序列与H5N1亚型禽流感病毒重组[2-4];并且具有人流感病毒的受体结合位点[3],因此对H9N2亚型AI的研究具有重要的经济和公共卫生意义。
我国自1994年首次报道从鸡群分离到H9N2亚型AIV以来[5],该亚型病毒已在我国广泛分布和流行[2],并且在家禽中不断地进化[6-7]。疫苗免疫是控制H9N2亚型AI的重要措施之一,我国有多种不同厂家研制和生产H9N2亚型AI灭活疫苗,在我国大范围应用。然而,由于种种因素,目前H9N2亚型AIV仍然在我国持续流行。为筛选出具有良好免疫效果的疫苗株,本研究选取2008年分离自8个省份的15株H9N2亚型AIV进行分析,选择代表毒株进行鉴定并制备灭活疫苗,免疫SPF鸡进行免疫效力研究,期待筛选出适合我国大部分地区应用的H9N2亚型AI灭活疫苗理想种毒株。
1 材料和方法
1.1 病毒株和血清 18株H9N2亚型AIV由中国农业科学院哈尔滨兽医研究所的国家禽流感参考实验室分离、鉴定和保存,其中15株2008年分离病毒来源于湖南、广西、福建、山东、浙江、安徽、湖北、四川8个省份(表1)。病毒抗血清由国家禽流感参考实验室制备、保存。
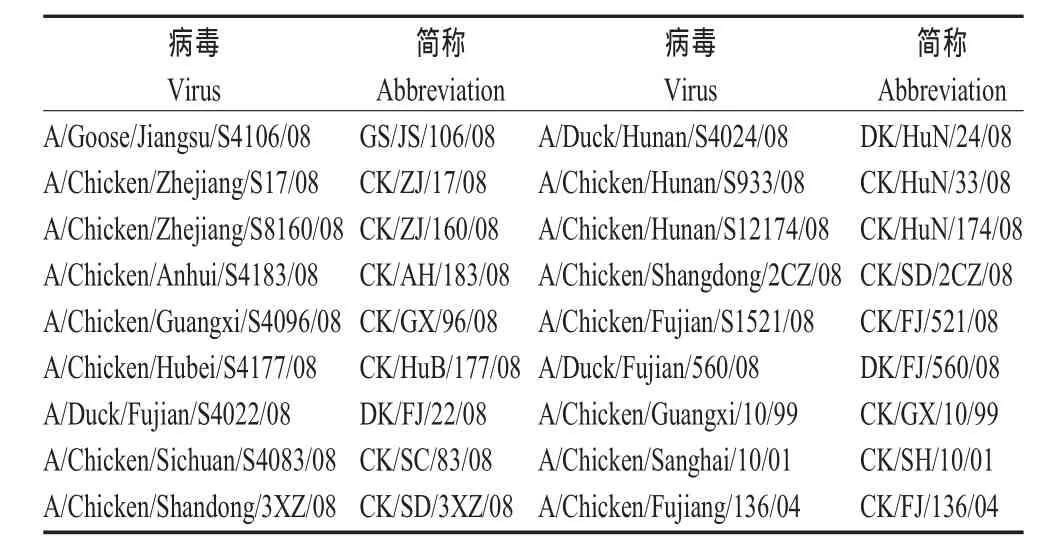
表1 H9N2亚型禽流感病毒分离株及简称Table 1 H9N2 subtype AIV isolates and abbreviation
1.2 SPF鸡胚和SPF鸡 9日龄~11日龄SPF鸡胚和4周龄~8周龄SPF鸡均购自哈尔滨兽医研究所实验动物中心,感染实验在负压隔离器中进行。
1.3 病毒的抗原性分析 选取病毒,制备抗血清,采用血凝(HA)-血凝抑制(HI)试验(GB/T 18936-2003)进行病毒抗原性分析。
1.4 毒株HA基因同源率比较 对疫苗株和攻毒株GS/JS/106/08、CK/SC/83/08 和 DK/FJ/22/08, 进 行HA基因测序,与目前用于制备H9亚型HI试验抗原的CK/SH/10/01株序列一起用Megalign进行同源率分析。
1.5 毒株的鸡胚半数感染量(EID50)测定 将病毒株用无菌生理盐水作10倍倍比稀释,取10-5~10-106个稀释度,各尿囊腔接种10日龄SPF鸡胚5个,37℃培养72 h后,逐个测定鸡胚尿囊液HA价,利用Reed-Muench法计算病毒EID50。
1.6 候选疫苗株对SPF鸡的致病性 分别将制备疫苗用病毒以106EID50(0.1 mL/只)的剂量滴鼻接种3周龄~4周龄SPF鸡10只,另取条件相同的SPF鸡10只,不接种作为对照,在相同条件下分别饲养,在14 d内观察感染鸡是否出现死亡或明显异常反应。
1.7 病毒株的稳定性实验 将制备疫苗用毒种分别以无菌生理盐水作10-4稀释,各接种9日龄~11日龄SPF鸡胚5个,收取尿囊液,在鸡胚上连续传15代,用HA试验检测每个代次的鸡胚尿囊液血凝价,同时观察胚体有无肉眼可见病变。
1.8 灭活疫苗免疫效力试验 将H9N2亚型候选疫苗株以常规方法制备油乳剂灭活苗,分别以0.3 mL/只的剂量免疫3周龄SPF鸡。免疫21 d时,采集血清,用商品化的H9亚型抗原和相应疫苗株测定HI抗体,同时将免疫鸡连同条件相同的对照鸡,分别以鼻腔途径感染选择的H9N2亚型流行株鸡胚尿囊液0.1 mL(含106EID50)。攻毒后第5 d采集喉头和泄殖腔拭子进行病毒分离,病毒分离阴性样品则盲传1代,每只鸡均以喉头和泄殖腔拭子的排毒总数作为其最终的排毒结果。
2 结 果
2.1 抗原性分析 HI试验结果表明,我国分离的H9N2亚型AIV早期分离株CK/GD/6/97(GD6)、DK/NJ/2/97(NJ2)、CK/BJ/8/98(BJ8)和 CK/HB/31/00(HB31)血清对2008年分离株的HI抗体效价相差8 log2左右,抗原性存在较大差异;CK/HuN174/08、CK/SD/2CZ/08、CK/FJ/136/04和 CK/GX/10/99毒株与 2008年其他毒株约相差2 log2~4 log2,抗原性略有差别;2008年分离的大部分毒株间的抗原性比较接近,HI交互抗体均在10 log2左右(表2)。综合考虑毒株的分离时间、地点、抗原性变化以及在一定区域分离的流行株数量等因素,本研究选取CK/HuN/174/08、CK/HuN/33/08、CK/SD/2CZ/08、CK/ZJ/17/08、CK/FJ/521/08和CK/FJ/560/08株共6个毒株进行免疫效力试验研究。
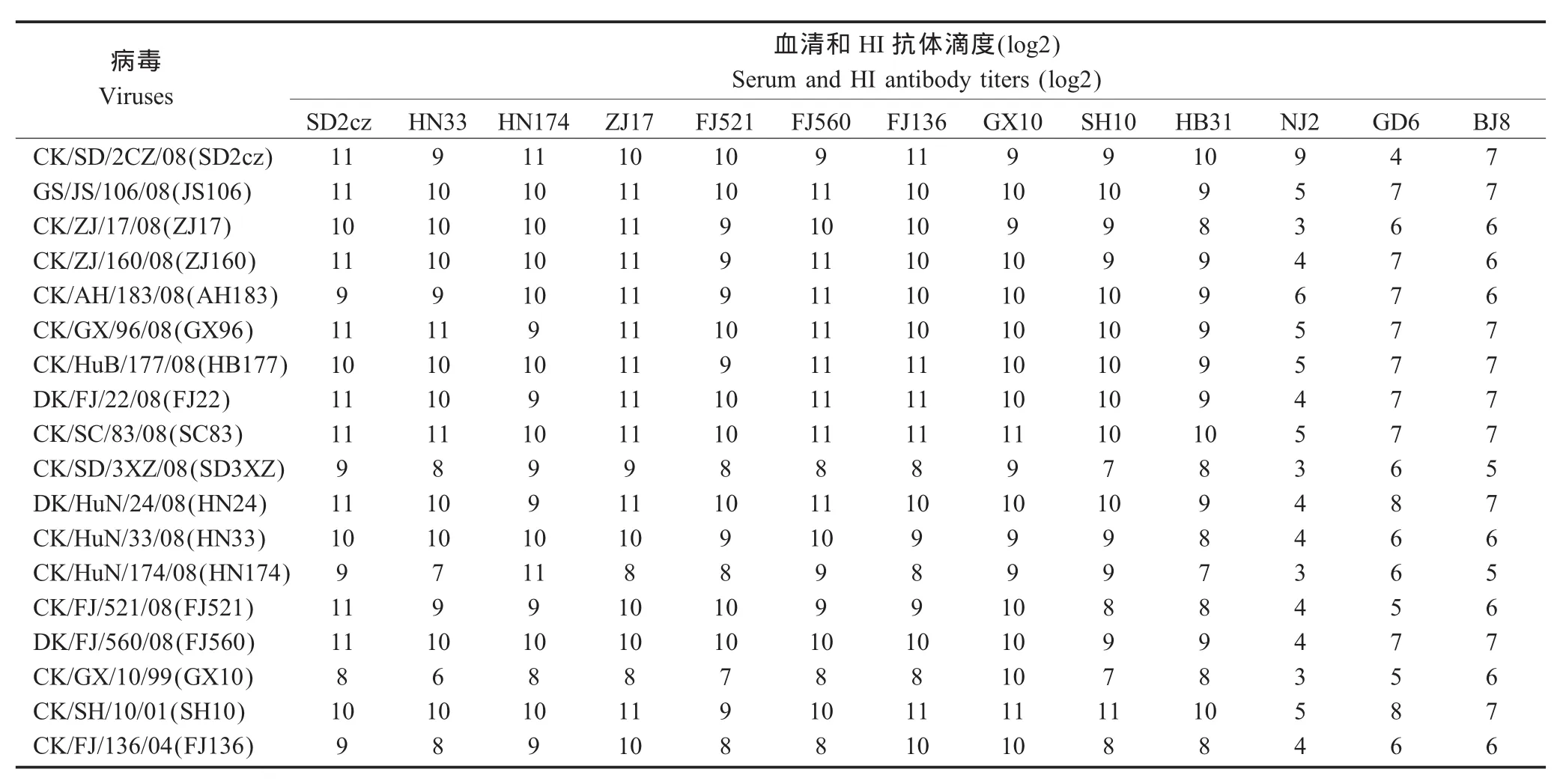
表2 H9N2亚型禽流感病毒抗原性分析Table 2 Antigentic analysis of H9N2 subtype influenza virus
2.2 HA基因同源率比较 包括疫苗株在内的2008年分离的8株病毒HA基因核苷酸同源率在93.2%~98.6%之间,而CK/SH/10/01毒株与这8株病毒的同源率仅在91.9%~93.5%之间。
2.3 效检用病毒株EID50测定 测定结果,CK/HuN/33/08、 CK/HuN/174/08、 CK/FJ/521/08、 DK/FJ/560/08、CK/ZJ/17/08、CK/SD/2CZ/08、DK/FJ/22/08、CK/SC/83/08和GS/JS/106/08株每0.1 mL的病毒含量 依 次 分 别 为 109.16EID50、 108.38EID50、 108.57EID50、108.50EID50、 108.69EID50、 108.13EID50、 108.38EID50、108.79EID50和108.57EID50。
2.4 候选疫苗株对SPF鸡的致病性 候选疫苗毒株 CK/HuN/33/08、 CK/HuN/174/08、 CK/FJ/521/08、DK/FJ/560/08、CK/ZJ/17/08和CK/SD/2CZ/08感染雏鸡后均不出现死亡或明显异常反应。
2.5 病毒株的稳定性 6株病毒在SPF鸡胚连续传了15代,所有代次病毒均无致病性;HA效价均比较稳定,除 DK/FJ/560/08、CK/ZJ/17/08毒株在 9 log2左右以外,其余毒株均在10 log2左右。
2.6 灭活苗免疫效果试验
2.6.1 免疫抗体检测 6株病毒灭活苗免疫后,针对目前使用的H9抗原的平均HI抗体滴度在9.33 log2~11.271 log2之间;针对疫苗株本身抗原的平均HI抗体滴度在10.35 log2~11.81 log2之间,表明各毒株均具有良好的免疫原性,免疫后能产生较高滴度的HI抗体(表3)。
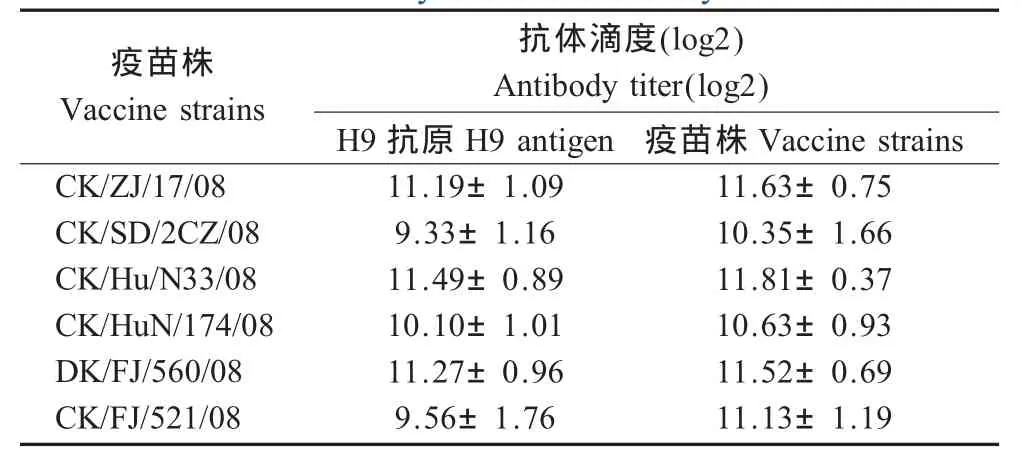
表3 疫苗免疫21 d时HI抗体滴度Table 3 HI antibody titers after 21 day's vaccination
2.6.2 攻毒保护性研究 在所有病毒株分别以106EID50攻毒后,CK/FJ/521/08灭活疫苗免疫鸡对同源毒株攻毒后有大量的病毒排泄,排毒数为7/8;对异源毒株的攻毒后也有大量排毒,最低为4/8,最高为 7/8;CK/SD/2CZ/08、DK/FJ/560/08和 CK/ZJ/17/08灭活疫苗对同源毒株攻击有相当程度的排毒,排毒数分别为3/10、3/8和4/8;对异源毒株的攻击同样有不同程度的排毒出现,而且最高总排毒数为5/8;CK/HuN/174/08和CK/HuN/33/08灭活疫苗对同源毒株100%保护,免疫鸡均无排毒,对异源毒株也有良好的保护,其中用CK/HuN/33/08、CK/ZJ17/08、 CK/SD/2CZ/08、 GS/JS/106/08、 CK/SC/83/08 和DK/FJ/22/08株攻毒后,CK/HuN/174/08灭活疫苗免疫鸡的排毒数分别为 0/9、1/10、2/10、3/9、2/9、1/9, 用 CK/HuN/174/08、 CK/ZJ17/08、 CK/FJ/521/08、 DK/FJ/560/08、 GS/JS/106/08、 CK/SC/83/08 和DK/FJ/22/08毒株攻毒后,CK/HuN/33/08灭活疫苗免疫鸡的排毒数分别依次为0/8、1/8、1/8、2/7、3/9、2/10和2/9(表4)。上述结果表明,CK/HuN/174/08和CK/HuN/33/08毒株灭活疫苗不仅可以抵御同源毒株的攻击,而且可以有效抵御异源毒株的攻击。
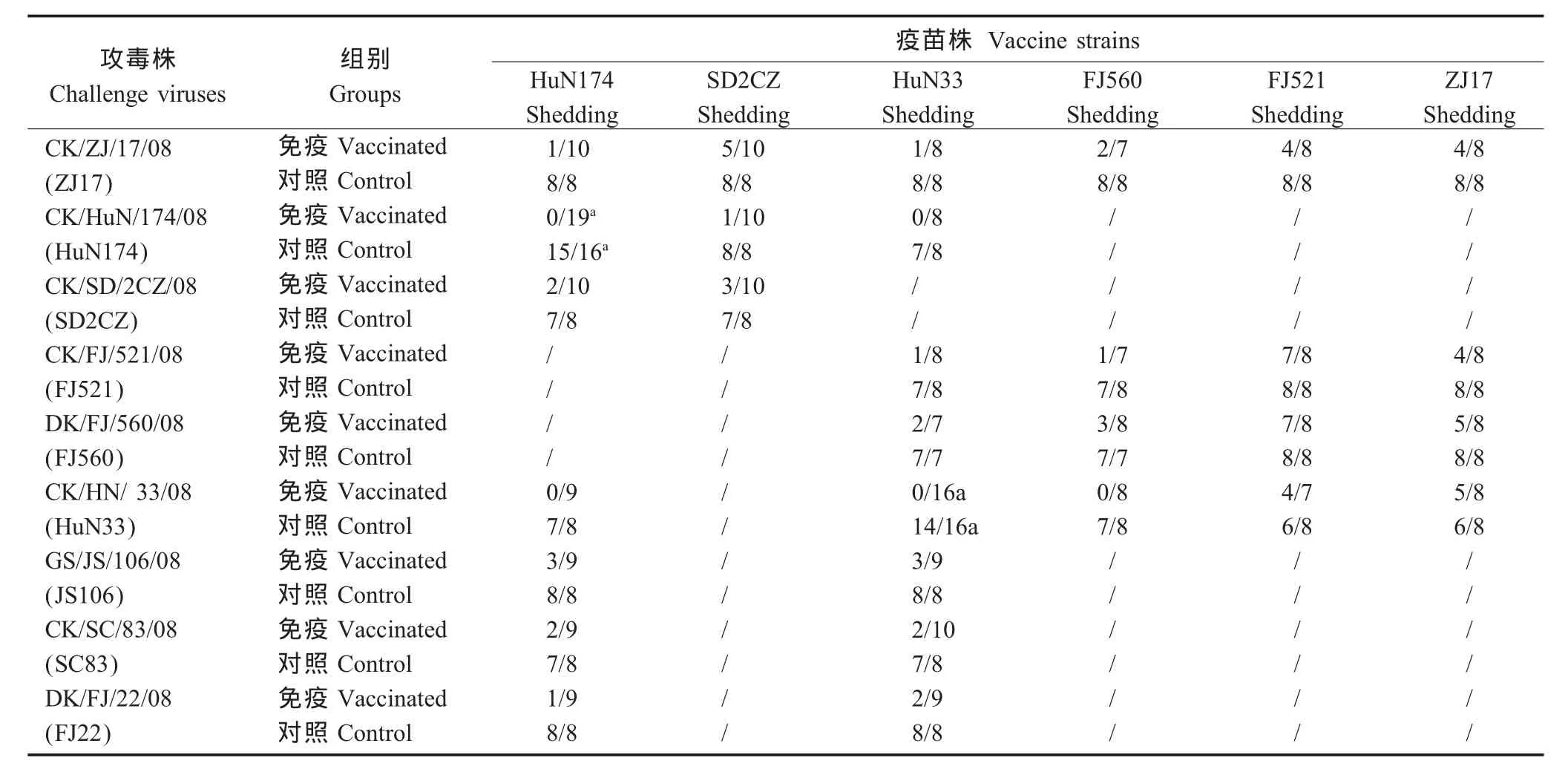
表4 不同毒株疫苗攻毒结果Table 4 The challenge results of different vaccine
3 讨 论
自90年代中期我国分离到第一株H9N2亚型AIV后,该亚型病毒一直在我国家禽中传播蔓延,始终困扰着养禽业的发展。郭元吉等报道H9N2亚型病毒可感染鸡并可以导致鸡发病和死亡,死亡率可以达到10%~20%[8]。但李呈军等研究发现,27株H9N2亚型分离株分别鼻腔感染SPF鸡后,均未出现明显临床症状,也未出现死亡[6]。本研究中6株2008年分离的病毒接种SPF鸡后,也未出现临床发病或死亡现象。究其原因可能是实验室负压隔离器内环境纯净,试验鸡不受其他疫病的干扰,无并发或继发症出现,而感染H9N2亚型AIV的现地家禽常由于环境不良或继发感染细菌可出现不同程度的临床症状。国外有研究报道,与葡萄球菌或嗜血杆菌同时感染时,H9N2亚型AIV对鸡的致病性增加[9],另外,有研究报道我国的H9N2亚型禽流感一直存在变异与进化[10]。因此,H9N2亚型AI对现地生产具有潜在的威胁,应重视对该病的防制。
本研究对分离株的抗原性和HA基因序列分析显示,早期分离株CK/GD/6/97、CK/BJ/8/98、DK/NJ/2/97和CK/HB/31/00的血清与2008年分离株抗原性差异大;2008年分离株中,除CK/HuN174/08和CK/SD/3XZ/08等个别病毒株的抗原性略有差异外,其余病毒株的抗原性比较接近。比较HA基因核苷酸序列,发现2008年8病毒株间的HA基因同源率较高(93.2%~98.6%),与 2001年分离株CK/SH/10/01病毒HA核苷酸序列同源率均较低(91.9%~93.1%)。这些研究结果表明,我国2008年分离的H9N2亚型AIV基因与早期病毒基因同源率较低,抗原性差异大,同一年代不同地域的病毒大多具有较近的亲缘关系,但也有特殊病毒株的存在。
当前我国有多个厂家研制生产的10多株H9N2亚型AI系列灭活疫苗同时应用,为控制我国H9N2亚型AI发挥了重要作用。然而,本研究室在近2年的流行病学调查中发现,H9亚型HI抗体较高的免疫鸡仍然携带H9亚型AIV,由此推断目前应用的AI灭活疫苗中可能存在不能有效阻止免疫鸡排毒的疫苗。本研究对2008年分离的6株H9N2亚型AIV进行免疫效力研究,结果表明,CK/HuN/174/08和CK/HuN/33/08灭活疫苗免疫鸡不仅能够完全抵御同源毒株的攻击,而且同时对异源毒株攻击也产生较好的免疫保护。因此这2株病毒可作为理想的疫苗候选株。
本研究同时表明并非所有H9N2亚型分离株都适用于研制灭活疫苗。本实验中选择的6株病毒灭活疫苗免疫SPF鸡后均能够产生10 log2左右的HI抗体滴度,然而,所选毒株中CK/FJ/521/08灭活疫苗免疫鸡对同源毒株和异源毒株的攻击均有大量排毒,总排毒最高为 7/8;CK/SD/2CZ/08、DK/FJ/560/08和CK/ZJ/17/08毒株灭活疫苗对同源毒株和异源毒株的攻击,均只能提供部分保护。因此,只有对H9N2亚型AIV分离株进行大量的分析和免疫效果评估才能确定其是否适合作为灭活疫苗种毒株。
[1]唐秀英,付朝阳,冯菊艳,等.H9亚型禽流感的流行与防制[J].预防兽医学进展,2000,2(4):1-4.
[2]Chen H L,Subbarao K,Swayne D,et al.Generation and evaluation of a high-growth reassortant H9N2 influenza A virus as a pandemic vaccine candidate[J].Vaccine,2003,21(17-18):1974-1979.
[3]钟功勋,李雁冰,平继辉,等.H9N2亚型禽流感病毒血凝素和神经氨酸酶基因的遗传分析[J].中国预防兽医学报,2007,29(12):946-949.
[4]Peiris M,Yuen K Y,Leung C W,et al.Human infection with influenza H9N2[J].Lancet,1999,354(9182):916-917.
[5]陈伯伦,张泽纪,陈伟斌.禽流感研究:Ⅰ鸡A型流感病毒分离与血清学初步鉴定[J].中国兽医杂志,1994,22(10):3-5.
[6]Li C J,Yu K Z,Tian G B,et al.Evolution of H9N2 influenza viruses from domestic coultry in Mainland China[J].Virology,2005,340:70-83.
[7]王泽霖,刘岩,李建丽,等.H9N2亚型禽流感抗原性变异的研究[J].中国兽医学报.2007,27(3):351-354.
[8]Guo Y J,Krauss S,Senne D A,et al.Characterization of the pathogenicity ofmembersofthenewlyestablished H9N2 influenza virus lineage in Asia[J].Virology,2000,267:279-288.
[9]Kishida N,Sakoda Y,Eto M,et al.Co-infection of StaphylococcusaureusorHaemophilusparagallinarum exacerbates H9N2 influenza A virus infection in chickens[J].Arch Virol,2004,149:2095-2104.
[10]Choi Y K,Ozaki H,Webby R J,et al.Continuing evolution of H9N2 influenza viruses in southeastern China[J].Virology,2004,78(16):8609-8614.
——紫 苏

