牛白血病病毒GP51蛋白在大肠杆菌中表达及胶体金免疫层析试纸条检测方法的建立
宋阳威,张鑫宇,张常印,吴亚力,孙怀昌,唐泰山,张敬友
(1.徐州出入境检验检疫局,江苏徐州221006;2.扬州大学兽医学院,江苏扬州225009;3.江苏出入境检验检疫局,江苏南京210001)
牛白血病(Bovine leukaemia,BL)又称地方流行性牛白血病,是由牛白血病病毒(Bovine leukaemia virus,BLV)引起牛的一种慢性肿瘤性疾病,其特征为淋巴样细胞恶性增生,进行性恶病质和发病后的高死亡率[1]。在我国该病于1974年首次发现于上海,继而在合肥、江苏、陕西、乌鲁木齐和江西等省市发生,而且有逐渐扩大蔓延的趋势,在某些牛群中血清阳性率达30%~50%,已成为牛的重要传染病之一[2]。
BLV的囊膜上有GP51和GP30两种糖蛋白,其中GP51是BLV重要抗原之一,可以刺激机体产生相应的抗体[3],根据该特点,本实验表达并纯化了GP51重组蛋白,应用胶体金免疫层析技术,建立了BLV感染牛快速诊断胶体金免疫层析试纸条检测方法。
1 材料和方法
1.1 实验材料 感染BLV的FLK细胞由连云港出入境检验检疫局惠赠;胶中回收DNA试剂盒购于宝生物工程(大连)有限公司;载体pET32a(+)、大肠杆菌宿主细胞BL21、TG1购于Pharmacia公司;抗BLV标准阳性血清和阴性血清购于Institute POURQUIER;Protino Ni-TED2000 packed columns购于Macherey-Nagel公司;辣根过氧化物酶(HRP)标记的兔抗牛抗体、羊抗牛IgG抗体购于Rocland公司;羊抗牛IgG(Fc)抗体购于NORDIC IMMUNO LOGY公司;牛白血病临床血清样品和牛传染性鼻气管炎、牛病毒性腹泻-粘膜病、赤羽病、蓝舌病和副结核阳性血清由本课题组保存;纳米金溶液购于上海沪正纳米(NANO)技术有限公司。
1.2 gp51基因扩增及重组表达质粒构建
1.2.1 gp51基因的PCR扩增 收获感染BLV的FLK细胞,提取DNA,作为PCR扩增模板。根据Sagata等[4]发表的序列,合成特异性引物,上游引物:5'-GCGAATTCTGGAGATGCTCCCTGTC-3',下游引物:5'-GCCTCGAGTTAACGTCTGACCCGGGT AG-3'。PCR反应参数:94℃ 2 min;94℃ 30 s、55℃ 30 s、72℃ 1 min,30个循环;72℃ 7 min。PCR产物用0.8%琼脂糖凝胶电泳检测。
1.2.2 重组表达质粒构建 将PCR产物进行EcoRⅠ、XhoⅠ双酶切,电泳回收目的片段并与pMD18-T载体连接,转化感受态E.coliTG1,提取质粒,进行酶切和PCR鉴定,将测序验证正确的阳性质粒命名为pMD-gp51。
将pET32a载体和重组质粒pMD-gp51进行EcoRⅠ、XhoⅠ双酶切,分别回收载体片段和目的基因片段。纯化的双酶切纯化产物进行连接,将连接产物转化DH5α感受态大肠杆菌BL21(DE3),提取质粒,进行酶切和PCR鉴定。
1.3 重组质粒的诱导表达及表达产物鉴定、纯化将重组菌接种2×YTA培养基,37℃培养至OD600nm为0.8~1.0时,加入终浓度为1 mmol/L IPTG诱导表达4 h,收集菌体沉淀和上清进行SDS-PAGE电泳;同时设立未诱导重组菌以及诱导的含空载体宿主菌作为对照。按照Protino Ni-TED2000 packed columns说明书,从诱导的重组菌中分离包涵体,用Ni柱纯化重组蛋白,按文献[5]所述方法对重组蛋白进行western blot,分析其免疫反应原性。
1.4 胶体金免疫层析试纸条制备
1.4.1 待标记羊抗牛IgG(Fc)抗体最佳标记用量的确定 将待标记羊抗牛IgG(Fc)抗体作系列稀释,分别取0.05 mL加到0.5 mL胶体金溶液中,另设1管不加抗体的对照管,5 min后加入0.05 mL 10%NaCl溶液,混匀后静置2 h后观察结果,以胶体金颜色不发生改变的最高稀释倍数为准,在此基础上再加20%的抗体即为最佳标记量。参考文献[6]的方法,将羊抗牛IgG(Fc)抗体用胶体金进行标记。
1.4.2 金标羊抗牛IgG(Fc)抗体纯化 将金标羊抗牛IgG(Fc)抗体溶液4℃、2 000 r/min离心10 min,取上清;再进行4℃、12 000 r/min离心30 min,收集紫红色沉淀,用0.005 mol/L硼酸盐缓冲液溶解,4℃保存。
1.4.3 标记物工作浓度的确定 纯化的金标抗体作1∶0、1∶1、1∶2、1∶3、1∶4 不同稀释度,制备试纸条分别检测BLV标准阳性和阴性血清。根据检测线显色深度与显色时间等指标确定金标抗体的工作浓度;固定金标抗体浓度,将标记于检测线上的GP51蛋白作倍比稀释后制备试纸条,分别检测BLV标准阳性和阴性血清。根据检测线显色深度与显色时间等指标确定检测线上GP51蛋白的工作浓度;固定金标抗体和GP51蛋白的工作浓度,将加于质控线上的羊抗牛IgG抗体作倍比稀释后制备试纸条分别检测同一份标准阳性血清,根据检测线与质控线的显色情况确定羊抗牛IgG抗体工作浓度。
1.4.4 胶体金免疫层析试纸条的制备 将玻璃纤维制成的样品垫、胶体金垫、包被有检测(T)线和质控(C)线的硝酸纤维素膜及吸水滤纸制成的吸水垫按照示意图1装配,干燥密封,室温保存。
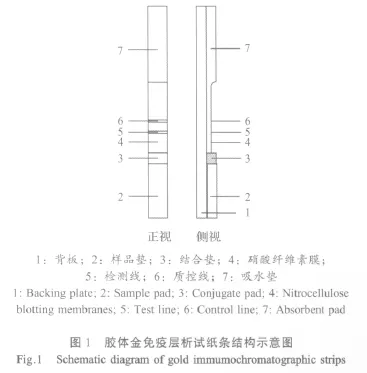
1.4.5 试纸条检测方法 将待检牛血清作50倍稀释,取15 μL加在试纸条的加样区,5 min~10 min后观察结果。
1.5 评价试验
1.5.1 特异性和敏感性测试 用试纸条检测牛传染性鼻气管炎、牛病毒性腹泻-粘膜病、赤羽病、蓝舌病和副结核等阳性血清,观察其特异性。将BLV标准阳性血清作 1∶10、1∶20、1∶30、1∶40、1∶50、1∶60、1∶70、1∶80、1∶90、1∶100 倍稀释,分别用试纸条检测并观察其敏感性。
1.5.2 重复性和稳定性试验 用同批和不同批次的试纸条分别检测BLV标准阴性血清和阳性血清,重复5次,检测其重复性。试纸条分别存放于室温和4℃,每隔2个月取出检测标准阳性血清,连续4次,检测其稳定性。
1.5.3 现地样本检测 用组装的试纸条对22份已知牛血清样品(该样品已用美国IDEXX公司ELISA试剂盒进行了检测,其中9份检测为阳性,13份检测为阴性)进行检测,并计算试纸条与ELISA检测结果的符合率。
2 结 果
2.1 gp51基因的扩增及重组质粒鉴定 通过PCR反应,从感染BLV的FLK细胞基因组中扩增出约为820 bp的条带(图2),与预期大小相符。回收该DNA片段,测序分析。测序结果与GenBank中登录的序列(K02120)进行比较,有3处发生点突变:100位T→C,348位C→T,510位T→C,但在氨基酸水平上无任何变化。将该片段连接到pET32a(+)中重组表达质粒用PCR和EcoRⅠ、XhoⅠ双酶切进行鉴定,结果表明获得阳性重组表达质粒,命名为pET-gp51。
2.2 表达产物的SDS-PAGE和western blot鉴定
IPTG诱导含有pET-gp51质粒的重组大肠杆菌,SDS-PAGE的分析结果显示在42 ku大小处出现一有别于对照样品的蛋白条带(图2),Western blot显示,在42 ku处有1条清晰的蛋白印迹带,与SDS-PAGE的分析结果一致(图2)。

2.3 羊抗牛IgG(Fc)抗体最佳标记用量及标记物工作浓度的确定 胶体金标记羊抗牛IgG(Fc)抗体最适稳定量的测定结果显示,稳定胶体金的最低抗体质量为5 μg/mL,最终确定抗体最佳标记浓度为6 μg/mL。点样于硝酸纤维素膜上的GP51和羊抗牛IgG抗体最佳浓度分别为 120 μg/mL 和 200 μg/mL。
2.4 试纸条结果判定 T线和C线均出现红色,结果为阳性;C线显红色,T线不显色,结果为阴性;C线不出现红色,结果无效(图3)。

2.5 特异性和敏感性测试 通过对牛传染性鼻气管炎、牛病毒性腹泻-粘膜病、赤羽病、蓝舌病和副结核等阳性血清进行检测,结果无一例阳性出现,说明试纸条特异性良好。对作系列稀释的标准阳性血清分别进行检测,结果1∶70倍稀释的血清仍呈阳性,说明试纸条的敏感性较好。
2.6 重复性和稳定性试验 不同批次的试纸条进行批内和批间重复性试验,符合率为100%。试纸条分别在室温和4℃下保存6个月,其特异性和灵敏性均没有变化,8个月后灵敏度均下降,表明试纸条重复性较好且具有一定的稳定性。
2.7 临床样品检测及符合率 试纸条对22份已知牛血清进行了检测,其中ELISA检测阳性的9份牛血清中,有8份试纸条检测为阳性,阳性符合率为88.89%(8/9);ELISA检测为阴性的13份血清样品中,11份试纸条检测为阴性,阴性符合率为84.62%(11/13)。
3 讨 论
目前,还没有有效防治该病的疫苗或方法,对感染的牛只能实行隔离或淘汰[7],因而早期诊断是十分重要的。BLV检测主要有电镜检查、合胞体感染试验和PCR,但这些试验费时,并且需特殊的仪器设备,因此目前应用得较少。常用血清学方法也存在灵敏度低,操作要求高或价格昂贵等问题,不适用于基层和大规模检测。
由于胶体金标记蛋白质是一物理结合过程,结合牢固,试剂非常稳定,不受温度等外界因素影响,可在实验室,甚至野外进行检测[8]。胶体金对比ELISA大大简化了操作,更适合于野外临床的现场应用[9],也不会污染环境[10]。因为“免疫浓缩”效应存在,免疫胶体金实验所需试剂和样本量都非常少,样本量可低至1 μL~2 μL[11]。因此该技术有良好的应用前景。
本研究从感染了BLV的FLK细胞中扩增出GP51基因,测序后与Sagata等发表的序列进行比较,有3处发生了沉默点突变。利用表达的GP51蛋白,建立间接胶体金免疫层析检测方法,组装出检测BLV GP51抗体的试纸条,通过检测抗体的有无来判定被检牛是否感染BLV。经对部分临床样本进行检测,结果与进口试剂盒检测符合率在86.8%左右,分析原因,一方面可能与本研究所检测的样品较少有关,另外胶体金免疫技术目前还不是十分成熟,其灵敏度及稳定性等还有待进一步提高。但该方法具有操作极其简单,无需特殊仪器设备,更适宜基层检测机构进行初筛诊断和现场检测。相信随着相关技术的不断发展与完善,本研究建立的快速诊断胶体金免疫层析试纸条检测方法将具有良好的应用前景。
[1]龙塔,潘耀谦.流行性牛白血病的病原及传播途径研究进展[J].动物医学进展,2005,25(6):65-68.
[2]龚海燕,彭远义.牛白血病病毒感染的免疫学研究进展[J].畜牧与兽医,2002,34(6):41-43.
[3]Bicka L,Kuzmak J,Kozaczynska B,et a1.Expression of bovine leukemia virus protein p24 in Escherichia coli and its use in the immunoblotting assay[J].Acta Biochimica Polonica,2001,48(1):227-232.
[4]Sagata N,Yasunaga T,Tsuzuku Kawamura J,et al.Complete nucleotide sequence of the genome of bovine leukemia virus:its evolutionary relationship to other retroviruses[J].Proc Natl Acad Sci,1985,82(3):677-681.
[5]奥斯伯F M,布伦特R,金斯顿R E,等.精编分子生物学实验指南[M].金由辛等译.北京:科学出版社,2008.
[6]唐景峰,李晓艳,王兴龙,等.布病胶体金免疫层析检测方法的建立[J].中国生物制品学杂志,2007,20(2):119-128.
[7]Acaite J,Tamosiunas V,Lukauskas K,et al.The eradication experience of enzootic bovine leukosis from Lithuania[J].Prev Vet Med,2007,82:83-89.
[8]马红艳,李强,韩雪松,等.胶体金诊断试剂盒中层析膜材料性能的分析[J].膜科学与技术,2002,22(6):14-19.
[9]蒋韬,梁仲,陈涓,等.O型口蹄疫病毒免疫层析试纸条检测方法的建立[J].畜牧兽医学报,2008,39(1):60-65.
[10]杨素,陈博文,沙才华,等.赤羽病胶体金免疫层析试纸条的研制[J].中国畜牧兽医,2009,36(3):42-44.
[11]许保疆,郭成留.免疫层析快速诊断试纸条的制备及在动物疫病诊断上的应用[J].中国畜牧兽医,2009,36(3):48-51.

