Asia 1型口蹄疫病毒VP1基因的表达鉴定及其多抗制备
朱远茂,任宪刚,史鸿飞,高欲燃,于 作,冯军科,相文华*,薛 飞*
(1.东北农业大学动物医学学院,黑龙江哈尔滨150030;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/大动物传染病研究室,黑龙江哈尔滨150001;3.哈药集团生物疫苗有限公司,黑龙江哈尔滨150030)
口蹄疫(Foot-and-mouth disease,FMD)是由口蹄疫病毒(FMDV)感染偶蹄动物所引起的急性、接触性传染病[1]。FMDV有7个血清型,即A、O、C、亚洲Ⅰ型(Asia 1)和南非Ⅰ(SAT1)、SAT2、SAT3[2]。Asia 1 FMDV于1954年分离于巴基斯坦,我国于1958年在云南省首次发现Asia 1 FMD。给我国的养殖业造成了巨大的损失[3]。FMDV结构蛋白VP1是主要免疫原性蛋白,能够诱导动物机体产生较高水平的抗体从而保护机体免受FMDV攻击[4]。人工合成的Asia 1型FMDV第133位~163位的多肽能够刺激豚鼠产生高水平的中和抗体[5]。在FMDV基因工程苗的研制、诊断方法的建立等领域,VP1蛋白是被关注的热点[6]。
本研究利用原核表达系统进行Asia 1 FMDV VP1结构蛋白的表达,并制备多克隆抗体,对于FMDV Asia 1的VP1蛋白抗原性、免疫原性及其蛋白功能研究具有重要意义。
1 材料和方法
1.1 菌株、质粒及血清 含Asia 1 VP1基因的质粒pUC57-Asia VP1由本实验室构建保存(Asia 1 VP1基因由上海生工生物工程技术服务有限公司合成);原核表达载体 pET-30a(+)、大肠杆菌 DH5α、BL21(DE3)、牛FMDV阳性血清和阴性血清、BHK细胞、FMDV Asia 1 JS/China/2005为本实验室保存;辣根过氧化物酶(HRP)标记的山羊抗兔IgG、兔抗牛IgG均为Sigma公司产品。
1.2 主要试剂 ExTaq酶、DNA Marker DL2000、IPTG为宝生物工程(大连)有限公司产品;T4 DNA连接酶、BamHⅠ、HindⅢ为Promega产品;DNA胶回收试剂盒为上海华舜公司产品;蛋白纯化试剂Ni-NTA Purification System为Invitrogen公司产品。
1.3 实验动物 2 kg~3 kg新西兰白兔由中国农业科学院哈尔滨兽医研究所实验动物中心提供。
1.4 VP1基因的扩增及回收 PCR引物由上海生工生物工程技术服务有限公司合成,上游引物vp1F:5'-ATTAGGATCCTCAGCGGACCCAGTGACA ACCAC-3';下游引物vp1R: 5'-CGCCAAGCTTATT ACAGTACCTGTTTCTCAGGTG-3',在上下游引物中分别引入BamHⅠ、HindⅢ位点。PCR扩增条件为:95℃3 min;94℃45 s、60℃45 s、72℃1 min,30个循环后72℃延伸10 min。扩增产物经琼脂糖凝胶电泳检测、回收。
1.5 VP1基因的克隆与鉴定 将回收的PCR产物与pET-30a(+)载体分别用BamHⅠ、HindⅢ进行双酶切后回收,T4 DNA连接、转化感受态细胞DH5α。提取重组质粒(pET-VP1),用双酶切鉴定。阳性的克隆进行测序做进一步鉴定。
1.6 重组VP1蛋白(rVP1)的表达 将pET-VP1转化感受态细胞BL21(DE3),进行增菌培养,以终浓度为1.0 mmol/L的IPTG进行诱导,同时设立未诱导对照,诱导6 h后,收集菌体。以SDS-PAGE检测。同时用超声波破碎菌体,离心后分别收集上清及沉淀表达的rVP1可溶性检测。
1.7 表达产物的纯化 将诱导表达菌裂解处理后按文献[7]的方法,对包涵体形式表达的重组蛋白进行纯化。以分光光度计测定蛋白含量。
1.8 表达产物的鉴定
1.8.1 表达产物的western blot分析 将纯化后的rVP1蛋白进行SDS-PAGE电泳,转移至硝酸纤维素膜,以1%明胶37℃封闭1 h,分别以FMD阳、阴性牛血清(1∶100稀释)为一抗,37℃孵育1 h,以HRP标记的兔抗牛IgG(1∶5 000稀释)为二抗,37℃孵育1 h,用4-氯-1萘酚显色。
1.8.2 表达产物间接ELISA检测 纯化的rVP1以1 μg/孔包被酶标板,4℃过夜,用1%明胶37℃封闭1 h,分别以8份FMD阴性及阳性血清作为一抗(与大肠杆菌作用后1∶100稀释),37℃作用 1 h,PBST洗涤后加入HRP标记的兔抗牛IgG(1∶5 000稀释),37℃作用1 h,PBST洗涤后,加入四甲基联苯胺(TMB)37℃避光显色 5 min,加 50 μL 2 mol/L硫酸终止,用酶标仪测定OD630nm值。
1.9 兔抗VP1蛋白多克隆抗体的制备 取纯化的rVP1蛋白4 mg,与等体积的弗氏完全佐剂(Sigma)进行乳化后于新西兰白兔双后足掌皮下注射进行第一次免疫;每只足掌2 mg/0.5 mL,2周后于双侧后肢腘淋巴结内各注射2 mg/0.5 mL上述抗原进行第二次免疫;2周后于背部皮下多点注射4 mg/1 mL经弗氏不完全佐剂进行乳化后的抗原进行第3次免疫;2周后于耳静脉注射4 mg/mL的不加佐剂的抗原0.5 mL进行加强免疫。1周后耳静脉采血测定效价,效价达到要求后心脏采血分离血清。
1.10 兔抗VP1蛋白抗体效价的测定
1.1 0.1 间接ELISA效价的测定 以纯化的rVP1蛋白包被酶标板1 μg/孔,阴性兔血清和抗VP1兔血清进行1∶20~1∶81 920倍比稀释,以HRP标记的山羊抗鼠IgG为二抗(1∶5 000),按1.8.2的程序进行间接ELISA试验,以免疫血清与阴性血清OD630nm值的比值大于2.5判定为阳性。
1.1 0.2 中和抗体效价的测定 采用BHK细胞,以兔抗VP1血清对Asia 1 FMDV进行中和试验,每个血清稀释度重复4孔,以能中和2孔的血清稀释度为中和效价。
2 结 果
2.1 VP1基因的扩增及表达质粒的构建和鉴定PCR扩增产物经1.0%琼脂糖凝胶电泳显示约600 bp的扩增条带,与预期639 bp相符。重组表达质粒经限制性内切酶BamHⅠ、HindⅢ消化后可见约600 bp及5 200 bp目的片段和载体片段。
2.2 VP1基因的表达与纯化 重组菌用IPTG诱导后,经SDS-PAGE电泳证明VP1基因获得了表达,表达产物大小约为31.6 ku(图1)。将重组菌超声波破碎后的上清和沉淀分别做SDS-PAGE电泳,结果显示rVP1蛋白以包涵体的形式表达。包涵体经洗涤后用含8 M尿素的PBS缓冲液溶解后获得初步纯化的rVP1,再经Ni-NTA Purification system纯化后,稀释并透析复性后得到纯化的rVP1蛋白。
2.3 表达产物的western blot分析 将纯化后的rVP1进行SDS-PAGE,电转移至硝酸纤维素膜上,分别以牛FMD阳、阴性血清为一抗,兔抗牛IgG为二抗,结果显示rVP1蛋白与FMD阳性血清反应,可在31.6 ku处出现特异性免疫印迹条带,与FMD阴性血清不反应(图2)。
2.4 重组VP1的间接ELISA检测 以纯化的rVP1作为包被抗原,对经进口ELISA试剂盒(惠赠)鉴定的FMD Asia 1抗体阴、阳性牛血清各8份进行间接ELISA检测。结果显示8份阳性血清的OD630nm值均在1.0以上,8份阴性血清的OD630nm值都在0.2以下,每个样品的OD630nm值为两个检测孔的平均值,与进口ELISA试剂盒检测结果相符(表1)。
2.5 兔抗VP1蛋白多克隆抗体效价的测定 纯化的蛋白经过4次免疫新西兰白兔后,心脏采血分离血清。对高免血清进行间接ELISA检测和病毒中和试验测定其效价。结果表明ELISA效价可达10×211,即 1∶20 480(图 3);病毒中和试验效价可达 1∶64。

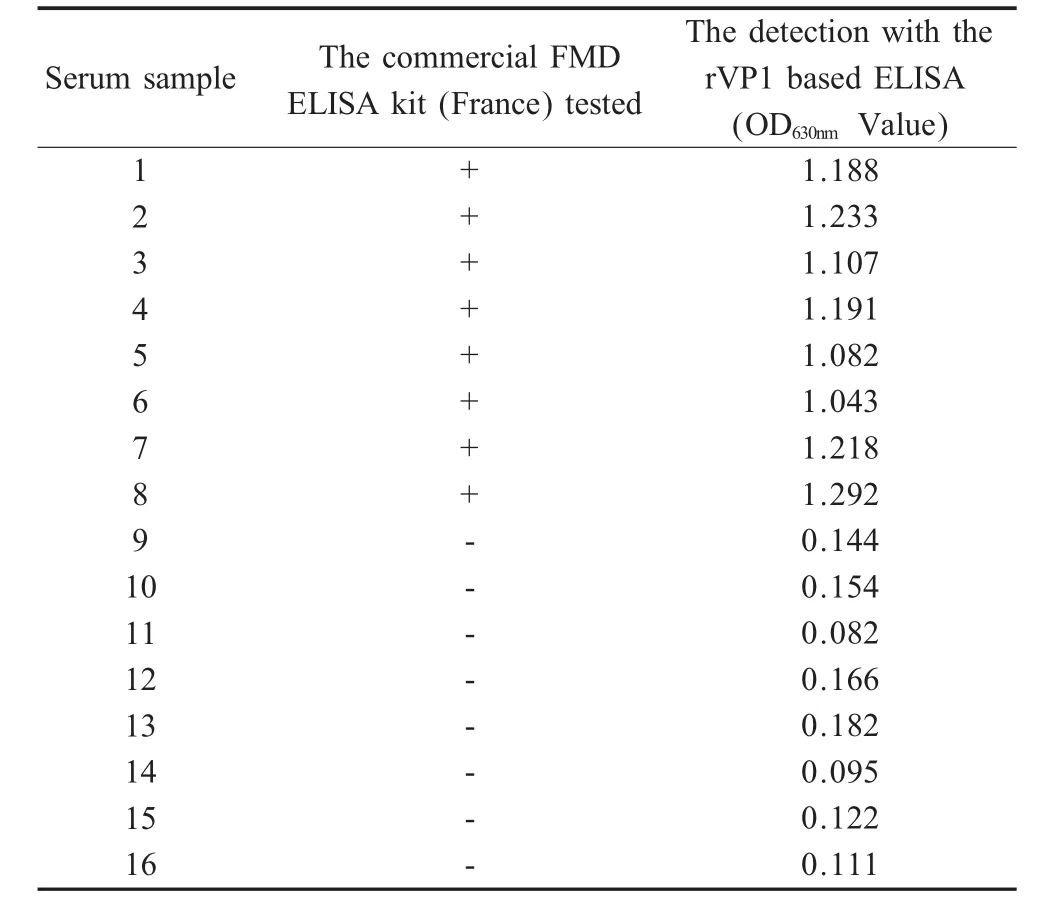
表1 rVP1的间接ELISA与进口检测试剂盒的比较Table 1 Comparison of the indirect rVP1 based ELISA with commercial FMD ELISA kit

3 讨 论
VP1基因在FMDV的研究中具有重要的地位。Suryanarayana等将FMDV VP1的C端部分在大肠杆菌中进行表达,证明表达蛋白经纯化后用免疫沉淀反应法检测到特异性抗体产生[8]。近年来国内许多研究者对Asia 1 FMDV开展了研究,尤其对VP1基因的研究比较多,包括基因测序和分析,单克隆抗体的制备,表位鉴定,在原核、真核和毕赤酵母中进行表达等[9-10]。张中旺等制备了FMDV Asia 1/HeB P1衣壳蛋白前体的抗血清,仅用表达蛋白测定了抗血清效价,但未进行中和活性的检测[11],在家兔中制备VP1多克隆抗体还未见报道。
本研究利用原核表达了FMDV Asia 1 IND 4/2004株的VP1全基因。表达产物分子量约为31.6 ku,以包涵体的形式存在。我们曾试图通过调整诱导剂浓度、诱导时间和诱导温度以求获得可溶性表达,但结果仍然是以包涵体的形式表达。这可能与蛋白质本身的氨基酸组成有关,仅仅改变表达菌的培养条件并不能从根本上改变表达形式。Western blot和间接ELISA分析结果显示rVP1能够与FMD阳性血清发生特异性反应,具有良好的抗原性。本研究以纯化的包涵体蛋白VP1免疫新西兰白兔制备了多克隆抗体,该抗体ELISA效价达到1∶20 480,病毒中和试验抗体效价为1∶64,这是国内首次制备特异性的兔抗Asia 1 FMDV VP1基因的多抗,而且能中和我国目前使用的疫苗毒株FMDV Asia 1 JS/China/2005,显示出良好的中和活性。
因此,本研究获得的rVP1可用于开发检测Asia 1 FMDV抗体的诊断试剂,所制备的多克隆抗体为进一步研究VP1的结构、功能以及抗原表位的鉴定奠定了基础。
[1]Johan B,Péter G,Alia Y,et al.Microarray-based molecular detection of foot-and-mouth disease,vesicular stomatitis and seine vesicular disease viruses,using padlock probes[J].J Virol Meth,2007,143(2):200-206.
[2]Domingo E,Escarmis C,Baronowski E,et al.Evolution of foot-and-mouth disease virus[J].Virus Res,2003,91(1):47-63.
[3]Guo H,Liu X,Liu Z,et al.Recent outbreaks of foot-and-mouth disease type Asia 1 in China[J].J Vet Med B Infect Dis Vet Public Health,2006,53(S1):29-33.
[4]Kleid D G,Yansura D,Small B,et al.Cloned viral protein vaccine for foot-and-mouth disease:responses in cattle and swine[J].Science,1981,214:1125-1129.
[5]Wang J L,Liu M Q,Han J,et al.A peptide of foot-and-mouth disease virus serotype Asia 1 generating a neutralizing antibody response,and an immunostimulatory peptide[J].Vet Microbiol,2007,125:224-231.
[6]卢曾军,刘在新.口蹄疫病毒研究概况 [J].中国兽医科技,2003,33(2):69-74.
[7]李娇,薛飞,朱远茂,等.牛病毒性腹泻病毒E2蛋白的截短表达与鉴定 [J].中国预防兽医学报,2008,30(3):200-205.
[8]Suryanarayana V S,Viswanathan S,Ratish G,et al.E.coli expressed protein as diagnostic reagents for typing of foot-and-mouth disease virus[J].Arch Virol,1999,144:1701-1712.
[9]Wang G H,Du J Z,Cong G Z,et al.Establishment of indirect ELISA diagnose based on the VP1 structuralprotein of foot-and-mouth disease virus(FMDV)in pigs[J].生物工程学报,2007,23(5):961-966.
[10]邢继兰,潘洁,陈波,等.口蹄疫病毒结构蛋白基因VP1的表达与应用研究[J].中国预防兽医学报,2007,29(4):299-302.
[11]张中旺,张永光,王永录,等.Asia1型口蹄疫病毒分离株P1基因的原核表达及其多克隆抗体的制备.中国人兽共患病学报,2009,25(10):973-976.

