巨噬细胞在创面愈合中的作用研究进展
郭敏 (综述),徐祥,黄宏 (审校)
(1.重庆医科大学第二附属医院创伤烧伤科,重庆 400010;2.第三军医大学第三附属医院野战外科研究所,创伤、烧伤与复合伤国家重点实验室,重庆 400042)
早在1975年,Leibovich和Ross在实验中就发现,以巨噬细胞抗血清和氢化可的松去去除中性粒细胞后,伤口愈合过程却无明显影响。1980年,Leibovich等人又将巨噬细胞激除伤口局部的巨噬细胞后,伤口纤维形成和血管生成受阻,愈合明显减慢。而以同样的方法活剂葡聚糖加入伤口局部,发现局部的巨噬细胞明显增多,并且血管生成提前,胶原合成增加,上皮形成加快,伤口牵张强度增加。近几年的实验研究有相似结果,在大鼠皮肤伤局部直接加入活化巨噬细胞的培养上清液,可导致伤口的胶原蛋白合成增加,伤口抗张强度增强。在老年个体,常因免疫功能低下、巨噬细胞功能不良导致创伤愈合延迟。由此可见,巨噬细胞在组织修复中起着非常重要的作用。
巨噬细胞是创伤愈合和组织修复过程的“总指挥”(orchestra leader),对整个愈合过程具有不可替代的指导作用[1-3]。它通过吞噬作用、分泌一些酶以及产生活性基团如:NO、O2+和H2O2等,继续清除损伤细胞与变性坏死组织,杀灭细菌,起到清创作用;更主要它具有强大的分泌功能,合成释放多种细胞因子和生长因子等生物活性物质,直接或间接地调控创面愈合过程,它是创伤愈合过程中主要细胞因子和生长因子的重要来源。巨噬细胞分泌的细胞因子作用广泛而且复杂,其中不但有促进愈合的细胞因子,也有抑制愈合的细胞因子。它促进创面愈合的生物学行为不仅发生在创伤愈合过程的炎症、增殖阶段,还参与创伤愈合的塑形期,并且与病理性瘢痕的形成也有显著的相关性。它对胶原具有双向的调节作用,既可刺激胶原纤维增生,又可促使胶原降解。可见,巨噬细胞调控创面愈合的作用贯穿于愈合过程的始末,因此,巨噬细胞在创面愈合中承担了重要角色。见图1。
1 巨噬细胞的浸润与活化
正常皮肤组织中巨噬细胞甚少,仅约1~2个/mm2,而在创面修复期则可多达正常的5倍。正常皮肤组织中的巨噬细胞和血管中的单核细胞处于未活化状态。而未活化巨噬细胞的吞噬功能和分泌细胞因子的能力很有限,巨噬细胞受到某些物质刺激后即可被活化。巨噬细胞一旦活化后不仅其吞噬功能显著增强,同时,细胞代谢和分泌能力也显著增强,合成分泌一系列生长因子和细胞因子参与调节损伤组织中血管再生、成纤维细胞功能和细胞外基质的生成。
损伤后,继血小板、中性粒细胞(伤后数分钟-24小时)之后,血液中的单核细胞在多种炎症介质趋化下很快到达创面,并转化为巨噬细胞和部分树突状细胞,发挥抗原提呈作用,激活获得性免疫。通常巨噬细胞在伤后第1天开始增加,随后数量逐渐增多,伤后2~4.
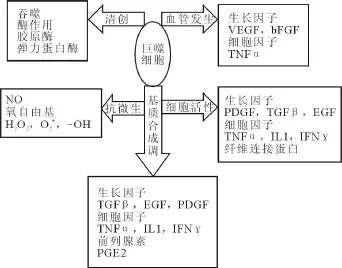
图1 巨噬细胞在组织修复中的主要作用Fig.1 The principal effects on tissue repair of macrophage
天数量最多,伤后第3天基本完全取代PMN成为创面最主要的免疫细胞。伤后第7天达到肉芽组织中细胞总数的80%以上,成为创面中数量最多、停留时间最长的一种炎症细胞。巨噬细胞不仅在促进创伤愈合由炎症期向增生期转化起着重要作用,而且也是创伤愈合由炎症期向增生期转化的重要标志[4]。
在炎症早期,外周血循环单核细胞在趋化因子的作用下募集至创面,炎症早期由血小板合成分泌的如血小板源性生长因子(PDGF)和转化生长因子(TGF-β)对巨噬细胞产生中度的趋化效应[5],创面早期浸润活化的巨噬细胞产生的单核细胞趋化蛋白-1(MCP-1)[1,6]、巨噬细胞炎症蛋白-1、2(macrophage inflammatory protein-1、2)TNF-α和 IL-1等都是巨噬细胞强有力的趋化因子。继而在血小板和内皮细胞等释放的炎症介质如白细胞三烯、补体C5a、以及细菌产物如 LPS也有促进单核细胞和PMN渗出的作用,而一些非炎症介质如结缔组织生长因子FGF、PDGF以及血凝副产物如血纤维蛋白肽、降解的胶原碎片、弹力蛋白、激活的凝血酶等都具有刺激PMN和单核细胞渗出至创面的作用。
创面巨噬细胞的活化是在多种细胞因子的作用下而完成的。巨噬细胞的早期活化因子主要来自血小板,血小板释放TGF-β、PDGF和血小板活化因子(PAF)均能激活巨噬细胞,而血小板分泌的这些细胞因子在创面中约12~14小时之内就被灭活;此外,损伤的内皮细胞也能分泌多种能刺激活化巨噬细胞的细胞因子,如TNF-α;活化的巨噬细胞本身也分泌 IL-1、IL-2、TNF-α、PDGF 和 T 淋巴细胞分泌IFN-γ等细胞因子也能激活巨噬细胞;细菌产物也是巨噬细胞活化的重要刺激物[7];早期激活的巨噬细胞还能以旁分泌的形式进一步激活其它巨噬细胞。
活化的巨噬细胞是执行不同免疫功能的复杂细胞群体。目前至少发现了三种生物学功能不同的活化的巨噬细胞[7],它们执行着不同的免疫功能。最早发现的是依赖于IFN-γ诱导的经典活化的巨噬细胞(classically activated macrophage),IFN-γ和TNF-α或TNF诱导剂是经典活化必须的两个细胞因子。在有LPS存在时能合成分泌NO.这些经典活化巨噬细胞表现为表面分子MHCⅡ和B27(CD86)的上调和提高了抗原呈递和杀伤细胞内病原体的能力。这些细胞迁移到炎症部位,接触病原体并降解它们。经典活化的巨噬细胞具有重要的分泌功能,可以分泌多种促炎细胞因子IL-1、IL-6和TNF-α等,还可以分泌IL-12和趋化因子CXCL9(Mig)和CXCL10(IP-10)。经典活化的巨噬细胞刺激T细胞产生IFN-γ,参与Th1型免疫应答。
其次,是替代性活化的巨噬细胞(alternatively activated macrophage),这类巨噬细胞受IL-4、IL-13、糖皮质激素等的作用活化,甘露糖受体和清道夫受体上调,而产生NO的能力下降,因此杀伤细胞内病原体的能力下降。这类巨噬细胞主要参与调节创伤愈合、血管生成和细胞外基质(ECM)沉积的功能。提示它们的功能是参与组织修复,而并非对病原体产生吞噬与杀伤效应。
第三类活化巨噬细胞是Ⅱ型活化的巨噬细胞(Ⅱtype-activated macrophage)。这类巨噬细胞是在IgG免疫复合物存在的情况下,由诱导巨噬细胞经典活化的刺激分子来诱导活化的巨噬细胞。该类细胞活化也需要两个信号,第一个信号是Fcγ Rs的配体,第二个信号是TLRs的信号和通过CD40或CD44的信号。能合成分泌大量的IL-10是其最大的特点,提示它们有重要的抗炎作用。Ⅱ型活化的巨噬细胞还能够诱导Th2型免疫应答。与经典活化巨噬细胞相同,Ⅱ型活化的巨噬细胞也能分泌IL-1、IL-6、IL-10 、IL-12 和 TNF-α等细胞因子。
此外,按照创伤后损伤部位募集的巨噬细胞的功能将其分为3类[8]:杀伤巨噬细胞、炎性巨噬细胞和修复巨噬细胞。杀伤巨噬细胞主要行使吞噬异物、清除坏死组织碎片的功能;炎性巨噬细胞产生PDGF 、TGF-β、bFGF,趋化内皮细胞和成纤维细胞迁移至创面,并刺激其增殖;修复巨噬细胞分泌PDGF和胰岛素样生长因子,参与创面细胞外基质改造和重塑。炎性巨噬细胞和修复巨噬细胞之间的平衡是修复成功的关键,它们是参与组织修复重要的细胞群体。
创面组织中的巨噬细胞活化后,分泌大量细胞因子通过自分泌和旁分泌的形式进而对巨噬细胞的浸润与活化进行放大,确保了机体在创伤后能迅速调动大量巨噬细胞参与创面修复。
2 巨噬细胞对创伤愈合过程的调控
巨噬细胞一方面作为炎症阶段主要的吞噬细胞,负责清除损伤细胞和病原体等;另一方面释放多种生物活性物质调控创伤愈合过程。活化后的巨噬细胞能分泌多种细胞因子参与创面修复。通过合成分泌 PDGF 、EGF 、TGF-α、TGF-β、IL-1、肝素结合表皮生长因子(HB-EGF)、巨噬细胞衍生生长因子(MDGF)、野生型 P53活化片段(WAF)等,趋化修复细胞、成纤维细胞和内皮细胞,刺激成纤维细胞的有丝分裂和新生血管的形成,以促进肉芽组织形成。实验表明,阻断伤口巨噬细胞的浸润、活化会严重阻碍组织的修复。Shirafuji等[9]发现,巨噬细胞浸润受阻是手术后病人伤口愈合受阻的一个重要原因。
2.1 巨噬细胞的吞噬和杀菌作用
炎症是机体抵御外来感染、创伤等的保护反应,强烈炎症反应本身可造成组织过度损伤,从而影响创面的修复过程。巨噬细胞在修复炎症期的突出作用表现在巨噬细胞能识别并清除坏死组织、细胞碎片和病原体,清理创面,为修复作准备。而另一方面,通过清除病原体和坏死组织巨噬细胞可以限制炎症反应的强度。病原体和异物刺激的持续存在,将导致巨噬细胞的过度激活,合成分泌促炎细胞因子增加,从而加重组织损伤。因此,可以说炎症反应是双刃剑,既有保护作用,又有破坏效应,而作为主要炎症效应细胞的巨噬细胞数量和激活程度决定了炎症反应的强度。
在创面清创过程中,巨噬细胞在接触到细菌、异物、衰亡的细胞时,即伸出伪足将其粘附和包围,并吞入胞质形成吞噬小体和吞饮泡。吞噬小体与初级溶酶体接触、融合,成为次级溶酶体,溶酶体酶消化分解异物,残留的异物则形成残余体。此外,巨噬细胞吞噬作用可通过Fc受体、C3受体介导促进其更强的免疫吞噬功能,吞噬坏死组织、崩解的中性粒细胞和细菌崩解产物。巨噬细胞不表达髓过氧化物酶,但它通过产生NO继续杀灭创面细菌。激活巨噬细胞一氧化氮合成酶(iNOS)产生 NO,通过TNF-α和IL-1与过氧化物氧自由基相互作用产生毒性更强的过氧化亚硝酸盐和羟基;激活的巨噬细胞合成和释放的多种活性因子如IL-1、淋巴细胞活化因子等发挥其细胞毒性作用,杀伤靶细胞。
2.2 巨噬细胞在组织修复中血管形成中的重要调节作用
血管生成是组织修复的前提和基础,是创伤修复过程中的重要环节。修复创面的肉芽组织中含有大量的新生血管。新生血管的形成主要是由内皮细胞迁移和分裂增殖而完成。激活的巨噬细胞分泌大量的促血管生成因子,主要有成纤维细胞生长因子(FGFs)、TGF-β、血管内皮生长因子(VEGFs)、血小板源生长因子(PDGFs)、转化生长因子α(TGF-α)、肿瘤坏死因子α(TNF-α)、胰岛素样生长因子(IGF-l)、IL-10、IL-8和 IL-6等。例如 VEGF、IL-6和 IL-8通过趋化、募集内皮细胞到达创面,而VEGF、FGF、TGF-α和TGF-β等细胞因子通过促进内皮细胞增殖、分化而促进新生血管形成。其中VEGF和bFGF是巨噬细胞分泌的早期最主要的血管生长刺激因子,对血管生成有强烈的促进作用。bFGF在创伤修复早期(24小时内)升高,与 bFGF不同,VEGF的高水平不出现在创伤早期,它通常在创伤后7天才达到高峰,因此,VEGF是持续诱导血管生长的主要刺激因子,它与bFGF均参与血管EC迁移、增殖和管样结构的形成。早有实验证明,从伤口分离出的巨噬细胞注入兔角膜,能明显诱导血管形成。
浸润在创伤组织中的巨噬细胞还可以分泌cathelicidin多肽,这种多肽达到一定浓度后,直接作用于血管内皮细胞,促进新生血管形成[10]。
此外,巨噬细胞除分泌细胞因子影响血管内皮的生成外,还通过影响细胞外基质(ECM)的生成而调节血管的形成。因内皮趋化、迁移需要血管内皮基膜和局部基质的降解,巨噬细胞可通过释放金属蛋白酶(MMPs,如胶原酶)、弹性蛋白酶和丝氨酸蛋白酶等降解基质。而另一方面,通过合成部分基质分子如纤维连接蛋白(fibronectin,Fn)等改变基质的组成,或通过释放单核细胞因子等作用来调节基质成分,有利于血管形成。在血管生成早期,丝氨酸蛋白酶如组织型(t-PA)和尿激酶型(和u-PA)纤溶酶原激活物激活的纤溶酶,与MMPs共同作用,除了水解基底膜,利于EC迁移和管样结构的形成外,还可以促进白细胞、血管平滑肌细胞等向血管生成部位迁移。这些细胞到达后,蛋白水解酶继续作用促进血管成熟。新生血管成熟的特征为新的基底膜沉积和EC增殖下调。同时,血管内皮分泌MMPs量开始降低,而组织抑制物TIMP及其蛋白含量升高,这不仅可阻断微血管继续生成,以及稳定已生成的微血管并防止其退化[11]。同时,也有利于基质重塑和新生血管成熟[13]。
创面愈合过程中新生血管生长是一个高度受控和有序的过程。在正常的创伤愈合过程中,高度增生的毛细血管会在愈合完成时迅速退化。要完成这一退化过程,诱导因子和抑制因子之间的平衡须恢复到毛细血管退化和EC重新静止这一水平。巨噬细胞可在新生毛细血管消退阶段分泌有助于毛细血管退化的细胞血小板反应素1(thrombospondin 1,TSP-1)。新近报道TSP-1可以在炎症反应早期减少巨噬细胞的聚集和MCP-1的分泌,TSP-1缺陷小鼠的血管生成增加[14]。
2.3 巨噬细胞对成纤维细胞的调节
成纤维细胞是组织修复的主要功能细胞,巨噬细胞主要通过释放的一系列生物活性物质对成纤维细胞的增殖、功能起着重要的调节作用,并且巨噬细胞在愈合的不同时期分泌不同的产物,对成纤维细胞起双向调节作用。一方面是促进成纤维细胞增殖的活性物质如巨噬细胞源性生长因子(macrophagede derived growth factor,MDGF)、IL-1、EGF 、成纤维细胞生长因子(fibroblast grow th factor,FGF)、前列腺素E2等外;另一方面是分泌抑制成纤维细胞增殖活性的物质如干扰素γ、TGF-β、前列腺素E2(PGE2)和IL-6等[14,15];巨噬细胞还分泌一些细胞因子如 TNF-α、IL-1、TGF-β等它们在不同的剂量和不同的条件下对成纤维细胞起不同的调节作用,甚至是相反的结果。因此,巨噬细胞对成纤维细胞的调节作用是所有分泌产物的综合作用的结果。但实验发现伤口局部注射巨噬细胞具有促进血管化、提高胶原含量、增强伤口抗裂强度等作用,而这些作用又可被相应的单克隆抗体所抑制。由此表明:伤口愈合过程中,巨噬细胞释放的多种细胞因子的综合效应是促进组织愈合的作用占主导地位。巨噬细胞在肉芽组织增生期不仅是数量最多的细胞成分,而且它能高表达PDGF、bFGF和 TGF-β等细胞因子。表明巨噬细胞在成纤维细胞增殖和胶原生成中起着重要作用。
手术切口模型的实验研究中发现,术后的腹腔巨噬细胞比正常腹腔的巨噬细胞具有明显刺激成纤维细胞增殖的作用。术后腹腔巨噬细胞的培养上清液对成纤维细胞有明显的促增殖作用,尤其以术后4天、7天的巨噬细胞上清液为最显著,而术后28天的作用下降,与术前的巨噬细胞上清液无差别。对术后巨噬细胞培养上清液的提取物进行研究,其结论基本一致。即术后5天的提取物对腹膜组织修复细胞的促增殖作用最强,术后2天、10天的作用不明显。从皮肤创面直接获取巨噬细胞,观察其培养上清液对成纤维细胞的增殖和胶原合成的影响,发现在伤后4、7、21、28天中有一个从弱到强再到弱的趋势,与创伤愈合的进程是一致的。这些研究结果都表明巨噬细胞在创伤愈合的不同时期可分泌不同的产物,对成纤维细胞起双向调节作用。
2.4 巨噬细胞对(纤维组织形成的影响)胶原纤维合成的调节
巨噬细胞参与了创面修复的重塑期。巨噬细胞通过分泌的生长因子PDGF、IGF-1、bFGF引起纤维增生,另一方面它分泌合成酶类如弹性蛋白酶、纤溶酶原激活剂和胶原酶等降解基质,调节基质形成。其中,降解胶原的酶主要为胶原酶。例如,巨噬细胞可直接产生一些基质金属蛋白酶(MMPs)[16],或者通过释放VEGF诱导MMPs在内皮细胞中产生。巨噬细胞虽能分泌胶原酶,但分泌量少而作用小,巨噬细胞在重塑期的调节作用主要表现促进成纤维细胞分泌更多的胶原酶。胶原酶正常时处于非活化状态,能被巨噬细胞的产物所活化和调节,如纤溶酶原激活剂(Plasminogen activator)使纤维蛋白溶酶原变成纤维蛋白溶酶,后者末活化的胶原酶变成活化的胶原酶。然而活化的胶原酶和纤维蛋白溶酶可被α 2-巨球蛋白所抑制。这种活化和抑制的系统被认为是胶原降解的一种控制调节机制。胶原分子一经胶原酶解离,由巨噬细胞释放蛋白酶(如纤维蛋白溶酶)进一步将其消化成碎片和游离氨基酸。胶原的生成和降解能否达到平衡与创面修复结局密切相关。组织修复过度将导致局部产生大量胶原基质降解减少而形成临床上常见的瘢痕[17];组织修复不足即基质降解过度将会导致难愈创面。此外,巨噬细胞降解胶原的作用还受某些因素的影响,如糖皮质激素抑制巨噬细胞向伤处游走,类固醇激素抑制巨噬细胞释放胶原酶和纤维蛋白溶酶原的活化物质。由此可见,巨噬细胞在伤口愈合中,对平衡胶原代谢方面起着复杂而重要的作用。
[1]Kunimoto BT.Growth factors in wound healing:the next great innovation?[J].Ostomy Wound Manage,1999,45:56-66.
[2]Henry G,Garner W.Inflammatory mediators in wound healing[J].Surg.Clin.North Am,2003,83:483.
[3]Gillitzer R,Goebeler M.Chemokines in cutaneous wound healing[J].J Leukoc Biol,2001,69:513-21.
[4]Dovi JV,He Li-Ke,DiPietro LA.Accelerated wound closure in neutrophil-depleted mice[J].J Leukoc Biol,2003,73:448-455.
[5]陈晓红,程天民.中性粒细胞在组织修复中的作用[J].中国药理学报,2001,17:373-376.
[6]Martin P,Leibovich SJ.Inflammatory cells during wound repair:the good,the bad and the ugly[J].T RENDS in Cell Biology,2005,15(11):659-607.
[7]Park JE,Barbul A.Understanding the role of immune regulation in wound healing[J].The American Journal of Surgery,2004,187:11S-16S.
[8]Atif D,Agaiby,Dy son M.Immuno-inflammatory cell dy namics during cutaneous wound healing[J].J Anat,1999,195:531-542.
[9]Martin P.Wound healing aiming for perfect skin regeneration[J].Science,1997,276:75-81.
[10]Dipietro LA,Reintjes MG,Low QE,et al.M odulation of macrophage recruitment into wounds by monocyte chemoattractant protein21[J].WoundRepair Regen,2001,9(1):28-33.
[11]郭强,熊思东.巨噬细胞的三种活化[J].生命的化学,2004,24(2):87-88.
[12]Waugh HV,Sherratt JA.Macrophage Dynamics in Diabetic Wound Healing[J].Bulletin of Mathematical Biology,2006,68:197-207.
[13]Shirafuji T,Oka T,Sawada T,et al.The importance of peripheral blood leukocytes and macrophage infiltration on bronchial wall wound healing in rats treated preoperatively with anticancer agents[J].Surg Today,2001,31(4):308-316.
[14]Agah A,Ky riakides T R,Lawler J,et al.The lack of thrombospondin-1(TSP1)dictates the course of wound healing in double TSP1/TSP2-null mice[J].Am J Pathol,2002,161(3):831-839.
[15]Rodegers KE,iZerega GS.M odulation of peritoneal reepithelialization by postsurgical macrophages[J].J Surg Res,1992,53:542-548.
[16]M ater RB,Reichner JS,Albina JD.Interleukin-6 activity in wounds[J].Am J Physio,1994,266:1840-1844.
[17]Kvanta A,Shen WY,Sarman S,et al.M atrix metalloproteinase(MMP)ex pression in experimental choroidal neovascularization[J].Curr Eye Res,2000,21:684-690.
[18]O'Kane S.Wound remodelling and scarring[J].J Wound Care,2002,11(8):296-299.