小鼠骨折愈合过程中骨痂中FGFRs的表达
谢杨丽,周锐,易玲娴,苏楠,金旻,杜晓兰,陈林
(第三军医大学大坪医院野战外科研究所创伤实验室,骨代谢与修复中心,创伤、烧伤与复合伤国家重点实验室,重庆 400042)
骨折愈合是一个包括软骨形成,骨形成和重建的复杂过程[1]。骨折愈合过程是局部骨骼的再发育过程[2,3]。骨折愈合机理研究发现,许多参与调控骨骼发育的分子如细胞因子、生长因子、转录因子和基质蛋白分子参与了骨折愈合过程,且这些分子的变化类型和规律与胚胎骨骼发育过程中的分子信号通路变化有较大的相似性。与发育过程中相似,成纤维细胞生长因子(fibroblast grow th factors,FGFs),转化生长因子(transforming growth factors,TGFs)和骨形成蛋白(bone morphogenetic proteins,BMPs)等肝素结合生长因子(heparin-binding growth factors,HBGFs)对骨折愈合发挥着重要的调节作用[4],并且体内实验发现FGF2等具有促进骨形成的作用[5]。成纤维细胞生长因子受体(Fibroblast growth factor receptors,FGFRs)是FGFs的特异性受体,提示它们同样也参与骨折愈合过程的调控。既往对于骨发育过程的研究发现,FGFR1和FGFR2主要影响膜内成骨过程,它们的功能增强型点突变均导致囟门早闭[6],而FGFR3在骨发育尤其是软骨内成骨中发挥关键作用,它是骨骼生长的负性调节分子[7,8]。不同的FGFRs发挥的作用不同,因此研究其在骨折愈合过程的表达对于明确其在骨折愈合中作用有较大的意义。
我们利用SPF级C57BL/6J小鼠制作标准骨折模型,组织学观察骨折愈合情况及骨折后第3天、第7天、第14天、第21天和第28天FGFRs表达水平,为研究FGFRs在骨折愈合的作用和寻求改善骨折愈合的方法提供理论基础和实验依据。
1 材料和方法
1.1 主要试剂和仪器
T rizol(Invitrogen,美国),逆转录试剂盒(Exscript,TAKARA,日本),定量PCR反应试剂盒(SYBRTMPremix Ex TaqTMKit,TAKARA,日本),PCR仪(Eppendorf,德国),实时荧光定量PCR仪(Stratagene,美国),紫外分光光度计(Eppendorf,德国),石蜡切片机(Leica,德国)。
1.2 动物模型及分组
2月龄雄性SPF级C57BL/6J小鼠(第三军医大学大坪医院野战外科研究所动物中心)50只,体重22-28g,随机数字法分为骨折后3、5、7、14、21 和28天等6个时相点组。以Choi[9]等描述的非稳定骨折动物模型制作方法为基础改良。使用1%戊巴比妥钠按1ml/kg剂量腹腔注射,待小鼠完全麻醉后,备皮、消毒小鼠右下肢,在小鼠右侧膝关节下切开约0.5cm纵行切口,分离肌肉筋膜后,于胫骨中上1/3处用眼科剪横断胫骨。逐层缝合切口,制成小鼠右侧胫骨干闭合性骨折模型。
1.3 小鼠骨折愈合情况观察
术后清洁环境下单笼饲养,室温22-24℃,湿度60%,定期紫外线消毒与排风。常规给水及饮食,小鼠可自由活动。手术当日,观察其苏醒情况。于骨折后5、7、14、21天处死小鼠(n=4),取其骨折胫骨多聚甲醛固定,乙二胺四乙酸(EDTA)脱钙,梯度乙醇脱水,石蜡包埋,切片厚5 μ m,常规HE 色,光镜观察其组织病理改变。
1.4 总 RNA提取、逆转录
取各时间点(n=4)的右侧胫骨骨折处上下各0.3 mm处剪下骨痂,加入液氮待组织变脆后研磨至粉末加入1ml T rizol中,样品体积不应超过T rizol体积 10%.静置 10 min;加 200 μ l氯仿混匀 、离心、取上清,异丙醇沉淀,75%乙醇洗涤,用紫外分光光度仪检测RNA纯度和浓度。OD260/OD280范围在1.8-2.0之间。取1μ g总RNA为模板,参照逆转录试剂盒的说明书进行逆转录反应。取手术当日左侧胫骨同样位置骨组织提取RNA为对照。
1.5 实时荧光定量PCR检测
内参和目的基因的引物由上海生工生物工程公司合成(表一)。PCR反应体系配制及扩增条件设置参照定量PCR反应试剂盒说明书进行,每次做3个复孔,每个基因重复3次。扩增条件:95℃30s;95℃5s,57℃20s,72℃15s,40个循环(扩增);95℃30s,57℃30s,95℃30s。定量PCR仪自动给出熔解曲线分析,得到扩增曲线、熔解曲线和样本的循环阈值(cycle threshold,CT)值和目的基因的相对含量。

表1 目的基因引物序列Fab.1 primens used in real-time pcr
1.6 统计学方法
2 结果
2.1 骨折模型制作成功
骨折小鼠麻醉后约2-3小时可完全苏醒并逐渐恢复正常活动,伤侧肢体大约在术后3-5天方可承重。小鼠可自由饮水、饮食及活动。实验动物术后成活率为100%,取材前X光摄片,初步观察骨折愈合,取对合良好、无明显错位和骨碎片的(图1)40只进入结果分析。

图1 胫骨骨折X光Fig.1 X-ray images of Tibia fracture
2.2 骨折愈合情况评价
骨折后5天,骨痂中主要是软骨组织,以尚未成熟的静息期、增殖期软骨为主(图2A、E)。骨折后7天,骨痂主要由软骨性骨痂及少量骨性骨痂组成,其中软骨痂内软骨组织与第5天比有明显增多,骨折线周围以软骨细胞为主,局部开始出现肥大软骨细胞(图2B、F)。骨折后14天,骨痂进入硬骨痂形成期,骨痂中大部分区域被新生编织骨取代,软骨组织明显减少,残留的软骨组织中软骨细胞基本上都已经分化为肥大软骨细胞(图2C、G)。骨折后21天,骨痂处于重建阶段,软骨痂基本被编织骨替代,并且开始形成骨髓腔(图2D、H)。骨折后28天,小鼠骨髓腔完全再通(图片未显示)。
2.3 小鼠骨折愈合过程中FGFRs mRNA表达水平变化
我们利用定量PCR检测了骨折愈合各阶段骨痂组织中FGFRs mRNA的表达。结果显示:与对照组相比,FGFR1骨折后3天开始显著升高,最高在14天时表达量达到对照的6倍,且持续到骨折愈合的28天仍处在对照3.2倍水平(图3A);FGFR2表达在骨折后显著增加,在骨折后7天达到峰值,约为对照的2.1倍,骨折后28天恢复正常水平(图3B);FGFR3骨折后7天表达达到峰值,持续到骨折后21天仍处在较高水平(图3C)。
3 讨论
骨折愈合过程包括炎症期、血肿机化期、软骨痂形成期、硬骨痂形成期和骨痂塑型改建期等病理学过程。骨折愈合过程有与骨骼发育过程类似之处:如骨折稳定,骨折处骨髓间充质细胞及骨膜下骨生成细胞等可直接分化为成骨细胞,在骨折端内外形成骨样组织并逐渐骨化成新骨,即膜内成骨;而在不稳定骨折时,骨折断端间的间充质细胞等先分化为软骨细胞,形成软骨痂,随后软骨细胞增生、成熟肥大、凋亡,在软骨细胞成熟肥大的同时伴有血管长入,成骨细胞成骨,逐步替代软骨,并在破骨细胞的作用下发生骨重建,即软骨内成骨。绝大多数骨折愈合都是两种成骨模式交织进行的,只是稳定性骨折以膜内成骨为主,非稳定性骨折以软骨内成骨为主[10,11]。本实验采用的是不稳定骨折模型,组织学观察结果与上述过程一致,是一个软骨形成和骨形成交织进行的过程。骨折后5天,血肿消失,骨痂中出现明显的软骨细胞,主要以静息期和增殖期软骨为主;骨折后7天,骨痂以软骨痂为主,有少量的骨性骨痂出现,局部可见肥大软骨细胞;骨折后14天,骨痂中大部分是新生编织骨所形成的硬骨痂,存有少量的软骨组织;骨折后21天,骨痂进入重建期,软骨组织逐渐消失,骨髓腔也开始逐渐恢复再通。
FGFs/FGFRs信号通路在骨发育中发挥着重要作用。由于表达谱和与不同配体的亲和力不同,FGFRs在骨发育中的作用有明显的分工。FGFR1、FGFR2主要在颅骨成骨细胞中表达,参与骨形成过程。FGFR1、FGFR2功能增强型点突变主要由于前成骨细胞分化加快膜内成骨增强进一步导致颅缝早闭[6,12]。相反地,FGFR3主要在软骨形成过程中表达,其突变能引起异常的软骨内成骨,研究证实,FGFR3是软骨发育的负性调节因子[7,13,14]。骨折愈合与骨折发育过程相似[15]。这提示我们,不同的FGFR在骨折愈合过程中发挥不同的作用。
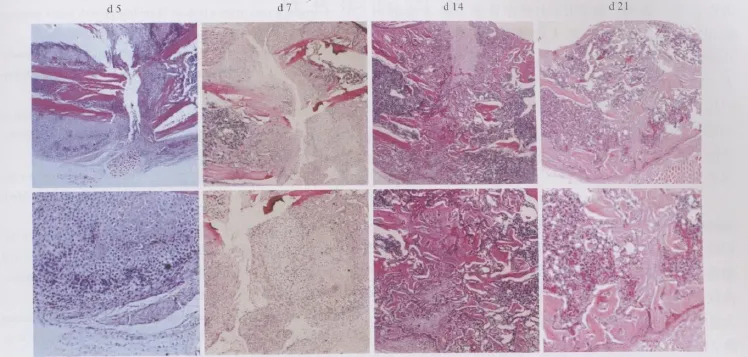
图2 胫骨骨折后第 5、7、14、21天骨痂组织学形态(上排HE×40,下排 HE×100)Fig.2 HE staining of callus tissues on day 5,7,14,21

图3 骨折愈合过程中FGFRs表达水平变化Fig.3 Temporal expression of FGF receptors in the tibia following surgery
我们应用定量PCR检测FGFRs在骨折愈合过程中的表达情况。我们发现,FGFR1在骨折后3天开始显著升高,骨折后14天达到峰值并持续到28天。这点与Nakajima等[16]的结果相似,FGFR1的表达从骨折后3天即开始升高,这与其在骨骼肌受损后促进肌源性细胞增殖和分化以及优先参与骨膜下骨前体细胞增殖相关[17]。同时研究证实,FGFR1与炎症反应有关[18,19],这也是FGFR1在骨折后早期就出现高表达的可能原因。随着骨折愈合过程的发展,软骨痂中的软骨细胞不断成熟形成肥大软骨细胞,成骨过程不断进行,表达于成骨细胞和的肥大软骨细胞的FGFR1在骨折后14、21天持续处于高表达,与组织学的骨折愈合过程相一致。
FGFR2表达在骨折后显著增加,在骨折后7天达到峰值,而后逐渐恢复到正常水平,这与其的表达谱也是相一致的。FGFR2主要在骨膜下的成骨细胞和软骨痂的肥大前、肥大软骨细胞表达[20],因此其在骨折后表达变化不如FGFR1灵敏,在骨折后5天,骨痂中以尚未成熟的软骨细胞为主,因此FGFR2的表达变化不明显,而在有肥大软骨细胞出现的骨折后7天发生明显改变,并且由于软骨细胞的不断肥大凋亡被成骨细胞取代而一直处在较高水平。
与对照相比,FGFR3骨折后7天、14天表达达到峰值,持续到骨折后21天仍处在较高水平。FGFR3在软骨发育中在长骨的静息期和增殖期软骨细胞表达,然而在骨折愈合中,FGFR3主要在肥大前软骨细胞和肥大软骨细胞中表达[21],因此,在有大量静息期与增殖期软骨的骨折后5天,并不能检测FGFR3表达的显著增高,而在肥大前软骨细胞和肥大软骨细胞较多的骨折后7天、14天高表达,这与组织学观察的过程相吻合。
总之,通过对骨折愈合中FGFRs表达的研究,可望为阐明FGFs/FGFRs在骨折愈合过程中的可能作用和采取干预FGFs/FGFRs信号的措施促进骨折愈合,降低骨不连率提供理论基础。
[1]Yamazaki M,Nakajima F,Ogasawara A,et al.Spatial and temporal distribution of CD44 and osteopontin in fracture callus[J].Bone Joint Surg Br,1999,81(3):508-515.
[2]Gerstenfeld LC,Cullinane DM,Barnes GL,et al.Fracture healing as a post-natal developmental process:molecular,spatial,and temporal aspects of its regulation[J].Cell Biochem,2003,88(5):873-884.
[3]Hadjiargyrou M,Lombardo F,Zhao S,et al.T ranscriptional profiling of bone regeneration.Insight into the molecular complexity of wound repair[J].Biol Chem,2002,277(33):30177-30182.
[4]Barnes GL,Kostenuik PJ,Gerstenfeld LC,et al.Growth factor regulation of fracture repair[J].Bone Miner Res,1999,14(11):1805-1815.
[5]Kawaguchi H,Nakamura K,Tabata Y,et al.Acceleration of fracture healing in nonhuman primates by fibroblast growth factor-2[J].Clin Endocrinol M etab,2001,86(2):875-880.
[6]Wilkie AO,M orriss-Kay GM,Jones EY,et al.Functions of fibroblast growth factors and their receptors[J].Curr Biol,1995,5(5):500-507.
[7]Deng C,Wynshaw-Boris A,Zhou F,et al.Fibroblast growth factor receptor 3 is a negative regulator of bone growth[J].Cell,1996,84(6):911-921.
[8]Colvin JS,Ogilvie C,T hompson Z,et al.Skeletal overgrowth and deafness in mice lacking fibroblast growth factor receptor 3[J].Nat Genet,1996,12(4):390-397.
[9]Choi P,Ogilvie C,Thompson Z,et al.Cellular and molecular characterization of a murine non-union model[J].Orthop Res,2004,22(5):1100-1107.
[10]Le AX,Miclau T,Hu D,et al.Molecular aspects of healing in stabilized and non-stabilized fractures[J].Orthop Res,2001,19(1):78-84.
[11]Ferguson C,Alpern E,Miclau T,et al.Does adult fracture repair recapitulate embry onic skeletal formation?[J].M ech Dev,1999,87(1-2):57-66.
[12]Iseki S,Wilkie AO,Heath JK,et al.Fgfr2 and osteopontin domains in the developing skull vault are mutually exclusive and can be altered by locally applied FGF2.[J].Development,1997,124(17):3375-3384.
[13]Rousseau F,Bonaventure J,Legeai-Mallet L,et al.Mutations in the gene encoding fibroblast growth factor receptor-3 in achondroplasia.[J].Nature,1994,371(6494):252-254.
[14]Chen L,Li C,Qiao W,et al.A Ser(365)->Cys mutation of fibroblast growth factor receptor 3 in mouse downregulates Ihh/PT HrP signals and causes severe achondroplasia[J].Hum Mol Genet,2001,10(5):457-465.
[15]Cheung C.The future of bone healing.[J].Clin Podiatr Med Surg,2005,22(4):631-641.
[16]Nakajima A,Nakajima F,Shimizu S,et al.Spatial and temporal gene expression for fibroblast g rowth facto r type I receptor(FGFR1)during fracture healing in the rat[J].Bone,2001,29(5):458-466.
[17]T empleton TJ,Hauschka SD.FGF-mediated aspects of skeletal muscle g rowth and differentiation are controlled by a high affinity recepto r,FGFR1[J].DevBiol,1992,154(1):169-181.
[18]Byrd VM,Kilkenny DM,Dikov MM,et al.Fibroblast growth factor receptor-1 interacts with the T-cell receptor signalling pathway[J].Immunol Cell Biol,2003,81(6):440-450.
[19]Schwertfeger KL,Xian W,Kaplan AM,et al.A critical role for the inflammatory response in a mouse model of preneoplastic progression[J].Cancer Res,2006,66(11):5676-5685.
[20]Rundle CH,Miyakoshi N,Ramirez E,et al.Ex pression of the fibroblast g rowth factor receptor genes in fracture repair[J].Clin Orthop Relat Res,2002,(403):253-263.
[21]Nakajima F,Nakajima F,Shimizu S,et al.Spatial and temporal gene expression in chondrogenesis during fracture healing and the effects of basic fibroblast growth factor[J].Orthop Res,2001,19(5):935-944.