磷化氢在改性活性炭纤维上的吸附等温过程
余琼粉,易红宏,唐晓龙,宁平,杨丽萍
(昆明理工大学 环境科学与工程学院,云南 昆明,650093)
密闭电石炉尾气中富含CO[1-3],可利用密闭电石炉尾气生产化工产品甲酸钠[4]、乙二醇[5]、合成氨或甲醇[6],但尾气中磷化氢(PH3)、氰化氢(HCN)等杂质[7]的存在限制了其作为优质化工原料的使用。目前,密闭电石炉尾气中的PH3净化技术鲜见报道,大量密闭电石炉尾气远远达不到化工原料对PH3杂质含量限制的要求。大部分富含CO的密闭电石炉尾气只能采用点火燃烧的方式处理,燃烧后大量的CO2排放到大气中不符合清洁发展机制的要求,而且能量浪费十分严重。为实现CO2减排和密闭电石炉尾气的综合利用,需要采用经济适用的技术措施将密闭电石炉尾气中的PH3杂质去除。如果能采用易于解吸的吸附法净化气尾气中的PH3,一方面可将净化后的CO用于生产高附加值的产品,同时,还为PH3的资源化创造了前提条件。本文作者以PH3为研究对象,利用CoCl2改性活性炭纤维(ACF)为吸附剂,从吸附量、吸附等温线和吸附热方面对相关问题进行研究。
1 材料与方法
1.1 吸附剂制备
实验用新鲜吸附剂为黏胶基活性炭纤维(ACF,中国化工新材料公司辽源化工材料厂产品),活性组分为CoCl2(广东省汕头市西陇化工厂产品),纯度大于99%,采用浸渍法制备CoCl2改性ACF。制备方法如下:将一定浓度的CoCl2水溶液加入装有ACF的烧杯中,于40 ℃超声浸渍20 min后经过滤、洗涤、干燥及焙烧制得实验用CoCl2改性ACF。
1.2 吸附等温线实验装置
改性ACF对PH3的静态吸附量采用静态容积法测定。实验装置为自制的真空玻璃静态吸附装置测定,实验装置如图1所示,其中,阀5~7包括的封闭区域为参比槽。
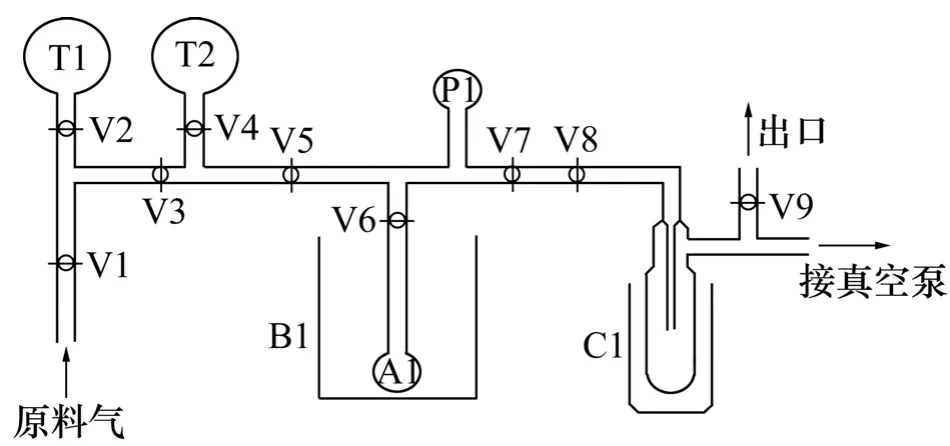
图1 静态吸附实验装置图Fig.1 Apparatus of static volumetric method
进入系统的原料气储存在T1或T2中。根据实验要求,参比槽中的气体压力必须精确,因此,要严格控制输入气室气体的体积。在实际操作中,手动调节阀5 要仔细控制。原料气通过二通调节阀5后进入气室,此时调节阀6和7关闭,气室的压力会缓慢上升。将压力精准控制。当压力稳定后,关闭调节阀 5,此时气室的充气过程结束。记录此时压力表 P1的准确读数。随后,在调节阀5和7关闭的情况下,缓慢打开调节阀 6,此时吸附过程开始。随着吸附过程的进行,待精密压力表 P1的读数保持恒定时,即达到吸附平衡。根据预先设定的测量压力间隔,记录各个压力段下压力表P1的读数。在本实验装置中,改性ACF的解吸采用抽真空解吸的方法。在解吸步骤中,首先关闭调节阀9,打开调节阀7和8以及真空泵。
吸附实验所用PH3气体购于大连大特气体有限公司。工业废气中PH3体积分数为0.1%左右,本实验选用体积分数为1%的PH3(载气为N2),其目的在于减少实验过程中因磷化氢分压偏小引起较大的实验误差。又由于N2为惰性组分,且在实验条件下经吸附测试后发现,将ACF暴露于N2中测试时,压力表的读数基本不变。因此,可忽略N2对PH3吸附过程的影响,吸附过程可视为单组分PH3在改性分子筛上的吸附。取1.5 g左右的吸附剂装入容积为82.96 mL的吸附管中,在60 ℃抽空1 h,测定浸渍液浓度和吸附温度对PH3在改性ACF上吸附量的影响。
2 结果与讨论
2.1 浸渍液浓度对PH3吸附量的影响
采用不同浓度的CoCl2浸渍液对ACF载体进行负载,并进行吸附量测试,吸附测试温度为298 K,对应吸附量如图2所示。
从图2可以看出:采用CoCl2水溶液浸渍改性后,ACF载体增大了对PH3的吸附量。在实验条件范围内,0,0.1,0.2,0.3,0.4和0.5 mol/L CoCl2水溶液浸渍改性后的ACF对PH3吸附量依次为17.211,18.891,19.674,18.441,17.973和16.470 mg/g,即随着浸渍液浓度的变化,改性ACF对PH3的饱和吸附量也在发生变化。这是因为改性后活性组分Co3O4的载入可提高改性ACF的吸附量,且随着浸渍液浓度的提高,即随着载体上活性组分含量增加,改性ACF对PH3的吸附量增大。但浸渍液浓度不能太高,否则负载量的增加可能会堵塞吸附载体的微孔,导致吸附剂比表面积下降,从而降低吸附剂的吸附量,这与文献[8-9]中的研究结果相一致。从图2可知:浸渍液浓度存在最佳值为0.2 mol/L,此时改性ACF对PH3的饱和吸附量最大,为19.674 mg/g,而浸渍液浓度过高或过低均不利于PH3的吸附。因此,考察温度对PH3吸附量影响时,选用的CoCl2浸渍液浓度为0.2 mol/L。
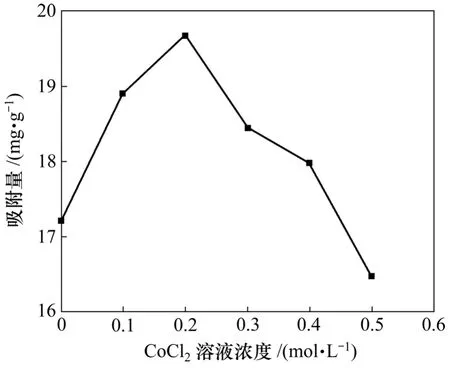
图2 浸渍液浓度对PH3吸附量的影响Fig.2 Influence of concentration of CoCl2 solution on adsorption capacity
2.2 温度对PH3吸附量的影响
实验研究了298,313和328 K时PH3在CoCl2改性ACF上的吸附行为,并根据吸附平衡数据绘制了吸附等温线,结果如图3所示。
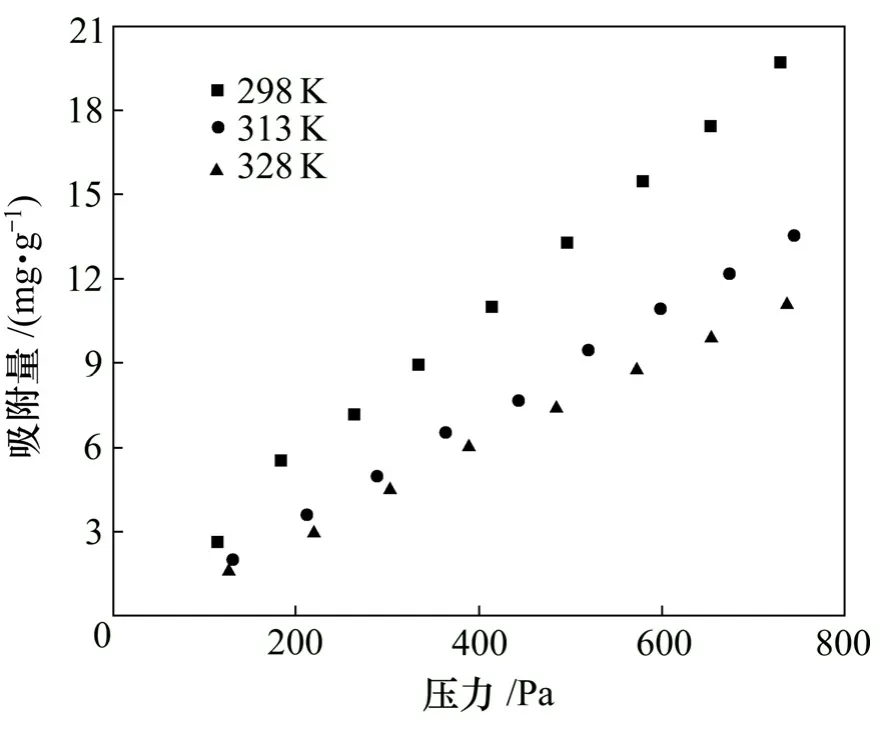
图3 不同温度下PH3在改性ACF上的吸附等温线Fig.3 Adsorption isotherm of phosphine at different temperatures
从图3可以看出:在同一温度下,吸附量随着PH3分压的升高呈线性趋势增大;而在同一PH3分压下,吸附量随温度升高而降低;当 PH3分压为 0~1 kPa,在 298,313和 328 K时 PH3的饱和吸附量分别为19.674,13.537和11.087 mg/g。这是因为PH3在改性ACF上的吸附过程是一个放热过程,温度升高,PH3蒸气压增大,从而增大吸附相的能量水平,吸附相PH3分子获得足够的能量后克服物理吸附力返回气相中[10]。这种吸附量随温度升高而迅速降低的趋势可以很好地将变温吸附技术用于PH3在改性ACF上吸附过程,从而实现密闭电石炉尾气的净化和PH3气体的资源化。
2.3 吸附等温方程的拟合
2.3.1 Langmuir吸附等温方程
Langmuir吸附等温方程假设吸附质在吸附剂固体表面是单分子层吸附,表面上各个吸附位置分布均匀,发生吸附时焓变相同,其方程基本形式[11]为:

式中:q为实验条件下1 g吸附剂的吸附量;qm为极限吸附量;b为 Langmuir常数;p为吸附剂表面的分压。
2.3.2 Freundlich吸附等温方程
Freundlich提出一种半经验的吸附等温方程,常用于描述吸附质浓度变化范围不是很大的非均匀表面的气固相吸附体系,其方程基本形式[12]为:

式中:k是与吸附剂、吸附质的种类和性质有关的常数;n为吸附常数。该方程应用很广泛,可用于物理吸附,也可用于化学吸附。
2.3.3 Langmuir和Freundlich吸附等温方程拟合结果
为了比较2种吸附等温方程对实验数据的拟合程度,引入平均相对误差来评判拟合效果,平均相对误差Δ定义如下:
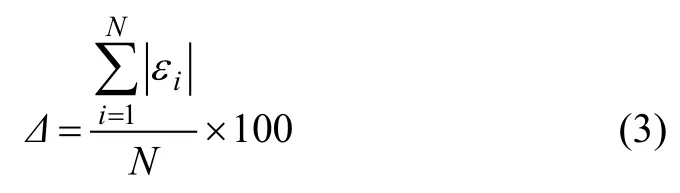
式中:N为实验所测数据点总数,iε为单个平衡点的实验结果与拟合结果之间的相对误差。
利用Langmuir和Freundlich吸附等温方程分别拟合298,313和328 K时PH3在CoCl2改性ACF上的吸附平衡数据。图4所示为2种方程对不同温度下PH3在改性ACF上的平衡吸附点的模拟结果,2种方程对各温度下拟合所得参数值、平均相对误差及相关系数如表1~2所示。
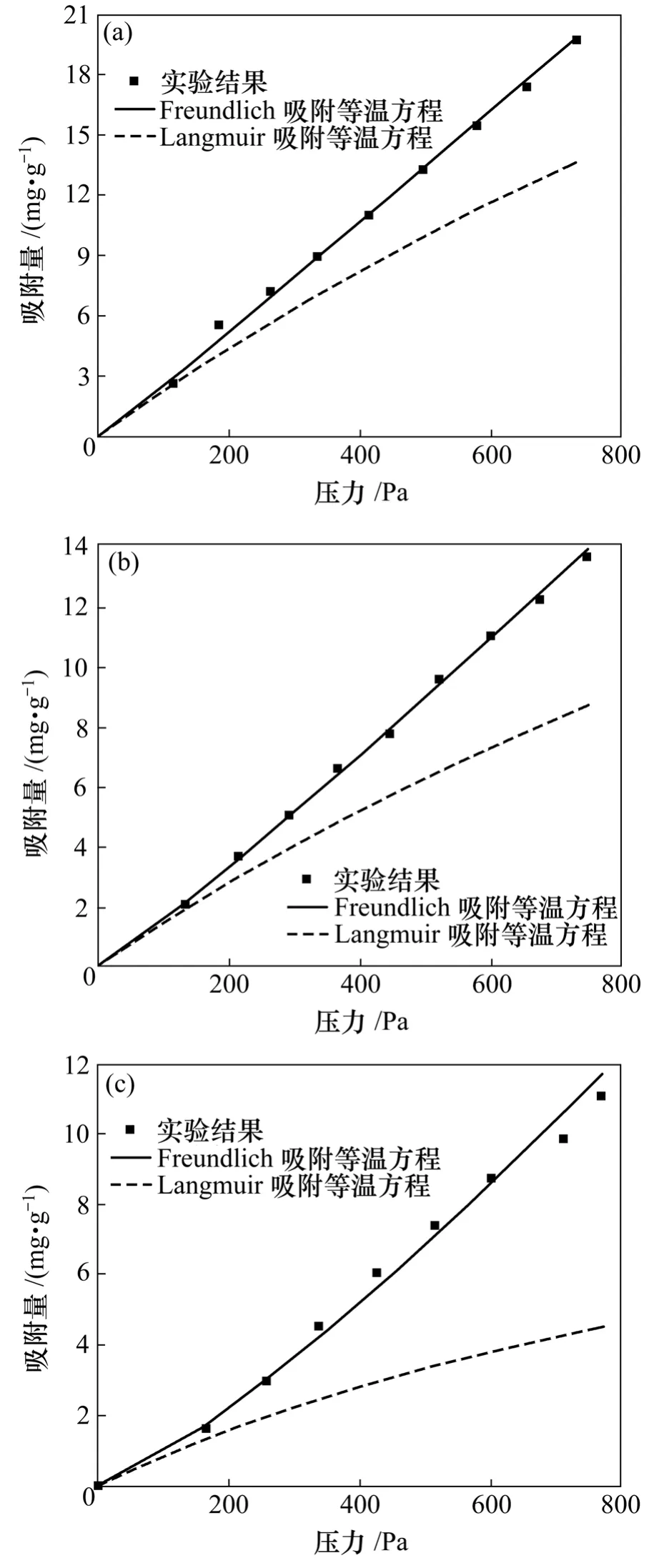
图4 不同温度下的实验吸附数据和2种方程拟合结果Fig.4 Experimental data and adsorbed amount quantities predicted by Langmuir and Freundlich equations
由图4可看出:Freundlich吸附等温方程拟合效果较好,部分实验数据点落在拟合曲线上,部分数据点均匀分布在Freundich曲线的周围;Langmuir吸附等温方程拟合出来的曲线位于实验数据点的下方,即拟合结果偏小,与实验数据偏差较大,难以准确预测实验平衡数据。
从表1和表2所示的拟合结果可看出:Langmuir方程对吸附平衡数据的拟合结果与实验结果的平均相对误差值均在22%以上;而Freundlich方程较好地拟合了实验结果,Freundlich方程的拟合结果与实验结果的平均相对误差小于5.2%。
从图4、表1和表2还可看出:Langmuir方程拟合所得的极限吸附量与实际的饱和吸附量差异较大,其原因可能与实验中PH3分压较低有关。这使得实验结果与拟合结果相差较大。由此可见,当分压较低时,应考虑采用Freundlich吸附等温方程对吸附平衡数据进行拟合。
以上结果表明:Langmuir方程的假设与实验吸附过程不吻合,由此也可以间接证实 PH3在改性 ACF上的吸附可能不是单分子层吸附,改性ACF表面的能量并不是均匀分布。由于Frendlich方程为经验方程,不能说明吸附过程的机理,因此,需要探讨等量吸附热等参数,从而在一定程度上解释其吸附机理。
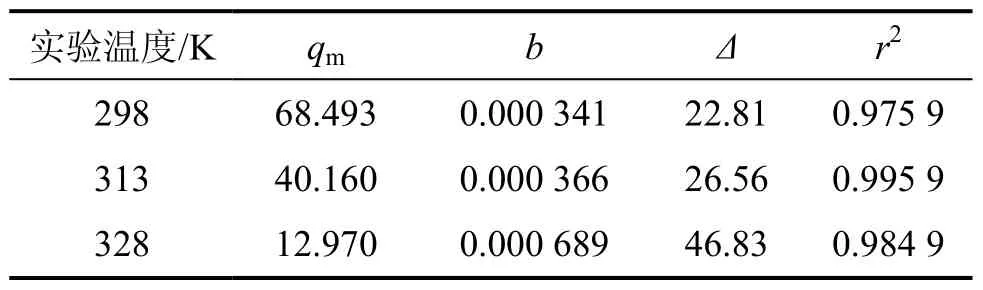
表1 Langmuir方程拟合所得参数值和平均相对误差及相关系数Table 1 Parameters qm, b and Δ of Langmuir fitting together with r2
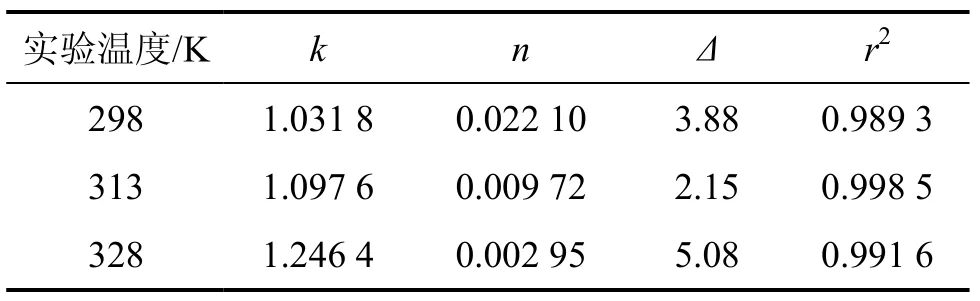
表2 Freundlich方程拟合所得参数值和平均相对误差及相关系数Table 2 Parameters k, n and Δ of Freundlich fitting together with r2
2.4 等量吸附热的计算
吸附热数据在一定程度上可表征吸附类型,而且可用于分析吸附剂表面的均匀性。因此,利用Clausius-Clapeyron方程[13],将不同温度下的吸附平衡数据用于计算等量吸附热ΔHs,从而分析吸附类型和吸附剂表面均一性。
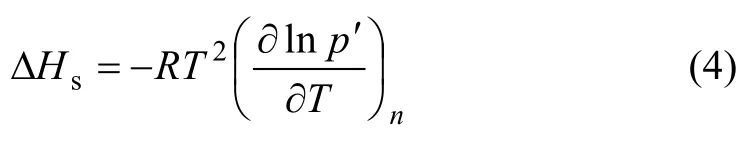
式中:ΔHs为等量吸附热,为吸附相浓度n的函数;负号表示吸附过程是放热过程;R为理想气体常数;T为温度,p′为PH3分压。在固定吸附量q下,将上式对T积分,有:
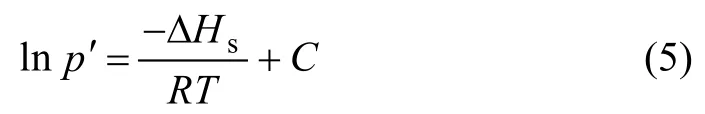
式中:C为积分常数项。从式(5)可以看出,对于固定平衡吸附量q, lnp′与1/T呈线性关系,由斜率可得到吸附热ΔHs。PH3气体在改性ACF上的等量吸附线如图5所示,等量吸附热数据见表3。
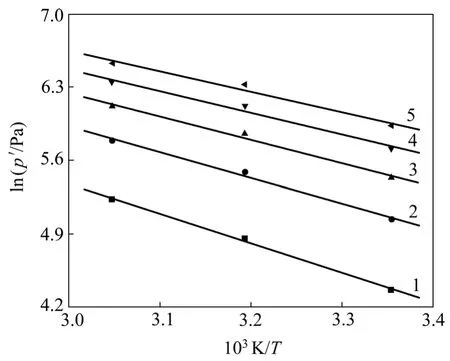
图5 不同吸附量下的等量吸附线Fig.5 Adsorption isosteres with different adsorbed amounts
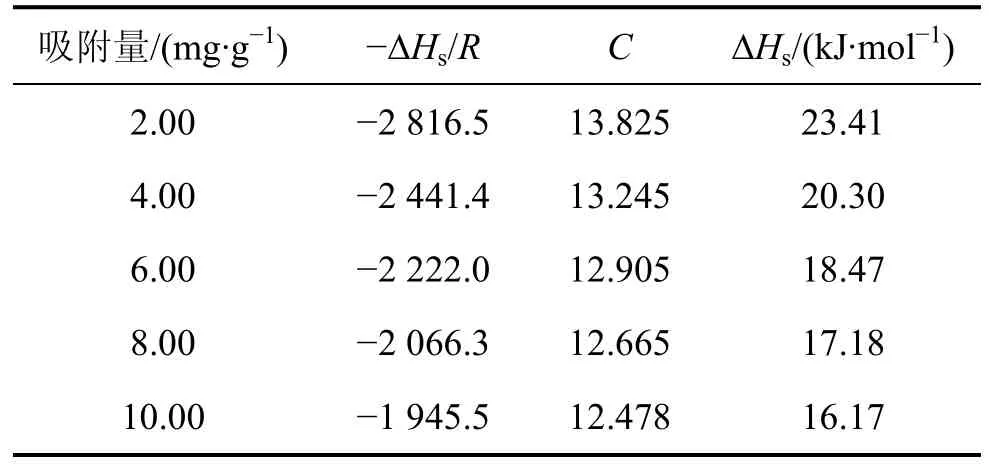
表3 等量吸附线线性拟合参数及等量吸附热Table 3 Fitting parameter of adsorption isosteres and isosteric heat of adsorption
由表3可知:当初始吸附量仅为2.00 mg/g时,吸附热最大可达23.41 kJ/mol;而随着吸附量的增加,吸附热逐渐减小,当吸附量达10.00 mg/g时,吸附热降低为16.17 kJ/mol,这种变化趋势表明改性ACF表面能量分布是不均匀的。这是因为吸附开始时,PH3吸附仅仅发生在最活泼的活性中心上,此时所需的活化能最小,而产生的吸附热最大;随着吸附量的增加,活性中心逐渐被占据,吸附转到那些较不活泼的吸附中心,此时,活化能增大,吸附热变小[14-15]。这是因为当吸附剂表面能量均匀时,被吸附的吸附质分子之间没有作用力,此时等量吸附热与吸附量无关,但若吸附剂表面能量不均一,则吸附了的吸附质分子间作用力不可忽略,此时等量吸附热会随吸附量的变化而变化。
在吸附量为 2.00~10.00 mg/g时,吸附热为 16~24 kJ/mol,鉴于化学吸附热通常为40~400 kJ/mol,因此,PH3在改性ACF上的吸附过程属物理吸附过程。不同温度下,吸附等温线上吸附量随温度升高而降低,这表明PH3在改性ACF吸附剂上的吸附过程为物理吸附,有利于密闭电石炉尾气的净化和PH3气体的资源化。
3 结论
(1) 浸渍液浓度存在最佳值,为0.2 mol/L,此时改性ACF对PH3的饱和吸附量为19.674 mg/g,过低或过高的浸渍液浓度均不利于PH3的吸附。
(2) PH3在CoCl2改性ACF上的吸附量随温度升高而迅速降低,当PH3分压为0~1 kPa时,在298,313和328 K时PH3的饱和吸附量分别为19.674,13.537和11.087 mg/g。这种变化趋势可以很好地将变温吸附技术用于PH3在改性ACF上吸附过程,从而实现密闭电石炉尾气的净化和PH3气体的资源化。
(3) 采用Langmuir和Freundlich吸附等温方程拟合了298,313和328 K时的吸附平衡数据,Freundlich方程拟合结果与吸附平衡结果较吻合。
(4) PH3气体在改性ACF上的等量吸附热随吸附量的增大而减小,表明改性 ACF表面能量的不均匀性。在实验条件下,PH3的等量吸附热小于24 kJ/mol,过程为物理吸附,有利于密闭电石炉尾气的净化和PH3气体的资源化。
[1] 苏凤林, 张国梁, 谭淑媛. 密闭电石炉烟气净化除尘技术研究[J]. 化学工程师, 2008, 148(1): 47-49.SU Feng-lin, ZHANG Guo-liang, TAN Shu-yuan. Study on flue gas purification for obturating furnace of calcium carbide[J].Chemical Engineer, 2008, 148(1): 47-49.
[2] 石峻, 毛志伟, 王琦, 等. 全密闭电石炉尾气治理及综合利用[J]. 中国环保产业, 2007(2): 51-54.SHI Jun, MAO Zhi-wei, WANG Qi, et al. Tail gas treatment and comprehensive utilization of full-airtight carbide furnace[J].China Environmental Protection Industry, 2007(2): 51-54.
[3] 朱建芳. 密闭电石炉炉气的热能综合利用[J]. 化工技术经济,1998, 18(1): 32-33.ZHU Jian-fang. Comprehensive utilization of heat energy of closed calcium carbide furnace gas[J]. Chemical Techno-Economics, 1998, 18(1): 32-33.
[4] 马俊. 电石生产废弃物的综合利用[J]. 煤化工, 2002(3):66-68.MA Jun. Comprehensive utilization of the waste material during the process of carbide production[J]. Coal Chemical Industry,2002(3): 66-68.
[5] 傅永茂, 任茂华. 一种利用电石炉尾气生产乙二醇的工艺:中国, 200810109834.0[P]. 2008-10-15.FU Yong-mao, REN Mao-hua. A method of producing ethanediol by using of calcium carbide furnace gas: China,200810109834.0[P]. 2008-10-15.
[6] 赵中彦, 魏彦辉. 电石炉尾气用于合成氨或甲醇生产的工艺:中国, 200510085638.0[P]. 2006-01-25.ZHAO Zhong-yan, WEI Yan-hui. A method of synthesis ammonia and ethanediol production by using calcium carbide furnace gas: China, 200510085638.0[P]. 2006-01-25.
[7] 宁平, 殷在飞, 陈玉保.一种密闭电石炉炉气净化的方法: 中国, 200610010705.7[P]. 2006-09-13.NING Ping, YIN Zai-fei, CHEN Yu-bao. A method of purifing of airtight calcium-carbide furnace tail gas: China,200610010705.7[P]. 2006-09-13.
[8] 张婷, 俞树荣, 冯辉霞, 等. 钴负载凹凸棒石基复合吸附脱硫剂脱除SO2的实验研究[J]. 矿物岩石, 2008, 28(3): 24-28.ZHANG Ting, YU Shu-rong, FENG Hui-xia, et al. Study on desulfurization of SO2by cobal T-containing attapul gite-base desulphurization agent[J]. Journal of Mineral Petrolsal, 2008,28(3): 24-28.
[9] 赵毅, 韩静, 靳小洁. 负载型 TiO2/ACF光催化剂的制备及同时脱硫脱硝实验研究[J]. 华北电力大学学报, 2008, 35(6):108-112.ZHAO Yi, HAN Jing, JIN XIAO-jie. Preparation of TiO2/ACF photocatalyst and experimental studies on simultaneous desulfurization and denitrification[J]. Journal of North China Electric Power University, 2008, 35(6): 108-112.
[10] Azhar M. Regeneration of activated carbon using hot vapors under reduced pressure[D]. Rhode Island: University of Rhode Island, 2000.
[11] Gregg, S J, Sing K S W. Adsorption, surface area and porosity[M]. 2nd. London: Academic Press, 1982.
[12] 谢兰英, Luo L, 李忠. VOCS 在MAC上吸附等温线的测定与拟合[J]. 化工学报, 2006, 57(6): 1357-1363.XIE Lan-ying, Luo L, LI Zhong. Measurement and simulation of adsorption isotherms of VOCSon MAC[J]. Journal of Chemical Industry and Engineering (China), 2006, 57(6): 1357-1363.
[13] Pan H, Ritter J A, Balbuena P B. Examination of the approximations used in determining the isosteric heat of adsorption from the Clausius-Clapeyron equation[J]. Langmuir,1998, 14(21): 6323-6327.
[14] 郭波, 常丽萍, 李春虎, 等. 活性炭对CO和CO2的吸附行为研究[J]. 太原理工大学学报, 2006, 37(3): 338-341.GUO Bo, CHANG Li-ping, LI Chun-hu, et al. Study on ion selectivity of nickel hexacyanoferrate thin films for electrochemically switched ion exchange[J]. Journal of Taiyuan University of Technology, 2006, 37(3): 338-341.
[15] 余琼粉, 易红宏, 唐晓龙, 等. 磷化氢在改性13X分子筛上的吸附行为[J]. 化学工程, 2009, 37(12): 1-4.YU Qiong-fen, YI Hong-hong, TANG Xiao-long, et al.Adsorption characteristics of phosphine on modified 13X molecular sieve[J]. Chemical Engineering (China), 2009, 37(12):1-4.

