壳聚糖对黄瓜苗期猝倒病的防控效果
谌江华,陈若霞,李 斌
(1.浙江省宁波市农业科学研究院,浙江 宁波 315040;2.浙江大学生物技术研究所,浙江 杭州 310029)
黄瓜苗期猝倒病是黄瓜育苗中的常见病害,一般苗床发病率为20%~50%,严重时可达80%以上[1]。特别是在设施栽培条件下,黄瓜苗期猝倒病发生更加普遍,危害日趋严重,已成为影响黄瓜育苗的首要问题。黄瓜苗期猝倒病主要由腐霉菌(Pythium spp.)引起,生产上主要采用甲霜灵拌种或土壤处理来防治。化学农药虽能在一定程度上防控该病,但同时也带来了农药残留超标、环境污染和病害抗药性等一系列问题[2]。壳聚糖(chitosan)是甲壳素 (chitin)脱乙酰基后形成的一种高分子阳离子多聚糖,广泛存在于真菌的细胞壁及虾、蟹等甲壳动物外壳中。壳聚糖能诱导植物产生多种抗病性反应[3-5],对多种植物病原微生物有明显的抑制作用[6-8]。此外,壳聚糖具有无毒、施用后可被土壤微生物完全降解,不会对土壤微环境造成不利影响等优点,这使其有可能作为一种新型的绿色农药在农业生产中发挥重要的作用[9]。近年来,关于壳聚糖诱导植物抗病反应和对一些植物病原菌抑制作用的研究已有不少报道,但有关壳聚糖不同产品不同浓度对蔬菜苗期猝倒病的防控效果则未见系统报道。本研究以黄瓜种子为试验材料,通过壳聚糖不同产品、不同浓度的离体抑菌活性和活体条件下不同产品、不同施用量对黄瓜猝倒病的防控效果的研究,为黄瓜的无公害栽培,特别是壮苗培育提供一定的技术依据。
1 材料与方法
1.1 材料
供试壳聚糖:壳Ⅰ (国药集团化学试剂有限公司生产),壳Ⅱ (上海蓝季科技发展有限公司生产),壳Ⅲ (浙江仙居县滕旺壳聚糖厂生产),3种壳聚糖均为白色粉末,脱乙酰度大于95%。
供试病原菌为黄瓜猝倒病菌瓜果腐霉(Pythium.aphanidermatum),FC42菌株,由浙江大学生物技术研究所提供。
供试黄瓜种子品种为津绿4号 (引自天津黄瓜研究所)。洗去黄瓜种子表面的种衣剂,并用75%酒精消毒1 min后,放入温水中浸种3 h,然后用纱布包裹放到30℃培养箱中催芽24 h后用于播种。
1.2 方法
1.2.1 壳聚糖母液的配制
准确称取一定量壳聚糖溶于2%冰醋酸溶液,pH调至6.5,配制成5 mg·mL-1的壳聚糖母液,121℃高压蒸气灭菌30 min后备用。
1.2.2 壳聚糖离体抑菌效果的测定
壳聚糖离体抑菌效果测定采用平板含毒介质法。将预先做好的PDA培养基熔化,当培养基冷却至50℃左右时,分别加入适量的壳聚糖母液,制 成 0.2,0.4,0.6,0.8,1.0,1.2 和 1.5 mg·mL-17个不同浓度的含壳聚糖 PDA培养基,迅速摇匀后倒入9 cm直径的培养皿中,制成含毒PDA平板。在平板中央接上1块0.5 cm直径的1日龄PDA腐霉菌饼。试验设不加壳聚糖溶液为空白对照 (CK),每处理平板重复3次。接完菌后,放入25℃培养箱中黑暗培养,24和36 h后,十字交叉法测量菌落直径2次,求平均值。根据下式计算出抑制率。
抑制率 (%) =[(CK的菌落直径-处理菌落直径)/(CK菌落直径-5)]×100。
1.2.3 壳聚糖防控黄瓜苗期猝倒病效果的活体测定
壳聚糖防控黄瓜苗期猝倒病效果的活体测定采用毒土法。以高温灭菌土壤为基质,拌入壳聚糖,拌好后装于育苗盘内,然后将催好芽的黄瓜种子播于育苗盘的土上,种子旁边接种1块0.5 cm直径的1日龄PDA腐霉菌饼,菌面朝下,盖土,盘内加适量去离子水以保持土壤湿润。试验设壳Ⅰ不同施用量处理和不同壳聚糖产品0.5 g·kg-1处理2组试验。第1组试验设不接菌 (CK)、腐霉、腐霉+ 壳Ⅰ 0.25 g·kg-1、腐霉 + 壳Ⅰ 0.5 g·kg-1和腐霉 +壳Ⅰ 1.0 g·kg-15个处理;第2组试验设不接菌 (CK)、腐霉、腐霉+壳Ⅰ、腐霉+壳Ⅱ和腐霉+壳Ⅲ 5个处理。重复3次,每重复24穴,每穴1颗黄瓜种子。
将处理好的育苗盘放入人工气候箱中培养。培养条件为白天16 h和21℃,黑暗8 h和19℃,相对湿度85%,光照强度为10只BMC T5-25 W灯管,7 000 lx左右。各处理出苗后调查出苗率、发病率。收集健康植株,洗净泥土后放入80℃烘箱中烘干24 h,最后分别称量根、茎干重,计算单株根、茎干重。
1.3 数据分析
试验数据用唐启义等[10]的 DPS软件采用邓肯氏新复极差法 (DMRT)进行统计分析。
2 结果与分析
2.1 壳聚糖对腐霉菌的离体抑菌效果
离体抑菌试验结果表明,壳聚糖对腐霉菌具有直接的抑制作用。壳聚糖对腐霉菌的抑制率与壳聚糖的浓度呈正相关,浓度越大抑制率越高。不同壳聚糖产品对腐霉菌的抑制效果不同。3种壳聚糖中壳Ⅱ的抑制效果最好,0.8 mg·mL-1浓度24 h的抑制率即达100%,壳Ⅰ和壳Ⅲ的抑制效果较差,1.5 mg·mL-1浓度的抑制率才达 100% (表 1)。另外,比较培养24和36 h的结果发现,壳聚糖对腐霉的抑制效果随培养时间而变化,培养时间延长,抑制率降低。综合以上结果可以看出,壳聚糖抑制腐霉菌菌丝生长受到壳聚糖产品自身品质、壳聚糖溶液浓度和培养时间的影响。

表1 壳聚糖离体抑菌的效果
2.2 壳聚糖对黄瓜猝倒病的活体防控效果
壳Ⅰ活体控病试验结果表明,土壤中施用壳聚糖对黄瓜猝倒病有较好防控效果。壳聚糖不同施用量对黄瓜猝倒病的防控效果不同 (表2)。施用0.5 g·kg-1壳聚糖对黄瓜猝倒病能起到较好的防控效果,处理后3 d的出苗率为65.28%,显著高于腐霉处理的6.94%,处理后7 d猝倒病发病率显著下降,为35.97%。壳聚糖施用量提高到1.0 g·kg-1时,防控效果则更加显著提高,3 d后出苗率达76.39%,7 d后防治效果达80.21%。根、茎干重结果分析表明,壳聚糖施用后,植株生长增强,根、茎干重显著高于腐霉处理。

表2 壳聚糖不同施用量对黄瓜猝倒病的防控效果
试验结果还表明,不同壳聚糖产品对黄瓜猝倒病的防控效果差异明显,且不同时段防控效果不同。3种壳聚糖中壳Ⅱ在出苗前对猝倒病的防控效果较好,出苗率为72.22%,显著高于壳Ⅰ和壳Ⅲ,但出苗后壳Ⅱ的防控效果则不如壳Ⅰ和壳Ⅲ,出苗后7 d的防效为45.86%,明显低于壳Ⅰ和壳Ⅲ的58.13%和56.41%,根、茎干重也低于壳Ⅰ和壳Ⅲ (表3)。综合以上试验结果可以得出,壳聚糖对蔬菜猝倒病的活体防控效果除受到壳聚糖的施用量影响外,自身的品质也很重要。
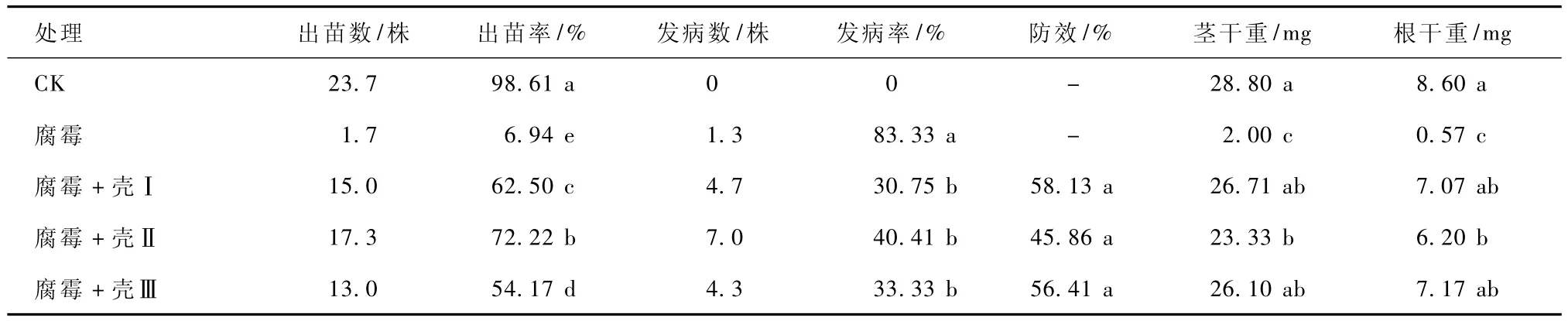
表3 不同壳聚糖对黄瓜猝倒病的防控效果
3 小结与讨论
离体抑菌试验结果表明,壳聚糖直接抑制黄瓜苗期猝倒病菌的生长,但抑制效果因壳聚糖产品理化性质、使用浓度及培养时间的不同而异。供试3种壳聚糖中壳Ⅱ对腐霉菌的抑制效果要好于壳Ⅰ和壳Ⅲ,壳Ⅱ采用0.8 mg·mL-1试验浓度,在 PDA上培养24 h的抑制率可达100%,显著高于壳Ⅰ和壳Ⅲ相同试验浓度PDA上培养24 h的抑制率。壳聚糖低浓度时,抑制率随浓度增加而提高。培养时间延长,抑制率下降。
活体控病试验结果表明,壳聚糖在活体条件下对黄瓜苗期猝倒病有较好的防控作用,其防控效果与壳聚糖的施用量呈正相关关系,土壤中添加0.5 g·kg-1壳聚糖对黄瓜猝倒病能起到较好的防控效果,施用量提高到1.0 g·kg-1,防控效果明显提高,根、茎干重均显著增加。不同产品壳聚糖对黄瓜猝倒病的防控效果差异显著。同时,壳聚糖自身作为一种有机物质,对植物的生长具有明显的促进作用。
已有的研究表明,壳聚糖防控植物病害的机制主要有2个方面。一方面是壳聚糖对植物病原菌的直接抑制作用,壳聚糖为甲壳素的多聚阳离子衍生物,可与病原菌细胞表面的带负电的物质 (如蛋白质等)相互作用,形成聚合物影响病原菌细胞膜的正常生理功能,同时壳聚糖还可直接进入病原菌细胞内与胞内蛋白质和核酸等物质相互作用,干扰细胞正常代谢,从而抑制病原菌的生长[11];另一方面,壳聚糖还能诱导植物产生广谱抗性的机制。施用壳聚糖直接抑制病原菌生长或诱导植物产生抗病反应,是提高植物对病害的抗性,减少化学农药施用量的有效途径。壳聚糖无毒、无害、来源丰富,是农产品无公害生产中极具应用潜力和有待开发的一种环保型农药和植物抗病诱导物,具有广阔的应用前景。
[1]楼兵干,张炳欣,Maarten R,等.黄瓜苗期猝倒病生物防治 [J].植物保护学报,2002,29(2):109-113.
[2]梁建根,张炳欣,陈振宇,等.促生菌CH1诱导黄瓜对猝倒病抗性的研究 [J].园艺学报,2006,33(2):283-288.
[3]El Ghaouth A,Arul J,Grenier J,et al.Effects of chitosan on cucumber plants:suppression of Pythium aphanidermatum and induction of defense reactions [J].Phytopathology,1994,84:313-320.
[4]Benhamou N,Lafontaine P J,Nicole M.Induction of systemic resistance to fusarium crown and root rot in tomato plants by seed treament with chitosan [J].Phytopathology,1994,84:1432-1444.
[5]廖春燕,马国瑞,洪文英.壳聚糖诱导番茄对早疫病的抗性及其生理机制 [J].浙江大学学报:农业与生命科学版,2003,29(3):280-286.
[6]Hirano S,Nagao N.Effects of chitosan,pectic acid,lysozyme and chitinase on the growth of several phytopathogens [J].Agricultural Biology and Chemistry,1989,53(11):3065-3066.
[7]Pospieszny H.Antiviroid activity of chitosan [J]. Crop Protection,1997,16(2):105-106.
[8]杨玲玉,孟祥红,刘成圣,等.壳聚糖的抗菌性及其对果实病害的防治研究进展 [J].中国农业科学,2009,42(2):626-639.
[9]马鹏鹏,何立千.壳聚糖对植物病害的抑制作用研究进展[J].天然产物研究与开发,2001,13(6):82-86.
[10]唐启义,冯明光.实用统计分析及其 DPS数据处理系统[M].北京:科学出版社,2002.
[11]Sudarshan N R,Hoover D G,Knorr D.Antibacterial action of chitosan [J].Food Biotechnology,1992,6(3):257-272.

