对一道高考化学试题的质疑—Mg2+、Al3+能同时沉淀吗?
叶建坤 赵爱丽
(宜兴市阳羡高级中学 江苏 宜兴 214200)
在每年的高考复习中,无论使用何种版本的资料,均出自名家之手,各有其特色。这些资料中有许多原创题,也往往会引用一些经典题和历年高考中的典型试题。由于中学化学对许多问题侧重于从定性的角度分析,很少从定量的角度去考虑,命题人常常会依据定性原理,拟制出一些供高中学生学习、训练的习题,这些习题为各种资料引用,时间长了便成为经典题目固定了下来,为人们广泛认同,有些问题由于缺少定量分析,命题人极易进入命题误区,人为拟制出一些与实际事实不符的习题来,以讹传讹,甚至出现在严肃的高考题目中,如Mg2+、Al3+同时沉淀的问题。下面以2009年四川理综的一道高考题为例加以说明:
(2009年四川理综高考,11,6分) 向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入cmol/L氢氧化钾溶液Vml,使金属离子刚好沉淀完全,得到的沉淀质量为ng。再将得到的沉淀灼烧至质量不再改变为止,得到固体pg,则下列关系不正确的是 ( )
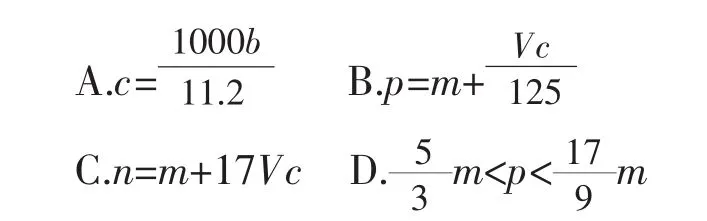
原题答案:C
解析:根据题意,反应过程如下:
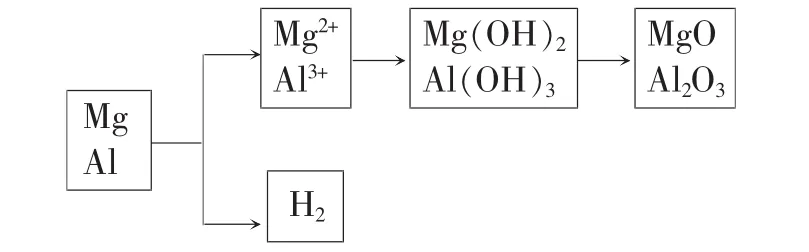


从本题的题意和解题分析来看,认为Mg2+和Al3+中加碱同时生成氢氧化物沉淀,笔者认为本题的命题依据不够科学,其标准答案值得商榷,和实际事实不符。事实上Mg2+和Al3+生成氢氧化物沉淀是分步进行的,不可能同步沉淀完全。下面从定量的角度分析如下:(为计算方便,Mg2+和Al3+的浓度均为0.1mol/L)
一、金属离子开始沉淀的pH

二、金属离子完全沉淀的pH
通常某离子在溶液中的浓度降到10—5mol/L以下,一般鉴定反应便难以检出,因而可以认为该离子已沉淀完全。 设沉淀完全时c(Al3+)=1×10—5mol/L,c(Mg2+)=1×10—5mol/L。
(1)Al3+完全沉淀的pH

(2) Mg2+完全沉淀的pH
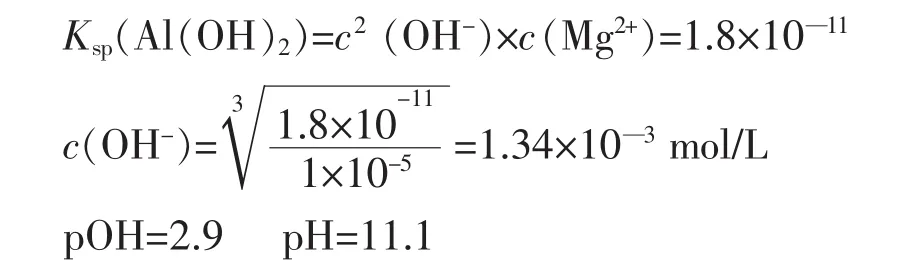
三、由于Al(OH)3具有两性,当在Al(OH)3浊液中加入酸或碱时, 只要 c(H+)×c(OH-) > KW 时Al(OH)3便开始溶解,可计算出最小的 c(OH-) 或c(H+),本题中是加碱。
(1)Al(OH)3开始溶解的pH:
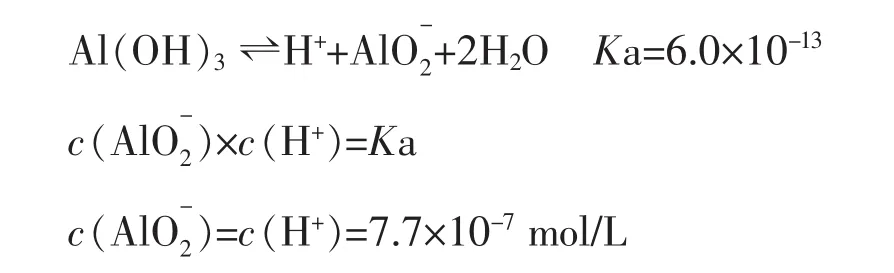
(2)Al(OH)3完全溶解时,溶液的pH也可计算得出:
若1L溶液溶解的Al(OH)3以0.2 mol计算,溶解度大约为1.56g/100g,达到可溶范围。

即当pH≥11.5时,Al(OH)3完全溶解。
以上计算归纳如下表:
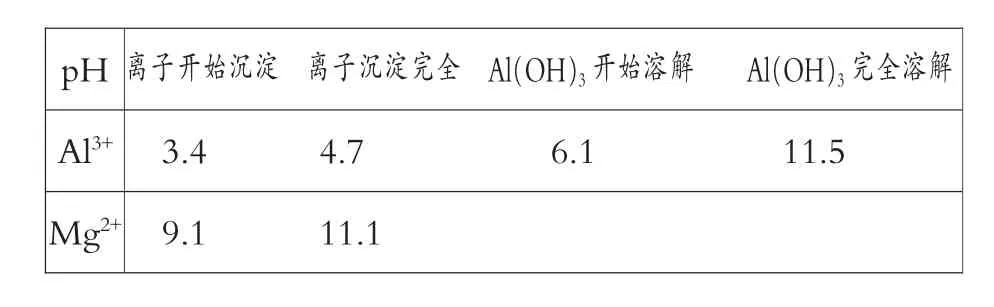
pH 离子开始沉淀 离子沉淀完全 Al(OH)3开始溶解 Al(OH)3完全溶解Al3+ 3.4 4.7 6.1 11.5 Mg2+ 9.1 11.1
从上面的定量分析结果上可以看出:
当Al(OH)3完全沉淀时,Mg(OH)2还未开始沉淀;当Mg(OH)2开始沉淀时,Al(OH)3已部分溶解;当Mg(OH)2完全沉淀时,Al(OH)3已溶解得差不多了。所以Mg2+和Al3+是不可能同步沉淀完全的。
由此笔者认为本题是命题老师依据高中学生已有知识编造的题目,可以肯定地说是不符合实验事实的,诚然其中有些知识高中学生并不知晓,但作为一道严肃的高考题,必须以科学知识为前提,创意不能违背科学常识。
高考试题在考虑选拔功能的同时,必须考虑试题本身的科学性和严谨性。由于高考题的影响力和对高中教学的导向作用,使得这一类型的试题广泛、长久地运用于教师教学中,以及为各种教辅资料所引用,作为一种对学生的思维训练手段,是有其一定作用,但当我们的学生进入高校,学习了相关知识以后,将对以往学过的知识产生疑问,其负面作用是很大的。在倡导素质教育、开展研究性学习的今天,人为编造、与实验事实相违背的题目,作为经典题型流行在各种资料中,是不恰当的,建议命题时最好避开此类问题。
[1]编写组.2009年高考题模拟题分类详解[M].北京:首都师范大学出版社,2009
[2]林铠.漫谈氢氧化铝的两性[J].化学教学,2005,(10)
[3]华中师院等合编.分析化学[M].北京:人民教育出版社,1981
[4]B.A拉宾诺维奇.尹承烈译 .简明化学手册[M].北京:化学工业出版社,1983.10


