研读化学新情境 巧解氧化还原题
——近三年上海高考化学试卷氧化还原试题解析
何红英
(靖江市第四中学 江苏 靖江 214500)
新一轮的课程改革从知识与技能、过程与方法、情感态度价值观“三维”描述了课程的目标。分析近几年的上海高考趋势会发现:教材是根本,创新是热点,能力是目标。在高考中氧化还原反应是非常重要的化学反应类型,涉及知识的内容广泛、概念众多,在应用时稍不注意就容易出错。现以近三年的上海高考化学试题为例,剖析一下如何“研读化学新情境,巧解氧化还原题”。
1.(2007上海高考化学试题) 氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
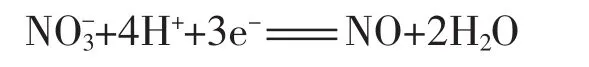
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:___________。
(2)反应中硝酸体现了____、_____性质。
(3)反应中若产生0.2 mol气体,则转移电子的物质的量是_____mol。
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:_____________。
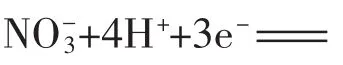
(3)根据NO~3e-,产生0.2molNO,转移0.6mol e-。
(4)因为有NO2生成,所以被还原硝酸的物质的量增加。
2.(2008上海高考化学试卷)某反应体系中的物质有:Au2O、H2O、NaOH、Au2O3、Na2S4O6、Na2S2O3。
⑴请将Au2O3之外的反应物与生成物分别填如以下空格内。

⑵反应中,被还原的元素是____,还原剂是_____。
⑶将氧化剂与还原剂填入下列空格中,并标出电子转移的方向和数目。

⑷纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为_________。
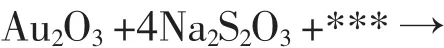
⑵Au Na2S2O3⑶Au2O3Na2S2O3⑷1∶4
3.(2009上海高考化学试卷)某反应中反应物与 生 成 物 有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是__________。
(2)已知0.2 mol KBrO3在反应中得到l mol电子生成X,则X的化学式为__________。
(3)根据上述反应可推知__________。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目________。
解析:(1)本题给出化学新情境AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。 从试题所给的物质,化合价升高的元素为As,所以AsH3是还原剂。
(2)利用得失电子守恒规律。由于KBrO3最后被还原,且价态发生变化的元素是Br,则设最后Br元素的化合价为x,可以列式:0.2(5-x)=1,x=0,所以还原产物为Br2。
(3)由于氧化剂的氧化性大于氧化产物,还原剂的还原性大于还原产物,所以选择a,c。
(4)本题是考查单线桥的表示方法,箭头从还原剂出发,指向氧化剂,在线上标出转移电子数
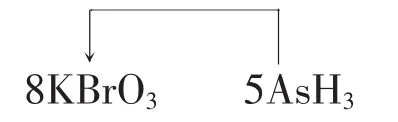
总之,注意准确理解概念和严密思维,学会对反应变化的不确定性、问题的开放性、隐含条件或知识的挖掘等化学新情境的研读,一定能巧解氧化还原反应题。

