有活塞的化学平衡问题的分析与解答
顾小兵
(江苏省兴化市第一中学江苏兴化225700)
有活塞的化学平衡问题的分析与解答
顾小兵
(江苏省兴化市第一中学江苏兴化225700)
有活塞的化学平衡问题是高中化学学习的难点之一,解决的方法是根据题目所给条件,从化学平衡基本原理入手,用等效平衡模式进行分析,注重始终态的研究。下面以两个习题为例,探究解题思路。
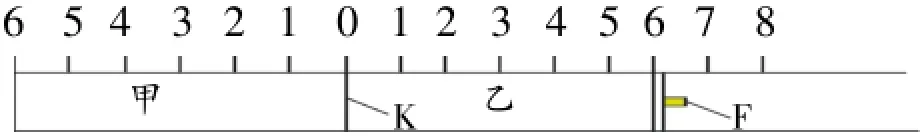
例1:(Ⅰ)如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)⇌2C(g);反应达到平衡后,再恢复到原温度。回答下列问题:
(1)可根据现______________象来判断甲、乙都已达到平衡。
(2)达到平衡时,隔板K最终停留在0刻度左侧a处,则a的取值范围是______________。
(3)若达到平衡时,隔板K最终停留在左侧刻度1处,则甲中C的物质的量为_______mol,乙中C的转化率_______50%(填<、>、=),此时,乙中可移动活塞F最终停留在右侧刻度_______处(填<6、>6、=6)。
(4)若达到平衡时,隔板K最终停留在左侧刻度靠近0处,则乙中可移动活塞F最终停留在右侧的刻度不大_______于;若K最终停留在左侧刻度靠近2处,则乙中可移动活塞F最终停留在右侧的刻度不小于_______。
(Ⅱ)若一开始就将K、F固定,其他条件均不变,则达到平衡时:
(1)甲、乙中C的物质的量的分数是甲_______乙(填<、>、=);
(2)测得甲中A的转化率为b,则乙中C的转化率为_______;
(3)假设乙、甲容器中的压强比用d表示,则d的取值范围为_______。
分析:此题是一道化学平衡的综合题,包括等效平衡、恒温恒压、恒温恒容下稀有气体的充入对恒温恒压、恒温恒容下平衡的影响,能力要求较高。
(Ⅰ)为恒温恒压状态
解:(1)根据平衡时各组分的浓度不再发生变化,可推出活塞K、F不再移动来判断甲、乙都已达到平衡。
(2)求a的范围,用极值的思路。若不发生反应,活塞不动,a=0;若A、B完全转化,生成2molC,容器的体积变为原来的2/3,活塞左移,a=2,所以A的取值范围为0<a<2。
(3)隔板K最终停留在左侧刻度1处,则平衡时甲中A气 体总的物质B的量为2.5mol,根据差量得到生成C1mol。根据等效平衡原理,若乙中只充入2molC,应与甲中平衡相同,C的转化率为50%。1molHe的充入,使活塞右移,相当于减小压强,平衡向左移动,C的转化率增大,所以大于50%。这样乙容器中的气体总的物质的量大于2.5+ 1=3.5mol,所以活塞F最终停留在右侧刻度>6处。
(4)若达到平衡时,隔板K最终停留在左侧刻度靠近0处,说明甲中气体物质的量接近3mol,则乙中气体物质的量接近3+1=4mol,这样活塞F最终停留在右侧的刻度不大于8;同理,若K最终停留在左侧刻度靠近2处,说明甲中气体物质的量略大于2mol,则乙中气体物质的量略大于2+1= 3mol,则乙中可移动活塞F最终停留在右侧的刻度不小于4。
(Ⅱ)为恒温恒容状态
(1)先建立一个中间状态,将K、F固定,甲中充入2molA和1molB,乙中充入2molC,由于容积相同,根据等效平衡原理,两容器中的平衡状态是相同的。此时再向乙中充入1molHe,但对平衡没有影响,所以甲、乙中C的物质的量的分数相同。
(2)根据甲中A的转化率为b,计算得到平衡时C的物质的量为2b,则乙中平衡时C的物质的量为2b,C的转化率为(2-2b)/2=1-b。
(3)求d的范围还是运用极值的思路。若两容器中全部是A和B,则乙中气体的物质的量为3+ 1=4mol,甲中气体的物质的量为3mol,此时d=4/ 3;若两容器中全部是C,则乙中气体的物质的量为2+1=3mol,甲中气体的物质的量为2mol,此时d= 3/2;所以4/3<d<3/2。
例2:如下图所示,温度不变下某容器分隔A、B两部分,A容积固定不变,B有可移动的活塞。现在A中充入2molSO2和1molO2,在B中充入2molSO3和1molN2,在相同条件下发生可逆反应:2SO2(g)+O2(g)⇌2SO3(g),根据要求填写空白:
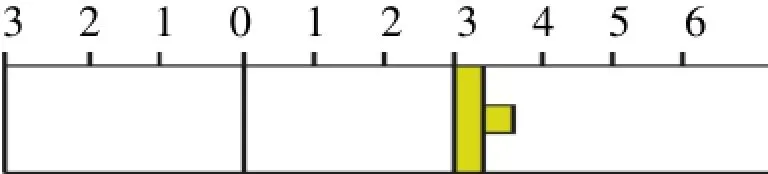
(1)固定活塞位置在3处不动,达到平衡时,则两部分的压强PA、PB的关系为PA_______PB(填<、>、=);
(2)若要使A中与B中平衡状态相同,可移动活塞的位置应在_______处;
(3)若活塞右移到5处,达到平衡后,B中SO3为xmol,A中SO3为ymol,则之间的关系为____(填<、>、=)。
解:(1)恒温恒容时,固定活塞位置在3处不动,A、B两部分的容积相同。若A中充入2molSO2和1molO2,在B中充入2molSO3,根据等效平衡原理,达到平衡时,两部分完全相同。再在B中充入1molN2,由于容积不变,所以平衡不移动,但容器里的压强增大。所以PA<PB。
(2)根据以上的分析,可移动活塞的位置在右侧“3”处时,A、B两部分的平衡相同。
(3)若活塞右移到5处,可看作达到上述平衡时,将活塞右移,相当于压强减小,平衡逆向移动, B中SO3的物质的量减小,所以x<y。
通过以上两个例题的分析,这种类型的问题如果能化为恒温恒压或恒温恒容的等效问题去思考,也就不难解决了。
文章编号:1008-0546(2010)03-0079-02中图分类号:G632.46
文献标识码:B
doi:10.3969/j.issn.1008-0546.2010.03.035
——一个解释欧姆表刻度不均匀的好方法

