慢性肾脏病在社区的筛查和干预——困惑与挑战
阮 晶,黄 萍,林 洁,田顺立,汪 涛
慢性肾脏病 (CKD)的发病率逐年升高并已经成为威胁全世界公共健康的主要疾病之一。由于慢性肾脏病具有发病率高、知晓率低的特点,往往在肾功能受损到了晚期才被发现。我国目前尚无详实的慢性肾脏病流行病学调查数据。早期发现是防止慢性肾脏病进展的重要措施。为了解社区全科医生作为CKD防治的重要管理者在慢病管理中所面临的困惑,特将北京大学医学部医院开展的 CKD筛查、干预过程和发现的问题总结如下。
1 资料与方法
1.1 研究对象 2008年 5月—2009年 10月,选择在北京大学医学部医院门诊就医的 608例高血压患者为研究对象,对其行常规肾功能检查。同时监测患者 3个月尿常规情况。根据以下诊断标准判断患者是否患有 CKD。
1.2 CKD诊断标准 根据美国肾脏基金会在 2002年制定的K/DOQI(dialysis outcome qualify initiative,慢性肾脏病及透析的临床实践指南)将 CKD定义为:(1)肾脏损害 (肾脏的结构与功能异常)伴或不伴有肾小球滤过率 (GFR)下降≥3个月。(2)GFR<60 ml/(min·1.73 m2)≥3个月,伴有或不伴有肾脏的损害。根据肾脏受损程度将 CKD分期描述 (见表1、表 2)。MDRD公式计算仍依据 2002年 K/DOQI指南的建议:成年人推荐使用 MDRD公式计算肾小球滤过率 (eGFR)。
1.3 方法 血肌酐的检查采用脲酶法、碱性苦味酸速率法;尿常规 10项采用德国 Bayer公司生产 CLINITEK-50尿分析仪检测。按 2005年 《中国高血压防治指南》血压诊断标准确定高血压人群,根据不同疾病及相关并发症,患者血压控制标准有所不同,如 1年中≥9个月血压控制为达标:(1)普通高血压患者经治疗后血压严格控制在 <140/90 mm Hg(1 mm Hg=0.133 kPa);(2)糖尿病合并高血压的控制目标:<130/80 mm Hg;(3)心脑血管病及糖尿病肾病患者血压控制目标:<125/75 mm Hg;(4)老年人 (≥60岁)收缩压降至 <150 mm Hg。根据其血压控制标准评价干预效果。
2 结果
2.1 高血压患者 608例中,肾功能不同程度受损者共计 287例 (47.2%),男 152例,女 135例,平均年龄 63.8岁。符合CKD诊断标准者 145例,高血压人群中筛查 CKD的患病率为23.8%。其中 CKD 1期 8例;2期 186例 〔尿常规异常者 52例 (28.0%)〕;3期 87例 〔血肌酐增高者 15例 (17.2%),血肌酐≥131μmol/L〕;4期 5例;5期 1例 (4期、 5期均为以往经肾穿刺及影像学或病理学检查已确诊的 CKD病例)。
2.2 对血肌酐正常以往并未确诊 CKD的 58例患者,根据MDRD公式计算 eGFR<90 ml/(min·1.73 m2),给予进一步分析:其中eGFR在 60~89 ml(min· 1.73 m2)者 27例 (男16例,女 11例;尿常规异常者 8例);eGFR在 30~59 ml(min·1.73 m2)者 31例 (男 10例,女 21例;尿常规异常者7例),既往血肌酐正常且未诊断 CKD的 58例患者,根据公式计算有 39例 (66.2%)患者 eGFR下降。这 58例患者中高血压合并糖尿病 15例。
2.3 在对 CKD患者管理过程中对持续性血尿、蛋白尿及血肌酐≥131μmol/L的患者及时转诊到三级甲等医院肾内科,治疗后病情改善者 23例。经改变生活方式、对患者进行健康教育和膳食指导及适当调整临床用药后使患者血压、血脂和血糖尽可能达标。在 2009年 1—7月随访复诊的 48例 CKD 3期患者中,初始评估 CKD 3期均转为 CKD 2期有 23例 (47.9%)经过生活方式干预 (尤其限盐)配合治疗原发病,使其患者eGFR水平有所回升;原处于 CKD 2期复诊患者 50例中有 5例转为 1期,好转率为10.0%。

表 1 GFR分期与 CKD分期对比Table 1 Comparison of GFR and CKD stages
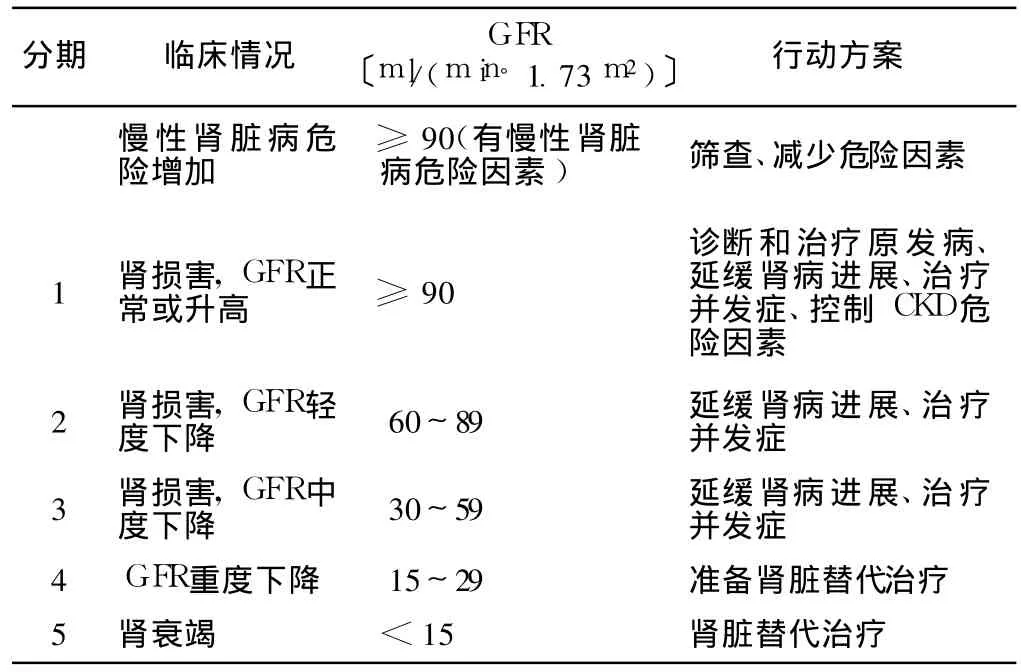
表 2 CKD分期及行动方案Table 2 CKD Stages and Treatments
3 讨论
CKD已经成为威胁全世界公共健康的主要疾病之一,在发达国家中 (如美国和荷兰),普通人群中有 6.5%~10.0%的人患有不同程度的肾脏疾病,其中美国的肾脏病患者已经超过 2 000万,医院每年收治肾脏病患者高达 100多万,而患了肾脏病未去就医的人数要比收治的患者数大得多[1]。我国目前尚无详实的 CKD流行病学调查数据,初步结果显示:40岁以上人群 CKD的患病率为 10.0%左右,而高血压、糖尿病等慢性疾病患者是其重要的危险人群。据统计全世界导致终末期肾病需要透析治疗的患者中糖尿病患者占 50.1%,高血压患者占 27.0%,肾小球肾炎患者仅占 13.0%[2-3]。CKD如果不积极有效控制可进展为尿毒症,治疗费用高昂,已经成为全社会的一个沉重负担[4]。
研究表明:CKD的进展是可以预防的,越是早期预防,越能有效控制疾病的进展[4]。然而,很多 CKD患者早期无特异性症状,发展为尿毒症才被发现患有 CKD,延误了疾病的诊断与治疗。因此 CKD又称为 “沉默的杀手”。一旦患病,往往伴随终生。CKD与高血压、糖尿病一样被称为是生活方式疾病,因此在社区层面的早期预防和管理就显得非常重要[5]。
一般认为:社区是控制慢性非传染性疾病的主战场[5]。合理的疾病预防措施可以有效降低医疗费用。对 CKD实施社区预防策略,理论上将延缓 CKD的进展,提高 CKD患者的生活质量,同时可以预防 CKD患者各种并发症特别是心血管并发症的发生。
近 2年来,北京大学医学部医院在北京市社区卫生协会和三级甲等医院的带领下,进行社区 CKD的筛查和预防、干预工作。肾脏功能的检查和分期的确定是 CKD筛查的重要部分,菊粉清除率是估计 GFR的金指标,但它仅限于实验室使用。临床上通常收集 24 h尿液检查肌酐清除率或用公式计算eGRF。24 h尿液检查肌酐清除率既不准确也费时。因此临床上常用公式估算 GFR,近年研究表明 MDRD公式可以有效地估算肾小球的滤过率,并广泛地应用于临床筛查。在这次北京社区 CKD筛查中推荐使用 MDRD公式。通过本次筛查,参加的患者对 CKD的认识比筛查前提高了很多。
本研究同时表明使用公式判断患者 GFR的方法仍存在一定问题。笔者发现使用该公式后,在本社区管理的高血压、糖尿病等危险人群中,有47.2%的患者 GFR低于 90 ml/(min·1.73 m2),仅有 28.0%的患者有尿常规异常。值得注意的是,在血肌酐正常,原先以为肾功能正常的 58例患者中,有67.2%的患者用公式计算显示 GFR下降,这些患者中大多数尿常规检查没有异常。我们将这些患者转诊到三级医院后也未发现患者的治疗方案发生明显变化。我们知道,尿常规无异常或不伴有肾脏形态学异常者 (本组患者因条件限制肾穿未查情况下),即使 GFR在 60~89 ml/(mim·1.73 m2)范围仍不能诊断 CKD 2期。同时有部分患者血肌酐正常但用 MDRD公式计算显示这些患者为 CKD 3期。作为社区全科医生我们对此深感困惑。诚然,我们不能单纯用血肌酐去衡量肾脏的功能。血肌酐受肌肉的影响,后者又受性别、年龄、种族、肾小管功能等的影响而不能完全代表 GFR水平。不同的肌肉状态下,血肌酐在参考值的高限水平时 GFR可能在参考值的 25%~100%,因此对于非肾脏专科医护人员往往难以识别。
不过,临床实践中我们也清醒地认识到,MDRD公式是在已经确诊为 CKD而且肾功能损害的患者 〔平均 GFR在 40 ml/(min·1.73 m2)〕中产生出来的。研究表明:它不但受种族的影响,更重要的是在肾功能接近正常的人身上是不准确的[6],对于一个 eGFR为60 ml/(mim·1.73 m2)的患者,他的真实 GFR值可能在 35 ~90 ml/(mim·1.73 m2)。此外,令人值得注意的是:用 MDRD公式公式计算在老年人 (70岁以上)、营养不良的患者、高血压和糖尿病患者以及心力衰竭患者中并未得到很好的验证。因此,尽管我们仍将 MDRD计算的eGFR值作为同一个患者随访跟踪分析的指标来反映肾功能的变化,但将该公式计算的 eGFR值用于肾脏病筛查可能将导致对 CKD威胁的扩大化,如不合理分析,并不利于肾脏病的防治和医疗保健资源的合理使用。我们更不能将 eGFR值作为肾脏功能的金标准。特别是对于 eGFR在 30~89 ml/(mim·1.73 m2)的人群,我们认为 eGFR和血肌酐的意义间差别并不大。
尽管我们也认为,筛查这些患者,哪怕是错误地把他们定义为 CKD患者可能有利于我们对疾病的管理,如:血压的控制、肾脏功能的监测、并发症的防治等。中国人历来以警觉性高、自主性强而著称。当知晓如果不认真控制高血压、糖尿病等相关疾病,前面有肾透析的结局在守候时,患者依从性及主动参与自身疾病管理与控制的自觉性将会明显提高,说明了CKD筛查和干预项目的魅力。
但同时考虑到社会对 CKD的认识,如给患者扣上 CKD的帽子,将给其带来不必要的心理上的压力,甚至导致不必要的使用过多的药物。一项英国的研究表明,尽管在一个人群中肾功能有损害 (血肌酐男性 >180μmol/L,女性 >135μmol/L),这些患者中绝大多数肾功能损害进展缓慢而不发展到尿毒症[7]。一项挪威的研究也表明尽管 CKD 3~5期的患病率为4.7%(大多数为 70岁以上患者),真正进展到尿毒症的患者是少数,有 0.04%的 CKD 3期患者,0.20%的 CKD 4期和2.60%的 CKD 5期进展为尿毒症[8]。
本研究表明:目前用于社区筛查 CKD的方法值得商榷,可能会过高地估计 CKD的存在,造成对医疗资源的不合理使用。但是另一方面,当患者得知自己面临 CKD风险时,其对疾病的治疗和改变不良生活方式的积极性有明显的改善。因此把握这两方面的平衡非常重要。
1 Stevens LA,Fares G,Fleming J,et al.Low rates of testing and diagnostic codes usage in a commercial clinical laboratory:evidence for lack of physician awareness of chronic kidney disease[J].JAm Soc Nephrol,2005,16(8):2439-2448.
2 Li ZY,Xu GB,Xia TA,et al.Prevalence of chronic kidney disease in a middle and old-aged population of Beijing[J].Clin Chim Acta,2006,366(1/2):209-215.
3 Zhang L,Zhang P,Wang F,et al.Prevalence and factors associated with CKD:a population study from Beijing[J].Am J Kidney Dis,2008,51(3):373-384.
4 Weiner DE.Public health consequences of chronic kidney disease[J].Clin Pharmacol Ther,2009,86(5):566-569.
5 Wang H,Zhang L,LV J.Prevention of the progression of chronic kidney disease:practice in China[J].Kidney Int,2005,94(Suppl):S63-67.
6 Zuo L,Ma YC,Zhou YH,et al.Application of GFR-estimating equations in Chinese patients with chronic kidney disease[J].Am J Kidney Dis,2005,45(3):463-472.
7 John R,Webb M,Young A,et al.Unreferred chronic kidney disease:a longitudinal study[J].Am J Kidney Dis,2004,43(5):825-835.
8 Hallan SI,Coresh J,Astor BC,et al.International comparison of the relationship of chronic kidney disease prevalence and ESRD risk[J].J Am Soc Nephrol,2006,17(8):2275-2284.

