大学化学中若干平衡问题的理解和思考
吴振玉 裘灵光 宋继梅 李村 朱维菊
(安徽大学化学化工学院 安徽合肥230039)
大学化学中若干平衡问题的理解和思考
吴振玉 裘灵光 宋继梅 李村 朱维菊
(安徽大学化学化工学院 安徽合肥230039)
在教学中,通过引导学生对一些平衡问题的基本概念进行深入思考和讨论,指导学生对有关数学问题进行严密推导和论证,既提高了学生解决实际问题的能力,又培养了学生严密的科学思维和严谨的科学态度。
在大学化学教学中,有关平衡问题的概念和理论涉及热力学平衡、酸碱平衡、沉淀溶解平衡、氧化还原平衡、配位平衡等问题。在教学中,引导学生对一些基本概念进行较为深入的思考和讨论,对其中涉及的一些数学问题,利用其实际物理和化学意义,根据需要对数学公式进行变通和化简,或对涉及的数学问题进行严格的推导和论证,以激发学生的学习兴趣。下面以缓冲溶液pH计算与质子平衡和化学平衡与自发变化为例进行简单介绍。
1 缓冲溶液pH计算与质子平衡
PBE(质子平衡式,proton balance equation)法是计算溶液氢离子浓度的基本依据,通过此法可以得到计算溶液中氢离子浓度的精确计算式,还可以根据一定的条件分别得到近似式和最简式。相关文献[1-6]虽然对PBE的变通写法和化简方法做了一些讨论,但是很少有直接利用PBE计算缓冲溶液pH的方法介绍。因此,我们在教学中引导学生在这方面进行了讨论和思考。以下以一元弱酸HA及其盐NaA(设其初始浓度分别为ca和cb,并设HA电离部分及A-水解部分的浓度分别为x和y)组成的缓冲体系为例,演示PBE的变通写法和直接利用PBE推导缓冲溶液pH计算的精确式、近似式和最简式的变通及化简方法。
首先,写出PBE,利用平衡常数关系找出PBE中各物种的表达式(为简便起见,公式推导中省略c⊖)。
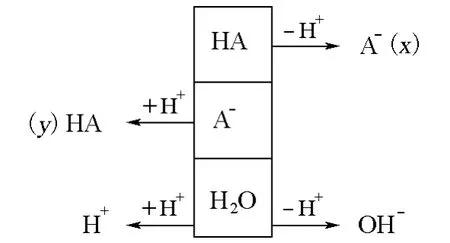
根据PBE的意义可知,该体系的质子平衡式如下:
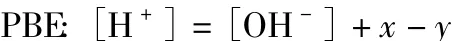
由HA的电离平衡和A-的水解平衡可知ca、cb与x和y的关系如下:
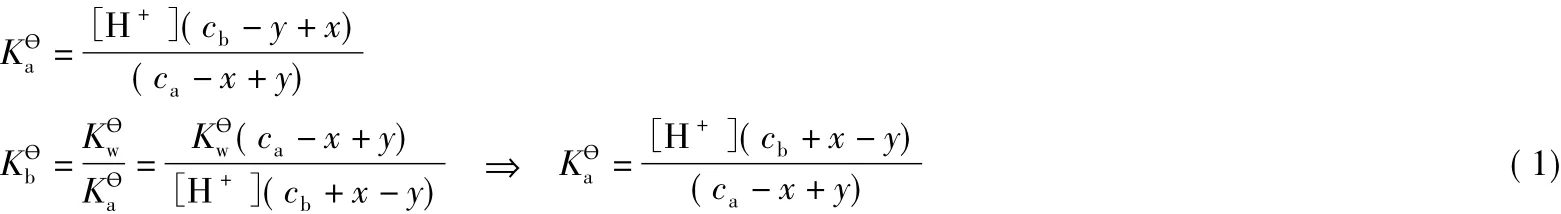
解(1)得:

把式(2)带入PBE中,得到缓冲溶液pH的精确式计算如下:
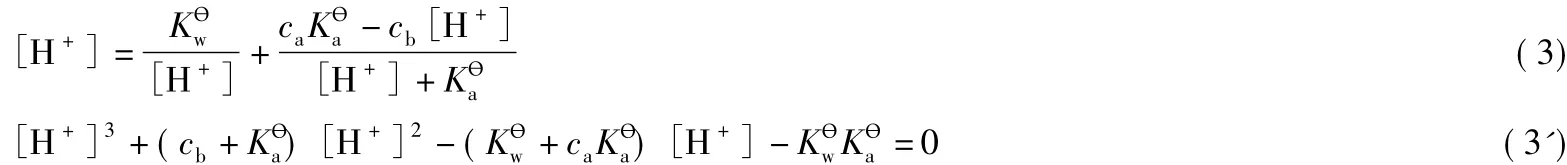
式(3)和式(3')即是缓冲溶液pH计算的精确式。
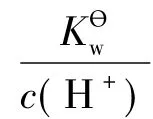

式(4)经整理后为:

当pH>8时,忽略x(电离生成的H+很少,即对应的x也很小),即式(1)和式(2)中去掉x,把去掉x后的式(2)带入PBE的表达式,结果仍然如式(3)。式(3)可整理为如下形式:
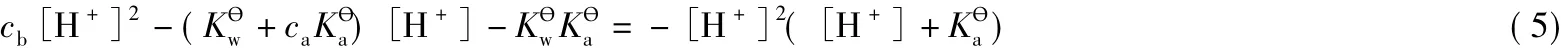
当pH>8时,[H+]2([H+]+)≈0,所以式(5)可变为:

式(6)即缓冲溶液pH的另一种近似计算式。把精确式(3')整理为如下形式:
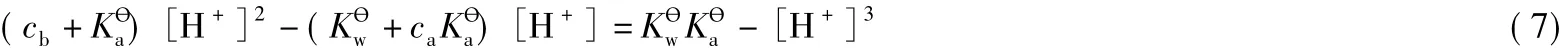
通常情况下,缓冲溶液pH不会太小,而且其ca或cb均较大,远远大于或,也比大得多,即把以上条件带入式(7),得到缓冲溶液pH计算的最简式如下:

以上直接利用PBE推导所得缓冲溶液pH计算的精确式、近似式和最简式与文献[1]一致。通过以上推导引导学生理解和思考缓冲溶液pH计算的问题,不仅可以使学生更好地理解PBE的概念,明白缓冲溶液pH计算中精确式、近似式和最简式的关系,而且可以学会如何对具有实际物理和化学意义的数学公式进行变换,达到解决问题的目的。
2 化学平衡与自发变化
在大学化学教材中[6-10],化学平衡与自发方向这一内容涉及许多基本概念。引导学生对相关概念进行归纳总结,区分其异同,可以准确地理解和掌握这些基本概念。
2.1 自发变化与系统(体系)
一般的大学化学教材[1,7]中,都是用类似“不需外力,任其自然,即可自动进行”的语言描述自发变化,并列举温度传递、浓度扩散、水往低处流、铁生锈等自发变化的实例。但是学生对如反应CaCO3(s)CaO(s)+CO2(g)高温自发的描述不容易理解,既然是高温,必定借助了外力进行加热,怎么又说是自发呢?针对上述问题引导学生从“体系(系统)与环境”这个热力学的基本概念出发,就能够更好地加深理解。上例中高温自发的前提是指我们选择的体系本身已处于高温,符合“不需外力,任其自然,即可自动进行”的自发变化条件,而不需要借助外力再进行加热或降温。可引导学生从本例讨论“体系(系统)”与“环境”的划分。
2.2 各种平衡常数
在确定化学势中各物质的标准态后,把反应系统中各物质的化学势代入系统的Gibbs自由能表达式中,并引入条件fB≈pB,ax,B≈xB,ac,B≈cB,am,B≈mB,可以推导出各种标准平衡常数(热力学平衡常数)。即:①纯气相反应中的标准平衡常数;② 溶液中反应的标准平衡常数、和;③固体溶液中的反应,其标准平衡常数与溶液中反应的热力学平衡常数类似。
应用注意:多相反应的标准平衡常数中,气体用相对分压p/p⊖表示,溶液中的溶质用相对浓度c/c⊖表示,因为对于纯态凝聚相aB=1,所以纯态凝聚相不出现在平衡常数表示式中。另外,还要注意标准平衡常数与Δr对应,经验(或实用)平衡常数Kp,Kc,Kx并不与Δr产生直接的联系,在应用计算中要考虑逸度系数及活度系数时,需要用以逸度或活度表示的平衡常数。
从以上思路引导学生对各种平衡常数进行归纳总结,有助于学生理解和记忆这些繁杂的概念。
2.3 Δr、ΔrGm与K⊖、Q(反应熵)
在学习化学反应等温方程式时,学生很容易混淆概念,把处于Δr时的反应系统与已经达到化学平衡时的反应系统等同起来。事实上,反应系统处于Δr时,Q=1;处于平衡时,Q =K⊖,ΔrGm=0。反应系统处于Δr时,其反应的自发方向取决于该反应的K⊖是大于1还是小于1;大于1则正向自发,小于1则逆向自发。例如酸碱平衡中的和,沉淀溶解平衡中的,配位平衡中的等远远小于1,因此处于Δr时的反应系统,朝着生成弱酸、弱碱、沉淀或配合物的方向自发进行。
2.4 K⊖与和
一般教材中都会讲到几种平衡常数的换算关系,特别是对于气相反应中的与,但是化学反应等温方程式中的K⊖通常并没有给出下标,以限定是标准压力平衡常数还是标准浓度平衡常数。因而学生经常会问:对气相反应而言化学反应等温方程式中的K⊖用或是否都可以?显然,对于同一个反应体系,除个别情况(反应前后气体分子数不变)下,和并不相等,而同一个反应体系的Δr是确定的,因此和不能随便使用。在教学中可以引导学生从标准平衡常数的导出来讨论这个问题,通过文献阅读和分析可知:由于推导不同标准平衡常数时,所用的各物质化学势中的标准态不同[6-10],因而与不同标准平衡常数对应的ΔrG也不同。通常对气相反应取压力标准平衡常数及对应的(T)而得到Δr;溶液中的反应用浓度标准平衡常数;对复相(或多相)反应,气体和溶质则分别取相对分压力、相对浓度以及对应的(T),而得到Δr,所以对复相(或多相)反应,K⊖不指明是标准压力平衡常数还是标准浓度平衡常数。总之,对气相反应而言,一般用,如果用带入等温方程式,则需要乘一个相应的换算系数。
2.5 为什么化学反应通常不能进行到底
在等温等压下,当反应物化学势的总和大于产物化学势的总和时,为什么化学反应通常不能进行到底?为了解答这一问题,教材[7]中以理想气体混合物的反应D(g,T,p)+E(g,T,p)2F(g,T,p)为例,做了简单推导。教学中为了培养学生严密的科学思维和严谨的科学态度,引导学生利用学习过的微积分知识对该例进行严格的数学证明,以严格的数学语言回答化学反应通常不能进行到底的原因,具体证明如下:
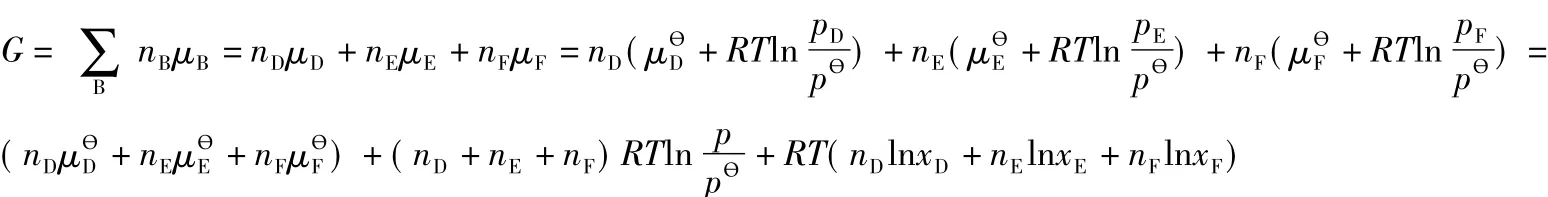
设反应从D,E开始,且其物质的量各为1mol,则在任何时刻,有:
从上式消去nE,nF,得:

令:
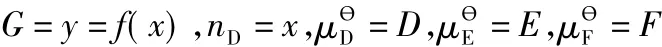
得:
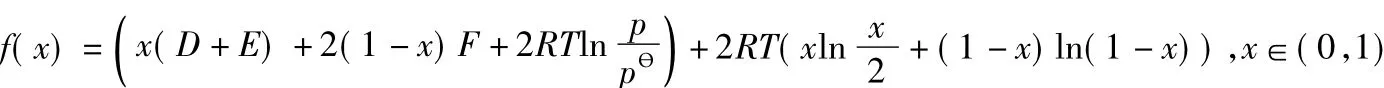
则:
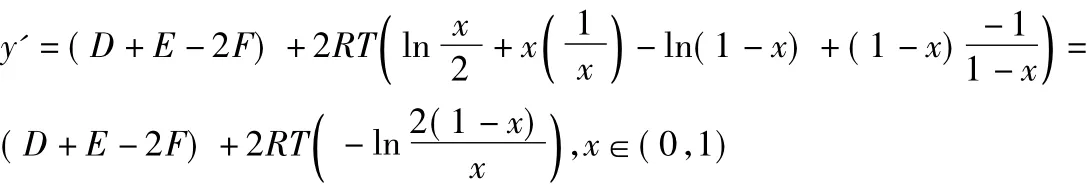
令:
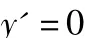
则:
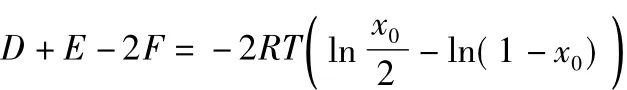
得:
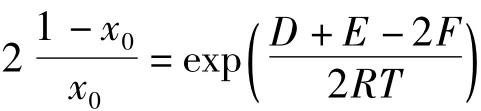
令:
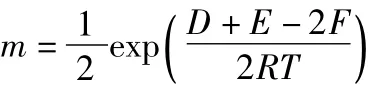
则:
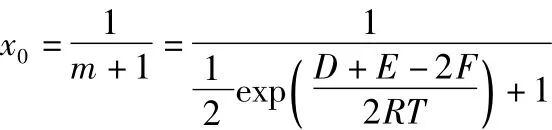
从反应的实际意义可知:D>0,E>0,F>0,R>0,T>0;且均为有界的正数。所以:
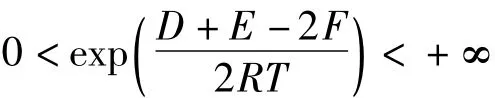
可得:x0∈(0,1)。
因为:
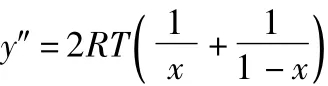
所以:

根据数学定理可知:x=x0为G=y=f(x)在x∈(0,1)上唯一的极小值点,即:G=y=f(x)在x∈(0,1)上有最小值。
由实际化学反应的意义可知:G=y=f(x)在x=0和x=1处的定义为:
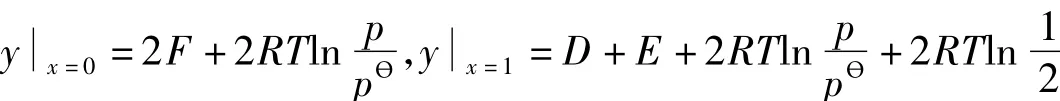
且:yx=1>yx=0。
综上所述,可以得到G=y=f(x)的图像(图1)。
在本例中,反应进程ξ等于1-x,所以图1就是文献[7]中图6.1及图6.2 PTS曲线的严格数学证明。
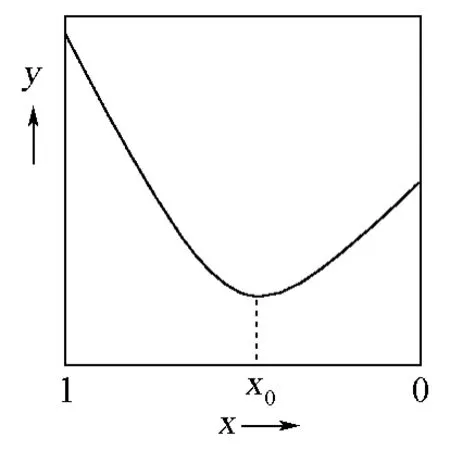
图1 G=y=f(x)的函数图像
[1] 武汉大学.分析化学.第3版.北京:高等教育出版社,1995
[2] 寇兴明.四川师范大学学报(自然科学版),1998,21(2):238
[3] 雷良萍.大学化学,1988,3(1):55
[4] 章旭坤.化学通报,1988,51(2):43
[5] 陈玲然,张懋森.丽水师范专科学校学报,1987,9(S2):62
[6] 浙江大学.无机及分析化学.第2版.北京:高等教育出版社,2008
[7] 傅献彩,沈文霞,姚天扬,等.物理化学(上).第5版.北京:高等教育出版社,2005
[8] 黄子卿.物理化学.北京:高等教育出版社,1955
[9] Atkins P,de Paula J.Atkins物理化学.第7版.影印版.北京:高等教育出版社,2006
[10] 北京师范大学无机化学教研室.无机化学.第4版.北京:高等教育出版社,2002

