基于纳米金、铁氰化镍纳米颗粒共修饰的电流型甲胎蛋白免疫传感器的研究
冉小琪,袁 若,柴雅琴,洪成林,刘凯歌
(西南大学化学化工学院,重庆市分析化学重点实验室,重庆400715)
0 引言
甲胎蛋白(α-1-fetoprotein,AFP)是由美国科学家Bergstrand和Czar于1956年在肝癌患者的血清中检测出的一种球蛋白[1]。AFP是胎儿早期由肝脏和卵黄囊产生的一种胚胎性蛋白,成人体内由肝细胞产生,正常成人体内含量极微。在大多数原发性肝癌或胚胎性癌患者体内,AFP的变化呈现出一定的规律,因此血清中AFP含量的检测对此类病症的诊断具有重要的意义[2~4]。目前基于抗体-抗原识别检测AFP的方法有很多种,应用较多的主要有酶联免疫吸附分析法(ELISA)、放射免疫测定法(RIA)、间接血凝法、琼脂双扩散法等[5~6]。这些方法具有检测时间长,需要对抗原抗体进行标记,费用高,有放射性等缺点。电化学免疫传感器由于其灵敏度高、费用低、体积小、半自动化和便于携带等特点,而具有重要的理论研究意义和实践应用价值。
该文将anti-AFP固定在由纳米金/铁氰化镍纳米颗粒(NiHCFNPs)/纳米金修饰的玻碳电极表面,纳米金具有扩大电极比表面积和增大抗体固定量的功能,同时能提供和自然相似的微环境并保持固定分子的生物活性,使得修饰电极表面能吸附大量抗体并很好地保持其生物活性[7]。根据文献报导,在普鲁士蓝 (PB)类化合物中,NiHCFNPs展示了特殊的氧化还原特性,是一种良好的电活性物质,在设计传感器时将其加入,可以改善传感器的性能(灵敏度,检测限等)[8]。由于-NH2,-SH,-CN和纳米金之间存在强烈的化学作用[9~10],NiHCFNPs和纳米金之间具有高的亲和性,因而可以直接将NiHCFNPs固定在沉积了纳米金的电极表面。NiHCFNPs具有大的比表面积,可以为固定第二层纳米金提供很好的生物兼容界面,再利用纳米金和-NH2间的化学吸附作用去固定anti-AFP。此外用这种方法形成的纳米金能提供一个稳定、粗糙和紧凑的表面,使之固定的抗体量增加。实验证明根据此原理制备的电极可以有效的测定AFP,并且检测限低,灵敏度高,线性范围宽,结果令人满意。
1 实验部分
1.1 主要仪器与试剂
CHI660C电化学工作站(上海辰华仪器厂),pHS-3C型酸度计 (上海大普仪器有限公司),透射电镜(TECNAI 10,飞利浦,荷兰),CS501-SP 型超级数显恒温器 (重庆四达实验仪器厂),KQ218超声清洗仪(昆山市超声仪器有限公司),AB203-S电子天平(瑞士Mettler-Toledo公司)。
甲胎蛋白抗体和抗原(郑州赛博生物工程有限责任公司);牛血清白蛋白(96%~99%)、氯金酸(HAuCl4)、 柠檬酸钠(Sigma 公司),K3Fe(CN)6和NiCl2·6H2O(四川化学试剂公司),其它试剂为分析纯试剂,实验用水为二次去离子水。0.02 mol/L磷酸盐缓冲溶液(PBS)由Na2HPO4-KH2PO4配制,并由0.1 mol/L KCl做支持电解质。
1.2 铁氰化镍纳米颗粒(NiHCFNPs)的制备[11]
把 70mL 0.01 mol/L NiCl2溶液逐滴加到剧烈搅拌的含有 0.05 mol/L KCl的 70mL 0.05 mol/L K3Fe(CN)6溶液中。在NiCl2溶液滴加完后,混合溶液继续剧烈搅拌5 min。再将混合液立即高速离心并洗涤数次后转到真空干燥箱中,室温下过夜,最终得到黄色粉末NiHCFNPs。
1.3 免疫传感器的制备
首先,将玻碳电极(φ=4 mm)分别用 1.0、0.3 μm Al2O3粉抛光成镜面,每次抛光后都用二次去离子水冲洗干净。抛光后的电极依次用二次去离子水、1∶1硝酸、乙醇和二次去离子水超声清洗干净。
清洗后的玻碳电极立即浸入2 mg/mL的HAuCl4溶液中,并在恒定电位-0.2 V下沉积60 s。 用蒸馏水冲洗后,电极表面滴加 10 μL 0.05 mg/mL超声5 min后的NiHCFNPs混悬液,将电极转移到4℃下冰箱中放置3 h,取出用二次蒸馏水冲洗后,将电极再次浸入到2 mg/mL HAuCl4水溶液中恒定电位-0.2 V下沉积30 s并用二次蒸馏水冲洗干净。
将洗净的纳米金/NiHCFNPs纳米金修饰电极浸到anti-AFP中4℃12 h,最后将电极在室温下浸入2.5%的BSA溶液中1 h封闭非特异性吸附点位。修饰好的电极不用时悬置于PBS溶液上方4℃下储存。免疫传感器的逐步修饰过程如图1所示。
1.4 实验方法
实验测量以免疫电极为工作电极,铂丝电极为对电极,饱和甘汞电极作为参比电极。所用的循环伏安法(CV),是一种有效、便捷的用来探测修饰电极表面特征的方法。在室温下的0.02 mol/L PBS(pH=7.0)里,在 0.0~0.8 V(对饱和甘汞电极)电位区间,扫速为50 mV/s条件下进行CV测试。
2 结果与讨论
2.1 NiHCFNPs的形态
NiHCFNPs的大小及形状直接影响着电极的性能,采用透射电镜TEM对其进行表征。图2展示了NiHCFNPs相对均一的微结构,平均尺寸为20 nm。
2.2 免疫传感器的电化学特征
图3为电极组装过程的循环伏安表征图。裸的玻碳电极由于缺少电活性物质,没有出现氧化还原峰(图3曲线a);当在裸的玻碳电极上沉积一层纳米金后,由于纳米金可以促进电子传输,背景电流有所增加(图3曲线b);在纳米金修饰的玻碳电极上自组装一层电活性物质NiHCFNPs后,出现一对明显的氧化还原峰,且峰电流非常大(图3曲线c);在 NiHCFNPs/纳米金/GCE上再次沉积一层纳米金后,峰电流再次大幅增加(图3曲线d),原因是NiHCFNPs层结合的纳米金促进电子传递;将纳米金/NiHCFNPs/纳米金/GCE在anti-AFP中浸泡12 h后,峰电流明显下降(图3曲线e),证明anti-AFP已经结合到了电极上,生成的蛋白质大分子严重阻碍了电子传输到电极表面;用BSA封闭后,由于BSA阻碍电子传输,峰电流进一步下降(图3曲线f)。
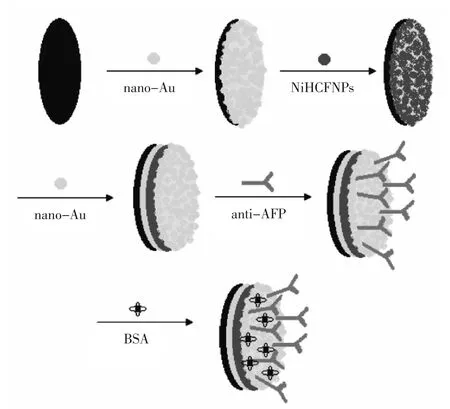
图1 免疫传感器的组装过程Fig.1 Preparation process of the immunosensor
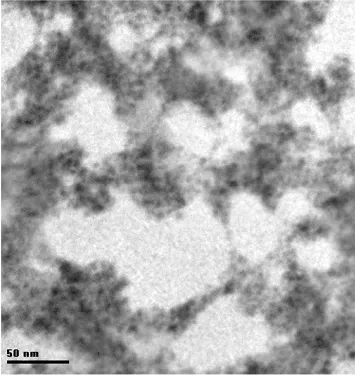
图2 NiHCFNPs的TEM表征图Fig.2 TEM image of NiHCFNPs
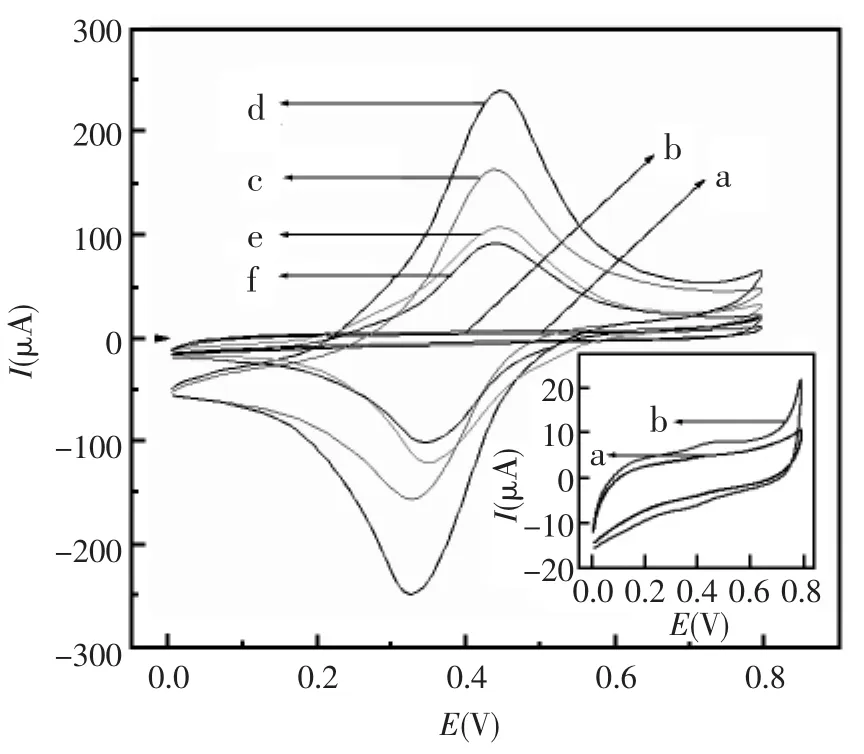
图3 电极制备过程中的循环伏安表征图(a)裸的玻碳电极;(b)在玻碳电极表面电沉积纳米金;(c)自组装NiHCFNPs层;(d)再沉积纳米金;(e)固定一层抗体膜;(f)用BSA封闭Fig.3 The diagram of the CVs of the stepwise
将免疫电极在0.02 mol/L PBS(pH=7.0)中用不同扫速进行循环伏安表征,随着扫描速度的不断增加,峰电流值也逐渐增大,且峰电流值与扫描速率的平方根(v1/2)成正比,说明该免疫电极受扩散控制。
2.3 实验条件的优化
2.3.1 第一层纳米金沉积时间的优化
电化学还原氯金酸的时间与所形成的纳米金层的厚度、量有着直接的关系,影响着NiHCFNPs的固定并将进一步影响传感器的性能。还原时间越长,纳米金的量越多,但是如果还原时间超过一定值时,将可能导致纳米金层过厚,阻碍电子的传输并影响传感器的响应。在Fe(CN)64-/3-溶液(pH=7.0)中对第一层纳米金的还原时间进行优化。如图4所示,在60 s时,电流响应达到最大值。因此第一层纳米金的还原时间选作60 s。
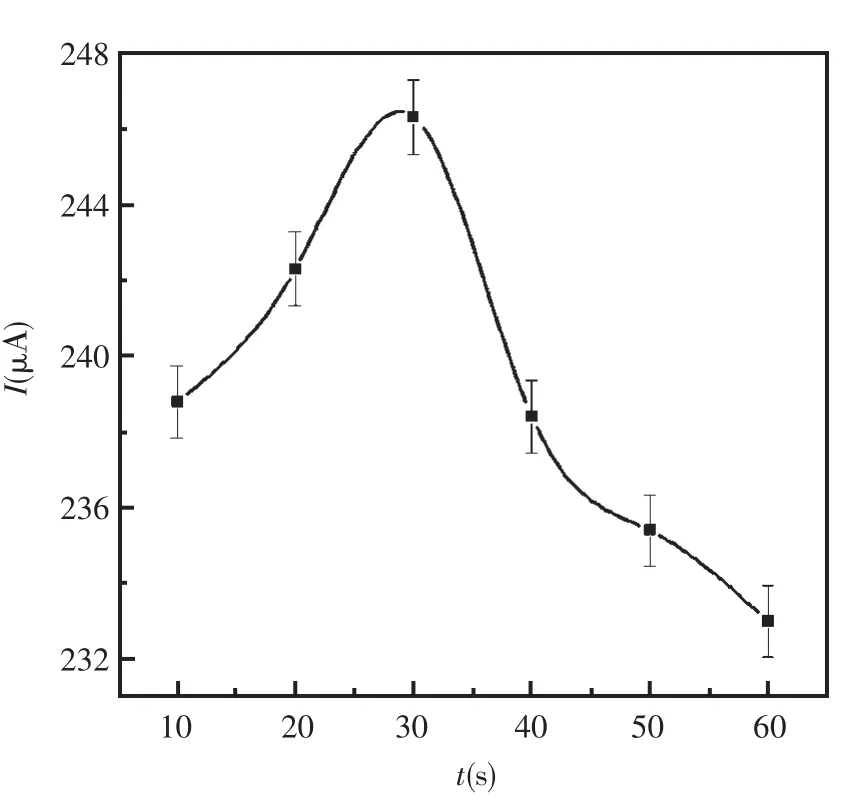
图4 第一层纳米金在玻碳电极表面还原时间的影响Fig.4 The effect of electrochemical reduction time of the frist layer of nano-Au
2.3.2 第二层纳米金时间的优化
同样,第二层纳米金的还原时间也需要优化。在0.02 mol/L PBS(pH=7.0)中测定第二层纳米金还原时间对电流响应的影响。根据图5知,在还原时间为30 s的时候,峰电流最大,因此实验中采用30 s。
2.3.3 孵育时间的优化
抗体与抗原形成免疫复合物的反应平衡与孵育时间有着直接的关系。图6展示了当使用20.0 ng/mL AFP做孵育底液时孵育时间对传感器响应的影响。由图可知,传感器的响应电流随着孵育时间的增加而增加,到25 min之后,增加孵育时间,电流响应慢慢持平,表明免疫反应达到了平衡。故实验中选择孵育时间为25 min。
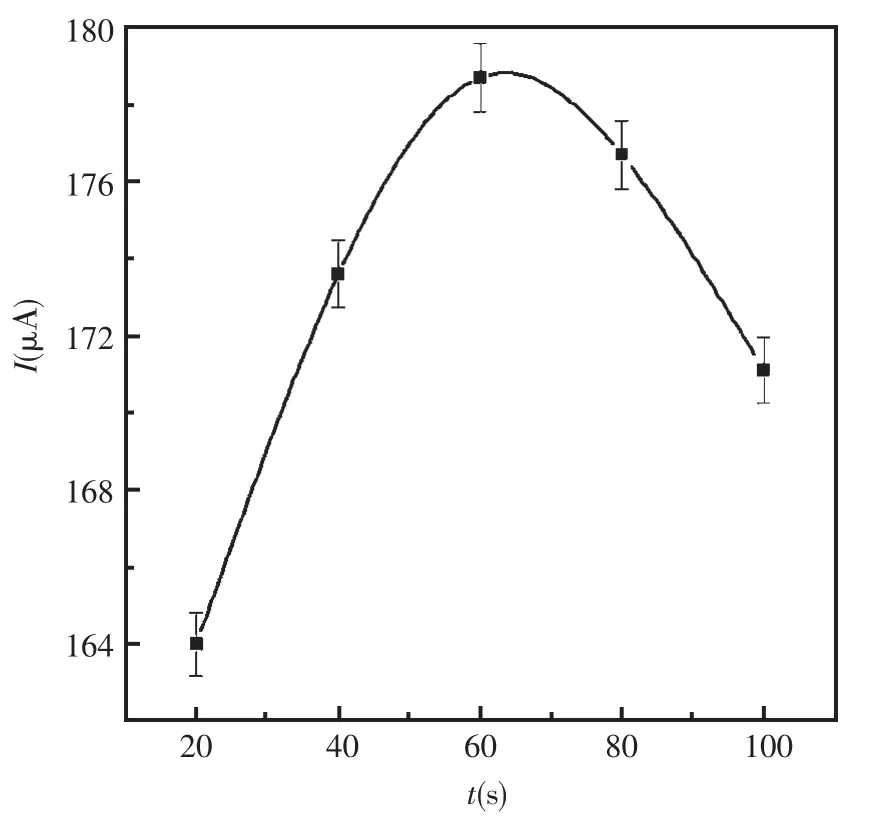
图5 第二层纳米金在玻碳电极表面还原时间的影响Fig.5 The effect of electrochemical reduction time of the second layer of nano-Au
2.3.4 工作底液酸度的优化
检测了pH从5.0到9.0范围内的0.02 mol/L PBS中该免疫传感器的电流响应变化情况(图7)。当pH值从5.0增加到7.0时,峰电流逐渐增加,pH从7.0到9.0增加时峰电流下降。实验结果展示在pH为7.0时,响应电流最大。因此实验中选择pH为7.0的磷酸缓冲液作为测试底液。
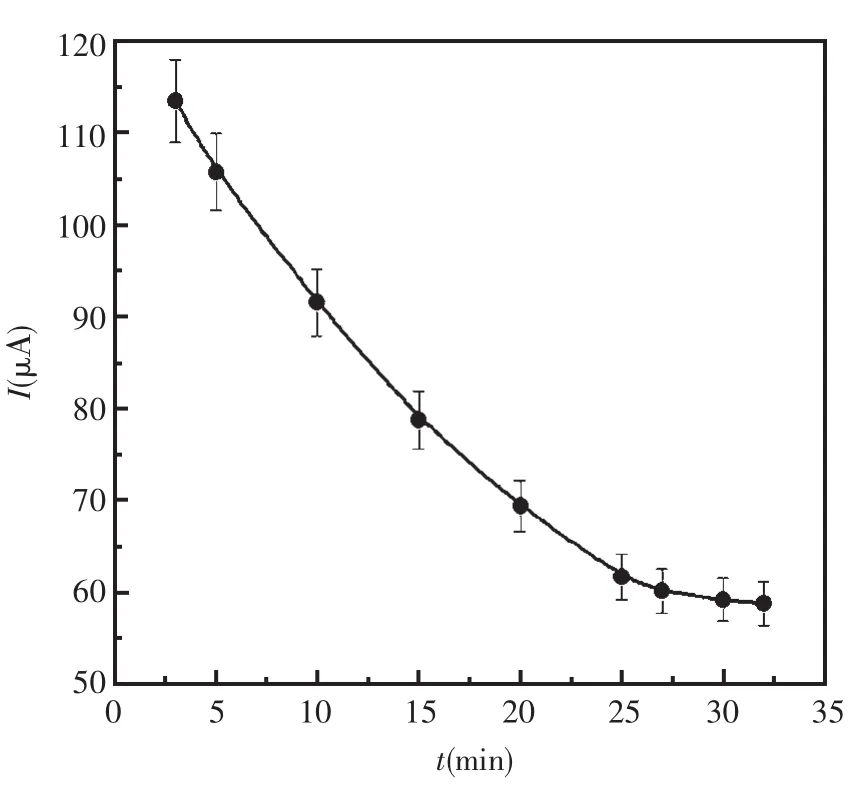
图6 孵育时间对免疫反应的影响Fig.6 The effect of incubation time on immunoreaction
2.4 免疫传感器的性能
在选定条件下,传感器在不同浓度的AFP标准溶液中孵育,图8展示了CV峰电流信号对AFP浓度的校准曲线,由图8可知峰电流与AFP浓度在1.0~10.0 ng/mL 和 10.0~200.0 ng/mL 两个浓度范围内成线性,两段线性的斜率分别为-5.878和 -0.215 1 μA/(ng/mL), 相关系数分别为0.992 4和 0.992 1, 检出限为 0.2 ng/mL(S/N=3 时)。
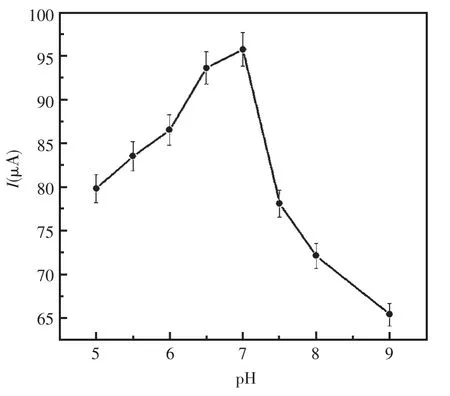
图7 工作底液酸度对电极的影响Fig.7 The influence of pH of the PBS on the response of the immunosensor
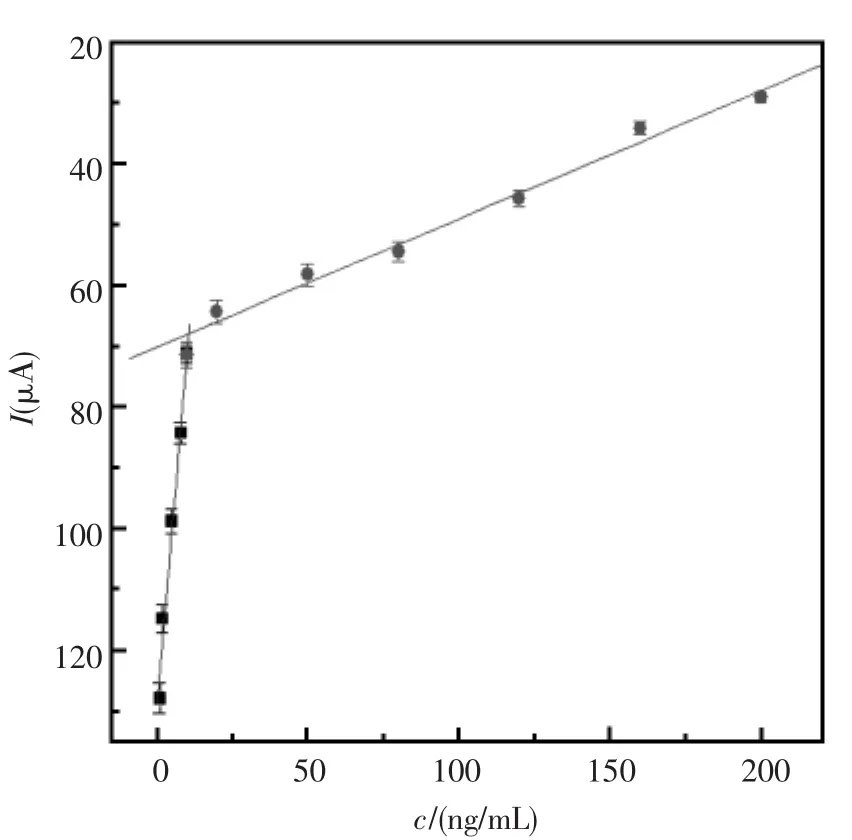
图8 免疫传感器检测AFP的线性图Fig.8 Calibration plot of the immunosensor for detection of AFP
2.5 免疫传感器的稳定性和重复性
当传感器在PBS缓冲液中分别重复连续测定11次时,产生了3.3%相对标准偏差。实验中还研究了连续稳定性,当免疫传感器在PBS缓冲液中连续扫描50圈,产生了3.7%的相对标准偏差。
2.6 免疫传感器的选择性
将免疫传感器孵育在包含20.0 ng/mL AFP以及其它可能和AFP共存的物质中测定免疫传感器的选择性。该文研究了浓度分别为20.0 ng/mL的癌胚抗原,牛血清白蛋白,蛋氨酸,异亮氨酸,甘氨酸,L-半胱氨酸对AFP测定的干扰。其干扰可以用传感器在20.0 ng/mL AFP中含有干扰物质和不含干扰物质中孵育的电流响应值之比来评定。表1即为以上物质对AFP的干扰测定结果,实验表明,不存在明显干扰。
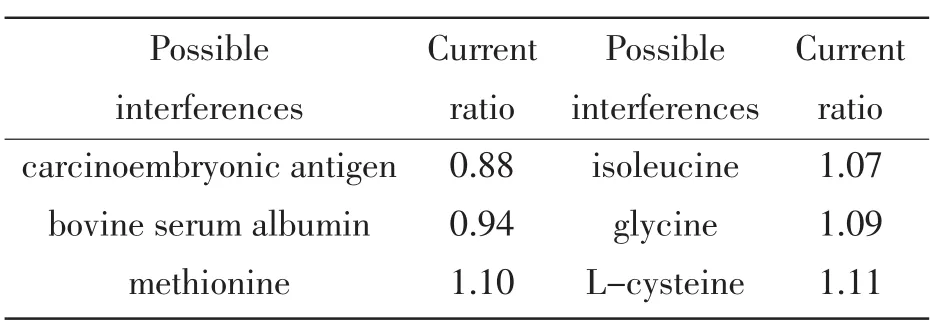
表1 免疫传感器的选择性Tab.1 Possible interferences tested with the immunosencor
3 结论
该实验利用纳米金和NiHCFNPs纳米颗粒固定anti-AFP,从而构建了一种新型的高灵敏度的电流型AFP免疫传感器。所研究的免疫传感器具有灵敏度高,制作简单,检测下限低,成本低,稳定性好的优点,有望用于AFP的医学研究和临床检验。
[1]Bergstrand C G,Czar B.Demonstration of A New Protein Fraction in Serum From The Human Fetus[J].Scand.J Clin.Lab.Invest,1956,8(2):174~179.
[2]Gillespie J R,Uversky V N.Structure and Function of α-Fetoprotein:A Biophysical Overview[J].Biochim.Biophys.Acta,2000,1480(1-2):41~56.
[3]Witzigmann,Geissler H,Benedix F.Prospective Evaluation of Circulating Hepatocytes by Alpha-Fetoprotein Messenger RNA in Patients with Hepatocellular Carcinoma[J].Surgery,2002,131(1):34~43.
[4]黎雪莲,袁若,柴雅琴,等.基于多层酶/纳米金固定甲胎蛋白免疫传感器的研究[J].化学学报,2006,(4):325~330.
[5]王力平,庄惠福.EIA法与RIA法检测甲胎蛋白结果比较[J].标记免疫分析与临床,1999,6(1):51~52.
[6]Ilkka H,Veli-Matti M.Time-Resolution in FluorometryTechnologies,Labels and Applications in Bioanalytical Assays[J].Crit.Rev.Clini.Lab.Sci,2001,38(6):441~519.
[7]Liu S Q,Leech D,Ju H X.Application of Colloidal Gold in Protein Immobilization,Electron Transfer and Biosensing[J].Anal.Lett,2003,36(1):1~19.
[8]Zhou D M,Ju H X,Chen H Y.Catalytic Oxidation of Dopamine at A Microdisk Platinum Electrode Modified by Electrodeposition of Nickel Hexacyanoferrate and Nafion[J].J.Electroanal.Chem,1996,408(1-2):219~223.
[9]Grabar K C,Freeman R G,Hommer M B,et al.Preparation and Characterization of Au Colloids Monolayers[J].Anal.Chem,1995,67(4):735~743.
[10]Gu H Y,Yu A M,Chen H Y.Direct Electron Transfer and Characterization of Hemoglob in Immobilized on A Au Colloid-Cysteamine-Modified Gold Electrode[J].J.Electroanal.Chem,2001,516(1-2):119~126.
[11]Yang M H,Yang Y H,Qu F L,et al.Attachment of Nickel Hexacyanoferrates Nanoparticles on Carbon Nanotubes:Preparation,Characterization and Bioapplication[J].Anal.Chim.Acta,2006,571(2):211~217.

