功能核酸检测金属离子研究进展
徐 慧, 高淑丽, 王丽华
(1.鲁东大学化学与材料科学学院,山东烟台264025)
(2.中国科学院上海应用物理研究所,上海201800)
0 引言
金属离子在生命科学、环境科学、医学等领域扮演着重要角色,金属离子的种类、浓度以及价态等性质直接决定了它们的功能以及对环境和生物体的作用,因此对金属离子进行特异性和高灵敏度检测具有重要意义[1~2]。例如重金属对人类健康的危害已是众所周知,近年来重金属对环境造成的污染已引起各国政府和人们的高度重视。一些过渡金属等微量元素(如硒、锌、铁等)对人类以及其它生物的健康具有重要意义,它们是保持酶活性的重要参与物质。维持生物体电解质平衡的钾盐、钠盐等,同时也具有非常重要的生理功能。例如K+可参与诸如神经脉冲传递和细胞活动调节等生物过程,在血液和尿液中的存在水平反映了身体的健康状况,对临床诊断非常重要[3]。因此对金属元素的定性、定量检测对生命、环境和医学科学等都有重要意义。目前金属元素的检测主要采用光谱法,包括原子(吸收、发射、荧光等)光谱、分光光度法等,电化学、声学等方法也有应用[4~10]。但这些方法依赖于大型仪器和专人操作,在现场和野外检测中受到限制。以冠醚类、多胺类、杯芳烃类等有机小分子为代表的化学传感方法也有一定的发展,目前存在灵敏度低、可重复性差、检测在有机溶剂中进行等不足之处,检测的可靠性和实用性不高。因此迫切需要发展无污染的、简便快速、高灵敏度和高特异性的方法来满足微量金属检测的需要。
伴随着分子生物学的快速发展,核酸适配体(aptamer)、 脱 氧 核 酶 (DNAzyme) 以 及 aptazyme(aptamer与DNAzyme的复合物)等一类具有特定生物功能的核酸分子被发现和合成。这类功能核酸的出现为生物传感分析提供了更广阔的发展空间,并已广泛应用于医疗诊断[11~12]、成像[13]、药物筛选[14]、分离[15]、材料科学[16]、纳米科学[17]、有机合成[18]和传感检测[19~22]等领域。 Aptamer是一类通过指数富集配体系统进化(Systematic Evolution of Ligands by Exponential Enrichment,SELEX)技术体外筛选出来的对靶分子(target)具有高度亲和力的一类DNA或RNA分子[23]。理论上,对于特定的目标分子,总能找到一种或多种与之特异性结合的aptamer,因此大大拓宽了应用领域,被认为是生物传感器最理想的识别元件之一[24~25]。DNAzyme是经过SELEX筛选出来的一种具有催化功能的单链DNA片段[26],具有高效的催化活性和结构识别能力。大多数的DNAzyme具有金属离子依赖性,只有在特定金属离子存在时才表现出催化活性。Aptazyme由两个独立的功能域组成,即能结合配体的aptamer和具有自剪切作用的DNAzyme,它充分综合了aptamer的高亲和力和DNAzyme的核苷酸序列专一性酶切活性等优势。这些功能核酸的出现为金属离子检测提供了更多的识别模式,例如金属离子可以和aptamer进行特异性结合,并引起aptamer自身的构象变化,通过监测这种构象变化来对金属离子进行定性和定量分析。DNAzyme在特定金属离子存在的条件下,可以导致DNA片断在特定位置上发生酶解,生成更小的寡核苷酸片断。由于DNAzyme的活性与金属离子的浓度呈正相关,因此可以通过检测DNAzyme的酶解产物来对金属离子进行检测。由于功能核酸与靶物质具有高的亲和力和高的特异性,所以具有灵敏度高、选择性好等特点。目前基于功能核酸的生物传感器主要是通过检测产物的光学和电学性质变化来实现的,具体包括荧光、比色以及电化学等方法。该文总结了近几年来用于金属离子检测的功能核酸传感器的研究工作进展,包括荧光传感器、比色传感器和电化学传感器等内容。
1 荧光传感器
1.1 以荧光探针为信号转换体
荧光分析法是生物传感器中应用最为广泛的方法之一,具有灵敏度高,选择性好,动态线性范围宽,方法简便,重现性好等优点。例如在分子生物学中广泛应用的分子信标,利用了DNA构象变化的原理,当双标记的茎环结构DNA在遇到互补DNA后,茎环打开导致荧光共振能量转移(FRET)不能发生,荧光信号升高。该节介绍了基于aptamer的荧光生物传感策略,主要是利用aptamer在结合靶分子后自身构象发生变化,导致荧光信号升高或降低。
目前应用最为广泛的是双荧光基团修饰型探针,即在aptamer的5'端和3'端分别标记上荧光基团(F)和猝灭基团(Q),类似于分子信标。Aptamer在结合target后,由柔性的单链结构转变成刚性的二级结构,改变了FRET发生的效率并导致荧光信号的改变。Ueyama等[27]利用此原理检测钾离子,在PSO(potassium specific oligonucleotide,GGG TTA GGG TTA GGG TTA GGG)的5'端和3'端分别标记上荧光基团FAM(donor)和 TAMRA(acceptor)(图1),当没有 K+时,PSO为柔性单链,FAM和TAMRA离得较远,不能发生有效FRET;而当有K+存在时,PSO可以特异性的形成G-四面体结构,拉近了荧光基团和猝灭基团之间的距离,可以发生有效FRET,FAM在522 nm处的荧光强度明显降低,TAMRA在582 nm处的荧光显著升高。当用302 nm的紫外光照射时,荧光的颜色从黄色变为红色,实现了对K+的可视化检测,而且过量Na+的存在不会干扰K+的检测。
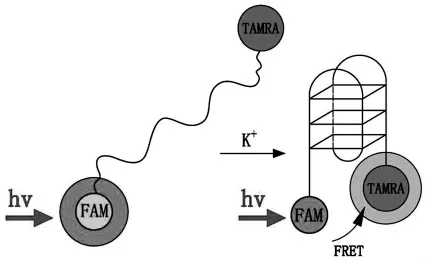
图1 基于荧光标记检测K+[27]Fig.1 Detection of K+with dual-labeled PSO[27]
利用上述原理以及Hg2+可以与胸腺嘧啶(Thymidine,T)发生特异性结合的性质,Ono等[28]设计了双标记的富T序列作为探针实现了对汞离子的特异性检测,检测限为40 nmol/L。Liu等[29]利用 thrombin binding aptamer(TBA)作为探针来检测Pb2+和Hg2+两种离子。当存在Pb2+和Hg2+时,TBA会分别转变为G-四面体和发夹结构,荧光素与猝灭剂之间发生FRET,低至300 pmol/L的Pb2+和5.0 nmol/L的Hg2+即可以产生可测的荧光信号变化。这种基于aptamer的荧光标记的方法具有灵敏度高、特异性好的特点,但需对功能核酸进行双荧光标记,成本较高。
联吡啶钌、溴化乙锭(EB)、Sybr Green I(SG)等染料分子可以嵌入不同的DNA结构中并表现出不同的荧光性质。在水溶液中,这些染料分子的荧光信号很低,一旦嵌入到DNA或RNA双链区的非水“口袋”环境后,荧光信号大大增强。例如SG与单链DNA通过静电相互作用结合,而与双链DNA通过静电结合和小沟结合两种方式,两种不同结合方式下SG荧光信号的强度相差10倍以上[30]。Aptamer的构象变化导致与染料分子的结合力发生变化,并表现出荧光信号的升高或者降低,这主要是由于aptamer在结合target后会通过部分碱基配对而形成一定的三维结构,这些局部配对碱基为染料分子的嵌入提供了可能。目前这种方法已用于IgE、血小板衍生生长因子(PDGF)、凝血酶及相思子毒素等蛋白质大分子[31~33]及金属离子的特异性检测,它的最大优势在于不用对DNA或者目标分子进行共价标记。
Liu 等[34]以 MSO(mercury specified oligonucleotide,MSO)和SG为探针检测Hg2+。MSO与Hg2+结合后由单链变为发卡结构,SG能够有效地区分这种结构差异并表现出荧光增强。此方法无需对MSO进行标记,简便快速,成本低廉,5 min内即可实现低至1.33 nmol/L Hg2+的检测。Chiang等利用T33序列和ToTo-3可以检测到0.6 ppb(3 nmol/L)的Hg2+[35]。Liu等[36]进一步将检测限降低到 0.5 nmol/L(0.1 ppb)主要原理是当 poly T 遇到Hg2+时能形成T-Hg2+-T复合物,影响了poly T与poly A杂交,双链不能有效形成,导致SG的荧光强度降低。与传统的荧光双标记DNA检测Hg2+的方法相比,该方法将灵敏度提高了2个数量级[28]。
利用胞嘧啶(Cytosine,C)与Ag+的特异性作用以及SG区分不同构象DNA的原理,Fan课题组对Ag+进行了检测[37],与检测Hg2+的原理类似,富C序列在结合Ag+后由单链变为发卡结构,SG与后者的作用较强,导致荧光显著升高。利用该方法最低可以检测5 nmol/L的Ag+,且整个过程在5 min内即可完成。类似的,Xu等对K+进行了检测,实验证明,SG也可以插入G-四面体结构中,导致荧光信号升高。Kong等[38]发现结晶紫Crystal violet(CV)能够对G-四面体与单双链DNA进行区分,并且发现CV具有识别平行和反平行G-四面体的能力[39],当CV插入到反平行G-四面体后,可使荧光强度有很大程度的增强。由于富G序列与K+或Na+作用时会分别形成平行和反平行构象,因此CV可以用来检测K+。
与荧光标记方法相比较,利用染料分子的核酸嵌入式荧光探针检测金属离子的方法无需荧光标记,成本较低,简单快速,而且灵敏度更好。
1.2 导电共聚物作为光学信号传导体
导电共聚物具有独特的光电性质,例如强的吸光性能[40](摩尔消光系数高达106L/(mol·cm)[41])以及“分子导线”性质等[41~42],可以用作生物传感器的信号传导元件,Swager等[41~43]首先将其应用于传感领域。目前基于共轭聚合物的检测方法能对纳摩尔甚至皮摩尔级的金属离子进行快速检测[44~46]。Fan课题组利用聚芴的荧光性质对DNA等进行了检测[46~47],并对各种基于不同传感策略的共轭高分子光学生物传感器研究进行了综述[45~46]。导电高分子聚芴具有非常高的荧光量子产率,并且可以高效采集能量通过FRET传递给荧光素,从而显著提高荧光素的荧光强度。Wang等[48]利用FAM标记的富G序列和聚芴,通过聚合物和FAM之间FRET效率的变化来检测K+(图2)。聚芴与单链的静电力很弱,因此DNA远离聚芴分子,与FAM的FRET很弱导致荧光很低。当加入K+后,DNA形成G-四面体构型,增加了DNA表面的电荷密度,与聚芴之间的静电作用变强,距离变近,它们之间可发生较强的FRET。为进一步提高FRET效率,他们利用EB作为过渡形成聚芴-FAM-EB的体系,实现了对富G序列由G-四面体到双链构象转变的实时检测[49],并进一步提高了灵敏度。Xu等[50]利用导电高分子(PFP),对 YOYO-1(TOTO-1)检测 Hg2+的方法做进一步放大,检测限可达0.27 nmol/L。
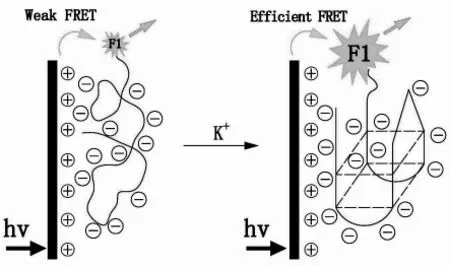
图2 利用共轭高分子实现对K+的检测[48]Fig.2 Detection of K+based on conjugated polymer[48]
2 比色传感器
2.1 基于金纳米粒子的比色传感器
纳米金颗粒具有优异的光学性质、电学性质、化学活性和生物兼容性,因此在生物领域尤其是生物传感领域得到了广泛应用[51~52]。研究表明,纳米金粒子的光学性质与颗粒之间的距离密切相关,当颗粒的间距超过其平均直径时,纳米金呈分散状态,宏观上表现为红色;当间距小于平均直径时,呈聚集态,呈现紫色或蓝色。这种颜色差异主要是因为聚集或分散态的纳米金具有不同的表面共振频率造成的[51]。纳米金具有很好的生物相容性、化学反应活性以及大的比表面积,可同时负载多条功能核酸序列,通过多价效应增强与靶分子间的亲和力和特异性。目前纳米金探针已用于多种物质的分析检测。主要原理是基于靶分子可以诱导功能核酸空间结构发生变化,并藉此引起金纳米粒子之间的聚集-分散状态改变,呈现不同的颜色,实现对靶分子的快速比色检测[53~54]。
2.1.1 非修饰型纳米金
Li等[55]发现纳米金与DNA单链和双链的作用明显不同,单链DNA具有很好的柔性,碱基游离在外使得N原子有机会与纳米金发生相互作用,通过Au-N键吸附在纳米金表面,增加了纳米金的表面电荷密度,大大提高了其耐盐性。而双链DNA的表面负电荷堆积程度高,并且dsDNA的双螺旋结构使N、S等原子包埋更深,因此ds-DNA与纳米金有较强的排斥,不能吸附到纳米金表面。当提高溶液中的盐浓度时,纳米金发生聚集,呈现蓝色。利用这个性质可以实现对单链和双链DNA的区分,并实现对DNA的检测。该方法不需要对颗粒、探针或靶序列进行共价修饰,操作简便快速,整个检测过程可以在10 min以内完成。
利用纳米金的这种性质,Fan课题组进一步研究了其它几种不同DNA结构与纳米金的相互作用,并发展了一系列传感策略用于K+[56]、Hg2+[57]、pH[57]等的快速检测。在检测K+的传感策略中 (图3),当溶液中没有K+时,柔性的单链PSO吸附在纳米金表面,有效的保护纳米金免受高浓度盐溶液引起的聚集。而存在K+时,柔性的PSO构象转化成刚性的G-四面体结构,不能吸附在纳米金表面,在高浓度盐溶液中发生聚集,颜色由红色变为蓝色。利用这种性质实现了对K+的可视化检测。类似的,利用MSO和Hg2+的特异性结合,该法实现了对Hg2+的高灵敏度和高选择性可视化检测[57~58]。Dong等利用富C序列(SSO)与Ag+特异性结合形成C-Ag+-C结构的性质[59],实现对Ag+的高灵敏度和高选择性可视化检测[60],肉眼最低可观察到52 nmol/L Ag+引起的纳米金颜色变化。
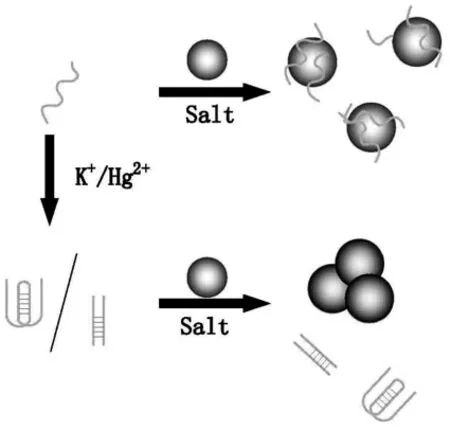
图3 利用纳米金与不同构象DNA之间作用的差异实现对 K+[56]和 Hg2+[57~58]的比色检测Fig.3 Colorimetric detection of K+[56]and Hg2+[57~58]based on the different interaction of AuNPs and DNA
进一步结合纳米金猝灭荧光的性质,Wang等[61]可以检测40 nmol/L的Hg2+,并且不受其它高浓度金属离子的干扰。图4中显示,游离的荧光标记DNA探针被吸附在纳米金表面并发生荧光猝灭现象。而Hg2+诱导单链DNA形成准双链结构,不在纳米金表面吸附,荧光信号得以保持。该方法不需要对金纳米粒子作任何共价修饰,检测成本低,操作简便快速;在水溶液中对Hg2+具有较高的灵敏度和特异性。
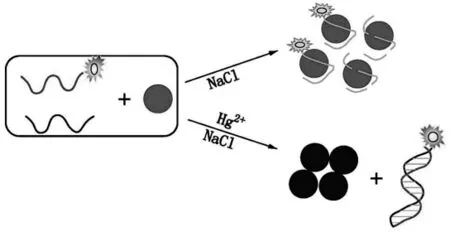
图4 一种基于金纳米离子与单双链作用差异的荧光检测汞离子策略[61]Fig.4 A novel fluorescent assay for Hg2+based on the different interactions of AuNPs and ssDNA/dsDNA[61]
2.1.2 修饰型纳米金
纳米金颗粒除了可与氨基发生非共价的静电吸附外,还可与疏基形成Au-S共价键,这使得胶体金可与生物活性分子结合制备AuNP探针并用于生物体系的检测。例如Mirkin研究组[62]将巯基DNA组装在纳米金表面得到AuNP-DNA复合纳米结构,通过DNA杂交来改变纳米金的分散-聚集状况,构建了基于纳米金比色方法的检测平台。目前AuNP-DNA探针已广泛应用于蛋白质,有机小分子和金属离子等的分析检测[63~68]。Lee等利用两段带有T错配的互补DNA分别修饰纳米金,利用T-Hg2+-T配对导致的Tm值升高来实现对纳米金距离的调控,使之在不同浓度Hg2+条件下呈现不同的颜色变化。该法可以特异性的检测低至100 nmol/L的Hg2+[69],但需要对检测温度进行控制。
Fan课题组[70]提出一种室温下检测水溶液中Hg2+的方法。利用AuNP-Tn探针与Hg2+结合形成准双链的性质,拉近纳米金颗粒之间的距离,并呈现由红色到蓝色的变化。该法可检测到5.0×10-6mol/L 的 Hg2+,且具有检测快速、方便的优点。Xue等[71]也发展了一种新颖、实际在室温下检测Hg2+的比色检测手段(图5)。他们设计了两个修饰有DNA的金纳米粒子 (记为探针A和B),同时引入了和两个探针序列部分互补且含T-T错配的探针C,只有Hg2+存在时,探针C可以特异性的识别探针A和B使其形成稳定的双链DNA,从而拉近了不同纳米金探针的距离,使金纳米离子发生团聚,颜色表现为蓝色。重要的是通过控制三个探针T-T错配的数量,可以在一定范围精确调控三个探针的熔化温度。
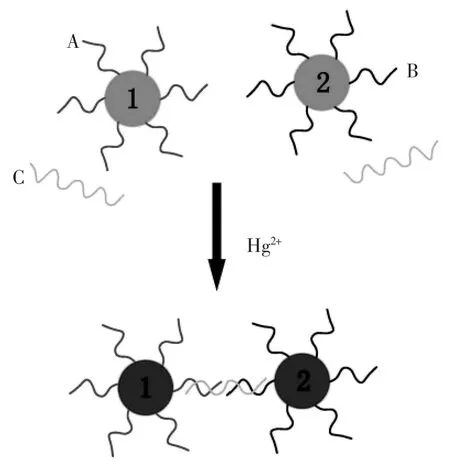
图5 室温下特异性检测Hg2+原理示意图:探针A和B部分序列和探针C互补,当存在Hg2+时,这三条DNA发生杂交,使纳米金发生聚集,表现为蓝色[71]Fig.5 The principle of specific detection of Hg2+at room temperature:probe C recognizes the particle probes A and B and forms stable DNA duplexes(or NP aggregated networks)only in the presence of Hg2+[71]
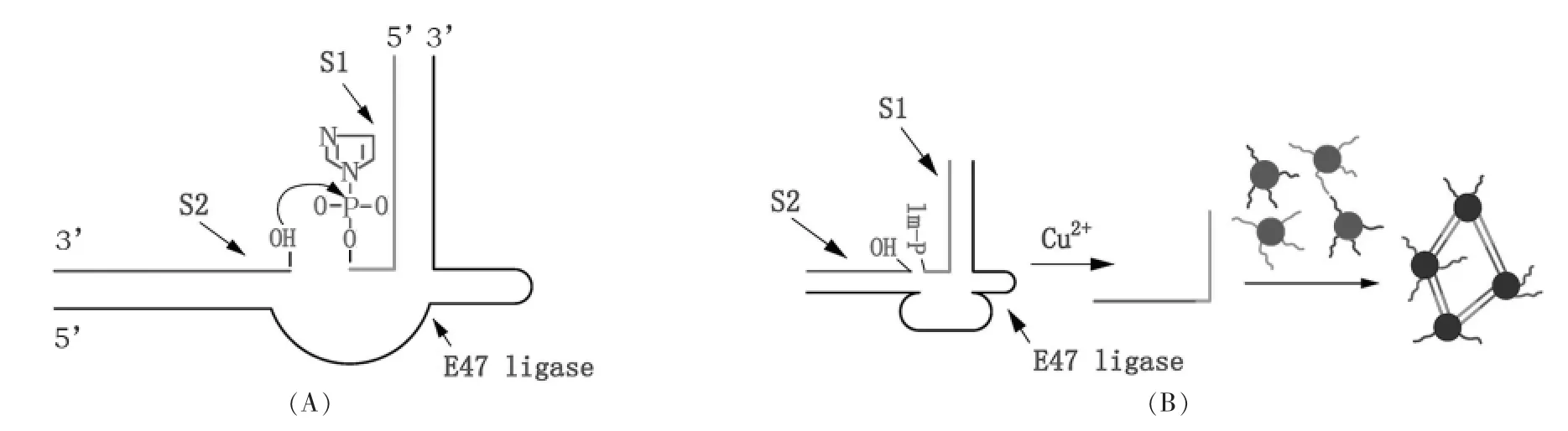
图6 (A)Cu2+依赖性具有DNA连接活性的DNA酶的二级结构。底物S1的3'端用咪唑活化;(B)存在Cu2+时,E47DNA酶将S1、S2连接起来,导致纳米金探针距离拉近发生团聚,颜色变为蓝色[77]Fig.6 (A)Secondary structure of Cu2+-dependent DNA ligation DNAzyme.The 3'end of substrate S1 was activated with imidazole;(B)In the presence of Cu2+,DNA enzyme E47 will connect S1 and S2 together,resulted in the formation of Au nanoparticles aggregate,reflected by the blue color[77]
结合DNAzyme的催化活性依赖于金属离子的性质,Li、Lu 等研究组[72~77]建立了基于纳米金光学性质变化的金属离子检测方法。通常DNAzyme的催化活性和结构识别能力只有在特定金属离子的存在下才可以发挥作用,因此可以用来设计高特异性的金属离子传感器。Li等[72]利用Ag+介导的DNAzyme发展一种检测Ag+的方法;Lu等利用DNA enzyme以及纳米金聚集颜色变化效应,发展了一系列特异性检测Cu2+、Pb2+等金属离子的方法[73~77]。图6[77]描述了利用对Cu2+依赖性的DNAzyme连接酶,以及底物DNA修饰的纳米金探针对Cu2+进行特异性检测的策略,比色结果显示出很好的特异性和高的灵敏度。
利用Pb2+依赖性的DNAzyme切割酶以及纳米金与单双链DNA作用的差异,可以检测Pb2+[73]。首先制备了AuNP-DNA探针并通过与DNAzyme底物的杂交形成纳米金聚集体(蓝色),没有Pb2+时,DNAzyme不能切割底物DNA,溶液保持蓝色;而有Pb2+存在时,DNAzyme对底物DNA特定位点进行切割,底物DNA断开,纳米金聚集体重新分散在溶液中,呈红色。利用这种方法可以检测到10-7mol/L的Pb2+。
应用纳米金和功能核酸对金属离子进行可视化检测是一种简便、快速、成本低廉、同时兼具较好灵敏度和高选择性的方法,适合于野外检测和现场监测,因此有较好的应用潜力。
2.2 基于导电高聚物的比色传感器
聚噻吩(PT)是一类具有构象效应的共轭导电高分子,它的光学性质伴随着分子构象的变化而变化。聚噻吩的共轭骨架上带有正电荷,在外界环境影响下(如温度、相反电荷底物等),骨架的平面结构发生形变,并导致光学性质(例如:颜色、紫外可见吸收光谱以及荧光光谱等)发生明显变化。
Leclerc研究组结合aptamer的生物识别特性以及共轭导电高分子的光学性质,发展了一系列基于聚噻吩构象变化的DNA传感器[78~82]。利用阳离子聚噻吩的构象变化以及aptamer与K+之间的特异性作用,实现了对溶液相中K+的特异性比色检测[80]。溶液中的聚噻吩分子共轭程度较低,主要以柔性的自由卷曲状态存在,颜色呈黄色。当加入单链DNA时,PT与之结合并使自身的共轭程度增加,最大吸收峰发生红移,溶液呈红色。K+使ssDNA形成G-四面体结构,与PT结合后导致PT的共轭程度较差,溶液呈黄色。通过观察溶液颜色或紫外吸收的变化就可直观简单的检测K+。
Tang等[83]将胸腺嘧啶T结合到聚噻吩的侧链制备了可以用于Hg2+检测的PTT探针。侧链的T结合Hg2+后,聚噻吩主链的构象由自由卷曲状态变为刚性的聚集体构象,相邻的聚噻吩链之间形成π堆积的聚集体,导致荧光自猝灭,藉此可以特异性的检测Hg2+。该方法可以检测30 μmol/L的 Hg2+,检测模式为“turn-off”模式。
Fan课题组[84]利用MSO探针以及阳离子聚噻吩衍生物PMNT的构象效应,实现了重金属离子Hg2+在水相中的快速、可视化检测。该方法无需任何修饰,检测模式为“turn-on”模式,灵敏度较高。利用MSO探针在结合Hg2+后构象发生变化的特性,PMNT以不同方式结合MSO并形成具有不同光学性质的复合物,通过比色和荧光来进行检测。直接用肉眼目测,在几分钟内可检测到12.5 μmol/L 的 Hg2+,结合荧光检测方法,检测限可以进一步提高到42 nmol/L。
3 电化学传感器
在大多数情况下,溶液中单链DNA或RNA的空间构象是不确定的,当靶分子存在时,会发生适应性的折叠,形成G-四面体等特殊的三维空间结构,通过特异性作用与靶分子紧密结合。这种结合前后的结构差异,可以通过电活性物质与电极表面的距离改变来识别,从而引起电化学信号的改变达到检测靶分子的目的[85~89]。目前用来对核酸适配体进行标记的电活性物质主要有二茂铁、亚甲基兰等。
Radi等[90]报道了识别K+的singal on型的电化学传感器。将二茂铁标记的巯基DNA通过自组装固定在金电极表面作为捕获探针 (图7),溶液中没有K+时,柔性单链DNA的二茂铁远离电极表面,电流信号较小。当加入K+后,DNA与K+形成G-四面体,二茂铁靠近电极表面,电流信号变大。该方法检测钾离子的线性范围为0.1~10 mmol/L,检出限为 0.015 mmol/L。Han 等[91]也利用类似的原理检测 Hg2+,线性范围为 0.1~2 μmol/L,检出限为0.1 μmol/L。并且可以重复使用。
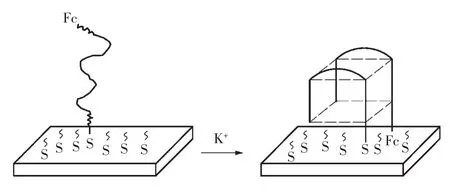
图7 应用电化学原理根据适体构象变化检测K+[90]Fig.7 An electrochemical aptasensor for selective detection of,K+based on the conformational change of aptamer[90]
电化学方法具有仪器简单、成本较低、灵敏度和特异性较好等优点,但需要对功能核酸进行电化学标记,因此仍有待于进一步发展。
4 总结和展望
该文对近些年来基于功能核酸的金属离子检测方面的研究工作做了综述,并比较了各种方法的优缺点(表1)。功能核酸具有很多的优越性,如稳定性好,成本低,易于合成和修饰等,所报道的检测方法大多简单、方便,灵敏度高、选择性好,能够在水溶液中进行检测,因此具有良好的应用前景。但是目前仍然存在着一些需要解决的问题。
(1)多数方法在体外展开,并且目前主要以纯品作为研究体系,在实际样品中的应用较少。主要是部分方法存在着灵敏度不够,容易受杂质干扰等缺点,在临床试验中体液等的检测、环境样品的实时、原位监测等方面仍然难以得到应用。但随着纳米技术的发展,更多生物相容性好、低毒性的纳米粒子的发现以及更多新方法的建立等将为金属离子的原位检测创造条件。
(2)目前针对特定金属离子检测的功能核酸的种类还较少,使得应用范围受到限制。因此筛选更多的高特异性功能核酸对于功能核酸在生物检测领域的应用具有重要意义。目前SELEX过程主要在实验室条件下通过多轮PCR和分离进行,耗时耗力且效率较低。因此急需发展更加快速简便的方法来提高筛选的效率,例如结合高通量的芯片筛选模式,以及结合计算机分子模拟方法等,加快筛选进程,获得更多种类的功能核酸。
(3)在已有的功能核酸中,Ag+、Hg2+等的检测主要依赖于碱基与金属离子的特异性作用,而对序列的依赖性较低,这也为更加灵活的设计传感策略提供了方便。
综上所述,利用功能核酸来检测金属离子已经取得了很好的发展,这些检测方法具有简便快速、成本低廉、重复性好、灵敏度和选择性较为理想,因此受到广泛关注。但是在实际样品的检测中仍存在较多问题。希望在不久的将来,通过生物学家、化学家、物理学家等的共同努力,伴随纳米技术、计算机技术、微机电技术的快速发展,基于功能核酸的生物传感器能够进入实用阶段,实现现场、原位、高通量检测,并向微型化、多样化和人工智能化方向发展,满足临床检验、环境监测等领域的需要。
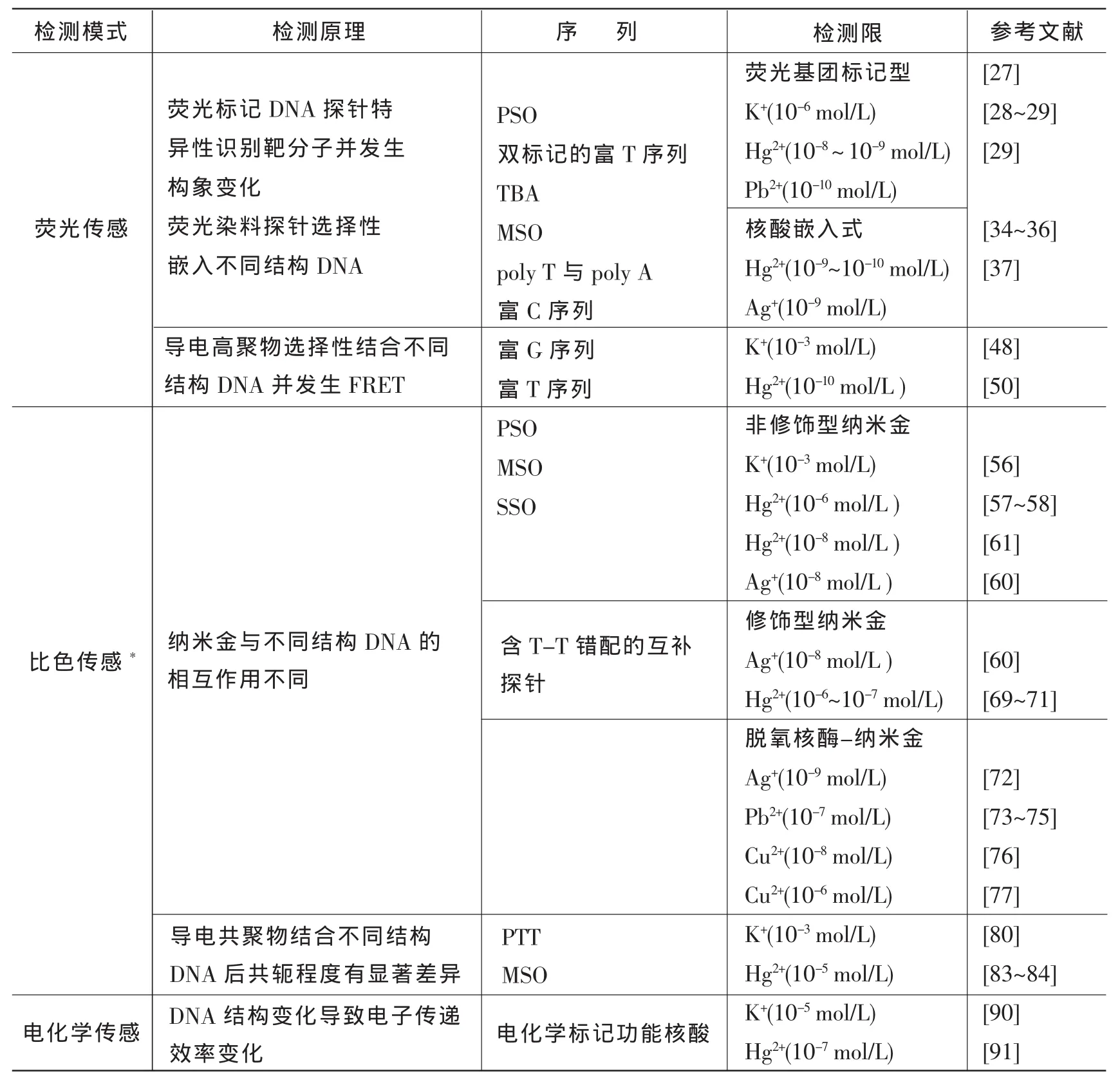
表1 基于功能核酸的金属离子检测方法对比表Tab.1 Comparision if metal ions analysis methods based on functional nucleic acids
[1]Trautwein A X.Bioorganic chemistry[M].Wiley-VCH,Weinhein,1997.
[2]Merian E.Metals and their compounds in the environment[M].Wiley-VCH,Weinheim,1991.
[3]He H,Mortellaro M A,Leiner M J P,et al.A fluorescent sensor with high selectivity and sensitivity for potassium in water[J].J Am Chem Soc,2003,125(6):1 468~1 469.
[4]Yang H,Zhou Z G,Huang K W,et al.Multisignaling optical-electrochemical sensor for Hg2+based on a rhodamine derivative with a ferrocene unit[J].Org Lett,2007,9(23):4 729~4 732.
[5]Lee M H,Cho B,Yoon J Y,et al.Selectively chemodosimetric detection of Hg(Ⅱ)in aqueous media[J].OrgLett,2007,9(22):4 515~4 518.
[6]Praveen L,Ganga V B,Thirumalai R,et al.A new Hg2+-selective fluorescent sensor on a 1,3-alternate thiacalix[4]arene anchored with four 8-quinolinoloxy groups[J].Inorg Chem,2007,46(16):6 277~6 282.
[7]Wegner S V,Okesli A,Chen P,et al.Design of an emission ratiometric biosensor from MerR family proteins:a sensitive and selective sensor for Hg2+[J].J Am Chem Soc,2007,129(12):3 474~3 475.
[8]Miiyake Y,Togashi H,Tashiro M,et al.MercuryⅡ-Mediated Formation of Thymine-HgⅡ-Thymine Base Pairs in DNA Duplexes[J].J Am Chem Soc,2006,128(7):2 172~2 173.
[9]Yang Y K,Yook K J,Tae J.A rhodamine-based fluorescent and colorimetric chemodosimeter for the rapid detection of Hg2+ions in aqueous media [J].J Am Chem Soc,2005,127(48):16 760~16 761.
[10]Peng X J,Du J J,Fan J L,et al.A Selective Fluorescent Sensor for Imaging Cd2+in Living Cells[J].J Am Chem Soc,2007,129(6):1 500~1 501.
[11]Sullenger B A,Gilboa E.Emerging clinical applications of RNA[J].Nature,2002,418:252~258.
[12]Nimjee S M,Rusconi C P,Sullenger B A.Aptamer:An emerging class of therapeutics [J].Annu Rev Med,2005,56:555~583.
[13]Cho E J,Rajendran M.Ellington A D [J].Top Fluoresc Spectrosc,2005,10:127.
[14]Famulok M,Verma S.In vivo-applied functional RNAs as tools in proteomics and genomics research[J].Trends Biotechnol,2002,20(11):462~466.
[15]Ravelet C,Grosset C,Peyrin E.Liquid chromatography,electrochromatography and capillary electrophoresis applications of DNA and RNA aptamers[J].J Chromatogr A,2006,1117(1):1~10.
[16]Lu Y,Liu J.Smart nanomaterials inspired by biology:Dynamic assembly of error-free nanomaterials in response to multiple chemical and biological stimuli [J].Acc Chem Res,2007,40(5):315~323.
[17]Storhoff J J,Mirkin C A.Programmed materials synthesis with DNA[J].Chem Rev,1999,99(7):1 849~1 862.
[18]Silverman S K.Catalytic DNA (deoxyribozymes)for synthetic applications-current abilities and future prospects[J].Chem Commun,2008,3 467~3 485.
[19]Famulok M,Mayer G,Blind M.Nucleic acid aptamers-From selection in vitro to applications in vivo [J].Acc Chem Res,2000,33(9):591~599.
[20]Song S P,Wang L H,Li J,et al.Aptamer-based biosensor[J].Trac-Trend Anal Chem,2008,27(2):108~117.
[21]Hesselberth J,Robertson M P,Jhaveri S,et al.In vitro selection of nucleic acids for diagnostic applications[J].Rev Mol Biotechnol,2000,74(1):15~25.
[22]Breaker R R.Engineered allosteric ribozymes as biosensor components[J].Curr Opin Biotechnol,2002,13(1):31~39.
[23]Jiang Y X,Zhu C F,Ling L S,et al.Specific aptamerprotein interaction studied by atomic force microscopy[J].Anal Chem,2003,75(9):2 112~2 116.
[24]Tombelli S,Minunni M,Mascini M.Analytical applications of aptamers[J].Biosens Bioelectron,2005,20(12):2 424~2 434.
[25]Yang Y,Yang D L,Schluesener H J,et al.Advances in SELEX and application of aptamers in the central nervous system[J].Biomol Eng,2007,24(6):583~592.
[26]Willner I,Shlyahovsky B,Zayats M,et al.DNAzymes for sensing,nanobiotechnology and logic gate applications[J].Chem Soc Rev,2008,37:1 153~1 165.
[27]Ueyama H,Takagi M,Takenaka S.A novel potassium sensing in aqueous media with a synthetic oligonucleotide derivative fluorescence resonance energy transferassociated with guanine quartet-potassium ion complex formation[J].J Am Chem Soc,2002,124(48):14 286~14 287.
[28]Ono A,Togashi H.Highly selective oligonucleotidebased sensor for mercury(Ⅱ)in aqueous solutions[J].Angew Chem Int Ed,2004,43(33):4 300~4 302.
[29]Liu C W,Huang C C,Chang H T.Highly Selective DNA-Based Sensor for Lead(Ⅱ)and Mercury(Ⅱ)ions[J].Anal Chem,2009,81(6):2 383~2 387.
[30]Zipper H,Brunner H,Bernhagen J,et al.Investigations on DNA intercalation and surface binding by SYBR Green I,its structure determination and methodological implications[J].Nucleic Acids Res,2004,32(12):e103
[31]Wang Y Y,Liu B.ATP detection using a label-free DNA aptamer and a cationic tetrahedralfluorene[J].Analyst,2008,133:1 593~1 598.
[32]Lee K,Maisel K,Rouillard J M,et al.Sensitive and selective label-free DNA detection by conjugated polymerbased microarrays and intercalating dye [J].Chem Mater,2008,20(9):2 848~2 850.
[33]Li B L,Wei H,Dong S J.Sensitive detection of protein by an aptamer-based label-free fluorescing molecular switch[J].Chem Comm,2007,1:73~75.
[34]Wang J,Liu B.Highly sensitive and selective detection of Hg2+in aqueous solution with mercury-specific DNA and Sybr Green I[J].Chem Comm,2008,39:4 759~4 761.
[35]Chiang C K,Huang C C,Liu C W,et al.Oligonucleotide-Based Fluorescence Probe for Sensitive and Selective Detection of Mercury(Ⅱ)in Aqueous Solution[J].Anal Chem,2008,80(10):3 716~3 721.
[36]Liu B.Highly sensitive oligonucleotide-based fluormetric detection of mercury(Ⅱ)in aqueous media[J].Biosens Bioelectron,2008,24(4):762~766.
[37]Yang Q,Gao S L,Wen Y Q,et al.Highly sensitive and selective detection of silver ions in aqueous with silverspecific oligonucleotide and SYBR Green I.Submitted.
[38]Kong D M,Ma Y E,Wu J,et al.Discrimination of G-quadruplexes from duplex and single-stranded DNAs with fluorescence and energy-transfer fluorescence spectra of crystal violet[J].Chem Eur J,2009,15 (4):901~909.
[39]Kong D M,Ma Y E,Guo J H,et al.Fluorescent sensor for monitoring structural changes of G-quadruplexes and detection of potassium Ion[J].Anal Chem,2009,81(7):2 678~2 684.
[40]Chen L H,McBranch D,Wang R,et al.Surfactant-induced modification of quenching of conjugated polymer fluorescence by electron acceptors:application for chemical sensing[J].Chem Phys Lett,2000,330(1-2):27~33.
[41]Zhou Q,Swager T M.Method for enhancing sensitivity of fluorescent chemosensors:energy migration in conjugated polymers[J].J Am Chem Soc,1995,117(26):7 017~7 018.
[42]Swager T M.The molecular wire approach to sensory signal[J].Acc Chem Res,1998,31(5):201~207.
[43]Zhou Q,Swager T M.Fluorescent chemosensors based on energy migration in conjugated polymers:The molecular wire approach to increased sensitivity[J].J Am Chem Soc,1995,117(50):12 593~12 602.
[44]冯继昌,李扬,杨慕杰.共轭聚合物离子荧光化学传感器 [J].化学进展,2008,20(12):2 012~2 020.
[45]刘兴奋,王丽华,宋世平,等.基于共轭高分子材料的光学生物传感器[J].化学进展,2008,20(9):1 375~1 384.
[46]Xu H,Wu H P,Fan C H,et al.Highly sensitive biosensors based on water-soluble conjugated polymers[J].Chinese Sci Bull,204,49(21):2 227~2 231.
[47]Xu H,Wu H P,Huang F,et al.Magnetically assisted DNA assays:high selectivity using conjugated polymers for amplified fluorescent transductin [J].Nucleic Acids Research,2005,33(9):e83.
[48]He F,Tang Y L,Wang S,et al.Fluorescent amplifying recognition for DNA G-quadruplex folding with a cationic conjugated polymer:A platform for homogeneous potassium detection[J].J Am Chem Soc,2005,127(35):12 343~12 346.
[49]He F,Tang Y L,Yu M H,et al.Quadruplex-to-duplex transition of G-rich oligonucleotides probed by cationic water-soluble conjugated polyelectrolytes[J].J Am Chem Soc,2006,128(21):6 764~6 765.
[50]Ren X S,Xu Q H.High sensitive and selective detection of mercury ions by using oligonucleotides[J].Langmuir,2009,25(1):29~31.
[51]Wang Z X,Ma L N.Gold nanoparticle probes[J].Coord Chem Reve,2009,253(11-12):1 607~1 618.
[52]Pingarron J M,Yanez-Sedeno P,Gonzalez-Cortes A.Gold nanoparticle-based electrochemical biosensors[J].Electrochimica Acta,2008,53(19):5 848~5 866.
[53]Wei H,Li B L,Li J,et al.Simple and sensitive aptamerbased colorimetric sensing of protein using unmodified gold nanoparticle probes[J].Chem Commun,2007,36:3 735~3 737.
[54]Zhang J,Wang L H,Pan D,et al.Visual cocaine detection with gold nanoparticles and rationally engineered aptamer structure[J].Small,2008,4(8):1 196~1 200.
[55]Li H X,Rothberg L J.Label-free colorimetric detection of specific sequences in genomic DNA amplified by the polymerase chain reaction [J].J Am Chem Soc,2004,126(35):10 958~10 961.
[56]Wang L H,Liu X F,Hu X F,et al.Unmodified gold nanoparticles as a colorimetric probe for potassium DNA aptamers[J].Chem Comm,2006,36:3 780~3 782.
[57]Wang L H,Zhang J,Wang X,et al.Gold nanoparticlebased optical probes for target-responsive DNA structures[J].Gold Bulletin,2008,41(1):36~40.
[58]Li L,Li B X,Qi Y Y,et al.Label-free aptamer-based colorimetric detection of mercury ions in aqueous media using unmodified nanoparticles as colorimetric probe[J].Anal Bioanal Chem,2009,393(8):2 051~2 057.
[59]Ono A,Cao S Q,Togashi H,et al.Specific interactions between silver(Ⅰ)ions and cytosine-cytosine pairs in DNA duplexes[J].Chem Commun,2008,39:4 825~4 827.
[60]Li B L,Yan D,Dong X J.DNA based gold nanoparticlescolorimetric sensors for sensitive and selective detection of Ag(Ⅰ)ions[J].Anal Chim Acta,2009,664:78~82.
[61]Wang H,Wang Y X,Jin J Y,et al.Gold nanoparticlebased colorimetric and "turn-on"fluorescent probe for mercury(Ⅱ)ions in aqueous solution[J].Anal Chem,2008,80(23):9 021~9 028.
[62]Mirkin C A,Letsinger R L,Mucic R C,et al.A DNA-based method for rationally assembling nanoparticles into macroscopic materials[J].Nature,1996,382(6592):607~609.
[63]Pavlov V,Xiao Y,Shlyahovsky B,et al.Aptamer-functionalized Au nanoparticles for the amplified optical detection of thrombin[J].J Am Chem Soc,2004,126(38):11 768~11 769.
[64]Huang C C,Huang Y F,Cao Z H,et al.Aptamer-modified gold nanoparticles for colorimetric detection of platelet-derived growth factors and their recptors[J].Anal Chem,2005,77(17):5 735~5 741.
[65]Liu J W,Lu Y.Non-base pairing DNA provides a new dimension for controlling aptamer-linked nanoparticles and sensor[J].J Am Chem Soc,2007,129(27):8 634~8 643.
[66]Wang J L,Zhou H S.Aptamer-based Au nanoparticlesenhanced surface plasmon resonance detection of small molecules[J].Anal Chem,2008,80(18):7 174~7 178.
[67]Zhao W A,Chiuman W,Lam J C F,et al.DNA aptamer folding on gold nanoparticles:from colloid chemistry to biosensors[J].J Am Chem Soc,2008,130,(11):3 610~3 618.
[68]Chen W B,Tu X J,Guo X Q,et al.Fluorescent gold nanoparticles-based fluorescence sensor for Cu2+ions[J].Chem Commun,2009,13:1 736~1 738.
[69]Lee J S,Han M S,Mirkin C A.Colorimetric detection of mercuric ion (Hg2+)in aqueous media using DNA-functionalized gold nanoparticles[J].Angew Chem Int Ed,2007,46(22):4 093~4 096.
[70]刘兴奋,武海萍,李玉兰,等.一种高灵敏度、高特异性检测重金属Hg2+的比色生物传感方法[J].核技术,2007,30(5):467~472.
[71]Xue X J,Wang F,Liu X G.One-step,room temperature,colorimetric detection of mercury(Hg2+)using DNA/nanoparticle conjugates[J].J Am Chem Soc,2008,130(11):3 244~3 245.
[72]Li T,Shi L L,Wang E K,et al.Silver-ion-mediated DNAzyme switch for the ultra sensitive and selective colorimetric detection of aqueous Ag+and cysteine[J].Chem Eur J,2009,15(14):3 347~3 350.
[73]Liu J W,Lu Y J.A colorimetric lead biosensor using DNAzyme-directed assembly of gold nanoparticles[J].J Am Chem Soc,2003,125(22):6 642~6 643.
[74]Liu J W,Lu Y J.Optimization of a Pb2+-directed gold nanoparticle/DNAzyme assembly and its application as a colorimetric biosensor for Pb2+[J].Chem Mater,2004,16(17):3 231~3 238.
[75]Liu J W,Lu Y J.Accelerated color change of gold nanoparticles assembled by DNAzymes for simple and fast colorimetric Pb2+detection[J].J Am Chem Soc,2004,126(39):12 298~12 305.
[76]Liu J W,Lu Y J.A DNAzyme catalytic beacon sensor for paramagnetic Cu2+ions in aqueous solution with high sensitivity and selectivity[J].J Am Chem Soc,2007,129(32):9 838~9 839.
[77]Liu J W,Lu Y J.Colorimetric Cu2+detection with a ligation DNAzyme and nanoparticles[J].Chem Commun,2007,46:4 872~4 874.
[78]Ho H A,Boissinot M,Bergeron M G,et al.Colorimetric and fluorometric detection of nucleic acids using cationic polythiophene derivatives[J].Angew Chem Int Ed,2002,41(9):1 548~1 551.
[79]Ho H A,Leclerc M.New colorimetric and fluorometric chemosensor based on a cationic polythiophene derivative for iodide-specific detection[J].J Am Chem Soc,2003,125(15):4 412~4 413.
[80]Ho H A,Leclerc M.Optical sensors based on hybrid aptamer/conjugated polymer complexes[J].J Am Chem Soc,2004,126(5):1 384~1 387.
[81]Ho H A,Bera-Aberem M,Leclerc M.Optical Sensors Based on Hybrid DNA/Conjugated Polymer Complexes[J].Chem Eur J,2004,11(6):1 718~1 724.
[82]Ho H A,Dore K,Boissinot M,et al.Direct molecular detection of nucleic acids by fluorescence signal amplification[J].J Am Chem Soc,2005,127(36):12 673 ~12 676.
[83]Tang Y L,He F,Yu M H,et al.A reversible and highly selective fluorescent sensor for mercury(Ⅱ)using poly(thiophene)s that contain thymine moieties[J].Macromol Rapid Comm,2006,27(6):389~392.
[84]Liu X,Tang Y,Wang L,et al.Optical detection of mercury(Ⅱ)in aqueous solutions by using conjugated polymers and label-free oligonucleotides[J].Adv Mater,2007,19(11):1 471~1 474.
[85]Xiao Y,Piorek B D,Plaxco K W,et al.Reagentless Sig-nal-on architecture for electronic,aptamer-based sensors via target-induced strand displacement[J].J Am Chem Soc,2003,125(51):17 990~17 991.
[86]Baker B R,Lai R Y,Wood M S,et al.An electronic,aptamer-based small-molecule sensor for the rapid,label-free detection of cocaine in adulterated samples and biological fluids[J].J Am Chem Soc,2006,128(10):3 138~3 139.
[87]Zou X L,Song S P,Zhang J,et al.A Target-responsive electrochemical aptamer switch(TREAS)for reagentless detection of nanomolar ATP[J].J Am Chem Soc,2007,129(5):1 042~1 043.
[88]Li B L,Du Y,Wei H,et al.Reusable,label-free electrochemical aptasensor forsensitive detection of small molecules[J].Chem Commun,2007,36:3 780~3 782.
[89]Lu Y,Zhu N N,Yu P,et al.Aptamer-based electrochemical sensors that are not based on the target binding-induced conformational change of aptamer[J].Analyst,2008,133:1 256~1 260.
[90]Radi A E,O'Sullivan C K.Aptamer conformational switch as sensitive electrochemical biosensor for potassium ion recognition[J].Chem Comm,2006,32:3 432~3 434.
[91]Han D H,Kim Y R,Oh J W,et al.A regenerative electrochemical sensor based on oligonucleotide for the selective determination of mercury(Ⅱ)[J].Analyst,2009,9:1 857~1 862.

