电沉积Ni纳米颗粒在碱性条件下对葡萄糖的直接电催化氧化
邢 亮,刘晓颖,曾宪冬,买楠楠,魏万之*
(1.湖南大学化学生物传感与计量学国家重点实验室,化学化工学院,湖南长沙410082)
(2.湖南师范大学树达学院,湖南长沙410012)
0 引言
人体血液中的各种化学成分一直是评价人体健康状况的重要信息。而血糖水平则是衡量新陈代谢能力和糖尿病临床诊断的重要指标。目前临床上最常用的葡萄糖检测方法是葡萄糖氧化酶(GOD)分析法,具有专一性高、反应速度快的特点。利用葡萄糖氧化酶测定葡萄糖的酶催化分析法而研制的酶传感器是开展得最早也是最成功的生物化学传感器之一。但由于酶本身固有属性,如酶的活性随时间降低,温度对活性的影响和酶的使用费用高等弱点[1]。同时,构建酶传感器时难以把酶固定在电极表面[2],这些都限制了酶传感器的应用。
利用固体催化电极传感器来测定葡萄糖[3],电极可反复多次使用,检测时间短,费用低,稳定性好,保存容易等优点,逐渐成为研究的热点。对葡萄糖具有电催化活性并可用于葡萄糖测定的金属(或其金属氧化物)电极材料有铂、金、铱、钛、铑、钌、铜、钴和镍[4]。同时,人们发现纳米材料拥有特殊的结构,表现出表面效应、小尺寸效应、量子尺寸效应和隧道效应等,从而优化了材料的电学性能。合成金属Ni纳米颗粒的方法有很多,例如近年来许多科学家通过化学气相沉积、湿化学等方法已成功地将镍纳米粒子分散在碳纳米管表面,但用电沉积法制备Ni纳米粒子的方法与其它制备方法相比,电沉积法制备Ni纳米粒子的方法具有设备简单、成本低,易大量制备,工艺参数容易控制,沉积温度低,沉积的纳米粒子不容易脱落等优点[5],因而越来越受到学者关注。
该实验利用电化学沉积的方法在金电极上修饰Ni纳米颗粒,探讨了电极的制备条件,研究了它在碱性条件下对β-D葡萄糖的检测限和响应线性范围;最后,还考察了该传感器的重现性和稳定性。
1 实验部分
1.1 试剂与仪器
氯化镍(分析纯,天津市大茂化学试剂厂);β-D葡萄糖购自ICN生物试剂公司(英国),葡萄糖贮备液使用前在室温下变旋过夜;浓度为0.1 mol/L的NaOH溶液作支持电解质;其它试剂如未特别说明均为分析纯;实验用水为二次蒸馏水,实验都在室温(25℃)下进行。
CHI 660A电化学工作站 (上海辰华仪器公司),电化学实验采用经典的三电极体系:以该文制备的纳米Ni颗粒修饰电极为工作电极,铂片电极为对电极,参比电极为Ag|AgCl|KCl(3 mol/L),所有的电位均是相对于参比电极而言的,电流测量在搅拌条件下进行,搅拌速率约为300 r/min;超声清洗机(宁波新芝生物科技公司);电子天平(德国梅特勒-托利多公司);Sirion 200型场发射扫描电子显微镜(美国)。
1.2 电沉积Ni纳米修饰电极的制备
在制备修饰电极之前,金电极(直径2 mm)首先进行打磨预处理。预处理程序如下:首先将金电极在麂皮上分别用 0.3 和 0.05 μm 的 Al2O3粉末抛光最终至光滑镜面,每次抛光后均在超声清洗仪中超声清洗2 min。打磨好的金电极放在0.5 mol/L的硫酸溶液中以50 mV/s进行扫描,扫描范围在0~1.5 V 内,如果电极在1.3 V左右出现氧化峰,在0.85 V左右出现一尖锐的还原峰,说明裸金电极的表面已经打磨完好,电极的导电能力达到最好。这道程序可以保障在下一步修饰时的电极界面是光滑的,提高修饰电极的准确性与可靠性,并且对电极进行了活化预处理。
将预处理好的金电极依次在二次蒸馏水和丙酮溶液中清洗5 min,然后将清洗好的金电极表面用N2吹干,就可以进行电极修饰了,修饰方法如下:将电极置于浓度为 1.0 mmol/L氯化镍(NiCl2)、pH=4.0 的 HAc-NaAc 缓冲溶液中,在-0.8 V的恒电位条件下沉积20 min,所得修饰电极用二次蒸馏水清洗,晾干待用。
2 结果与讨论
2.1 电沉积Ni纳米颗粒修饰电极的扫描电镜图
采用扫描电子显微镜对文中的修饰Ni纳米颗粒进行了表征。图1所示为电沉积Ni纳米颗粒材料在金电极表面的扫描电镜图。
由图可见,Ni纳米颗粒均一地分散在金电极表面,Ni纳米颗粒的直径约为30~60 nm。这种电沉积形成的Ni纳米颗粒能非常稳定地固定在电极表面,不容易脱落;均一分散的Ni纳米颗粒比单一的以金属Ni板制成的电极具有更大的表面积,形成了更多的电催化活性中心,大大提高了催化性能,从而能更好地催化氧化葡萄糖。Afsaneh等[6]研究表明,这种颗粒状的Ni纳米材料比针状Ni纳米材料更有利于催化氧化葡萄糖。
2.2 电沉积Ni纳米颗粒修饰电极的电化学性质
首先将裸金电极和电沉积Ni纳米颗粒修饰电极在0~0.8 V 的电位范围内,在 0.1 mol/L 浓度的NaOH溶液中用循环伏安法扫描,扫描速率为50 mV/s,主要考察Ni纳米颗粒修饰电极的电化学性质。实验中观察到Ni纳米颗粒修饰电极在0.52 V和0.6 V两个电位出现了一对定义很好的氧化还原峰(图2中实线所示)。在相同实验条件下,裸金电极上观察不到相应的峰电流响应(图2中虚线所示)。参考以往文献[7]报道,推断这对氧化还原峰对应为二价/三价金属镍离子在电极上发生氧化还原反应,反应方程式为:


葡萄糖是一种碳水化合物,在碱性条件下容易被催化氧化。在含有葡萄糖的0.1 mol/L NaOH溶液中,在一定的电位条件下,电沉积的Ni纳米颗粒修饰电极上发生的反应为:
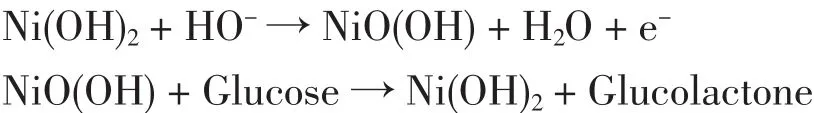

图1 金电极上沉积Ni纳米颗粒的SEM图Fig.1 SEM image of the deposited Ni nanoparticles at Au electrode
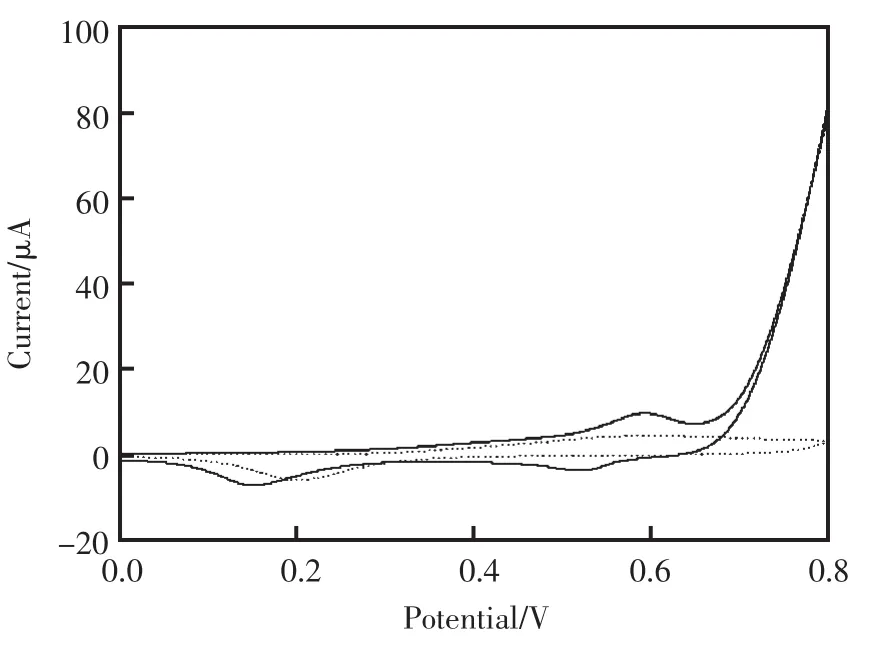
图2 Ni纳米颗粒修饰电极(实线)和裸金电极(虚线)在0.1 mol/L NaOH溶液中的循环伏安图Fig.2 Cyclic voltammograms at Ni nanoparticles modified golden electrode(solid line),bare golden electrode(dotted line)in 0.1 mol/L NaOH
从上述两式表明,葡萄糖的电催化氧化过程是借助于Ni(Ш)在此过程中扮演的氧化剂角色,使葡萄糖在Ni纳米颗粒上被氧化。同时,根据文献[8~9],改变电位扫描速度,阳极峰电位稍微正移,峰电流随电位扫描速度的增加而增大,峰电流与电位扫描速度的平方根成正比,说明葡萄糖在Ni电极上的电化学氧化受葡萄糖的扩散控制。
2.3 修饰电极响应条件的优化
电沉积Ni纳米颗粒的表面状况和尺寸大小直接影响着传感器对葡萄糖的响应。而实验中影响上述因素的主要实验条件是沉积纳米镍的pH值选择,Ni2+浓度的大小,应用沉积电位的大小,沉积时间的长短等。为了得到颗粒直径为纳米级、分布均一的Ni粒子,根据参考文献[10~11]报道:沉积Ni纳米材料一般选择在弱酸性溶液中,pH 值多为 3.0~4.0 之间, 实验中选择在 pH=4.0的醋酸和醋酸钠的缓冲溶液中进行,Ni2+浓度选择为 1.0 mmol/L;沉积恒电位选择在 -0.8 V。 电沉积纳米晶和粗晶的溶液相比,pH值和电流密度不同。纳米晶沉积时pH值很低,电流密度很大,而常规晶体电沉积时pH值较高,但是电流密度较低,pH值低、电流密度高增强了阴极极化程度,降低了金属的电沉积速度,增大了晶核的生成速度,有利于晶粒细化。而且pH值低和电流密度高使得大量氢离子放电,氢离子吸附以及还原,为金属离子还原提供了新的晶核,也使结晶更加细致。镍电极仅在碱性条件下对葡萄糖有电催化氧化作用,俞建国等[12]通过实验发现,当pH>10.0时,电极对葡萄糖的响应非常小,随着NaOH溶液浓度的不断升高,Ni电极对葡萄糖的响应峰电位逐步降低,氧化峰电流同时增大;pH>12.0增加更快;但是,大多数碳水化合物在较高的pH条件下都容易被氧化[13];在强碱性条件下,葡萄糖容易被其它的氧化介质氧化或解离,对测定结果产生负误差。因此,测定葡萄糖时也应尽可能避免底液碱性过强。一般情况下,文献中使用Ni材料电极测定葡萄糖时选用碱性介质的pH值为13或稍高[3,14~15],因此,文中选择0.1 mol/L NaOH(pH=13.0)溶液作为测定葡萄糖的支持电解液。
确定了上述条件后,首先考察了不同沉积时间的试验条件下,电沉积Ni纳米颗粒修饰电极在0.65 V电位条件下,0.1 mol/L的NaOH底液中对加入0.25 mmol/L葡萄糖溶液的响应。如图3所示,不同沉积时间的Ni纳米颗粒修饰电极对0.25 mmol/L葡萄糖溶液的响应值是先增大后减小,沉积时间是20 min时出现最大值。当沉积时间小于20 min时,金电极表面沉积的Ni纳米颗粒还没有达到饱和,电催化反应的活性中心还可以继续增多。所以,随着沉积时间的延长对加入0.25 mmol/L葡萄糖溶液的电流响应不断增加;但是,当沉积时间超过20 min后,Ni纳米粒子可能发生了团聚,从而使电极的表面积减小,颗粒的直径也增大,反应活性中心数目减少,所以,对加入0.25 mmol/L葡萄糖溶液的响应反而逐步减小。
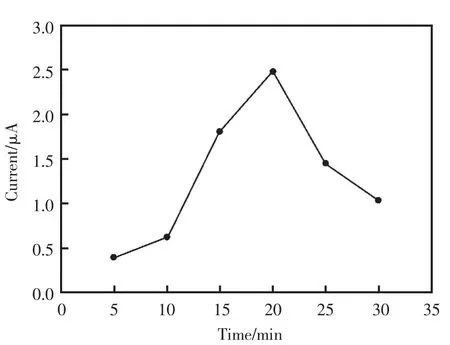
图3 沉积时间对在0.1 mol/L的NaOH底液中测定0.25 mmol/L 葡萄糖的影响Fig.3 Effect of electrodeposition time on the golden electrode to addition of 0.25 mmol/L glucose in 0.1 mol/L NaOH
接下来讨论了在不同的电位条件下,电沉积纳米Ni电极对葡萄糖的响应情况。选择了不同电位条件 (0.575,0.6,0.625,0.65,0.675,0.7 V)进行试验。由图4可知,随着电位的不断升高,对0.25 mmol/L葡萄糖的电流响应值也逐步增加,当电位达到0.65 V后,增幅变小。综合考虑到其它干扰因素会因为电位的升高而增大,所以,选择在0.65 V的电位条件下测量葡萄糖的浓度。
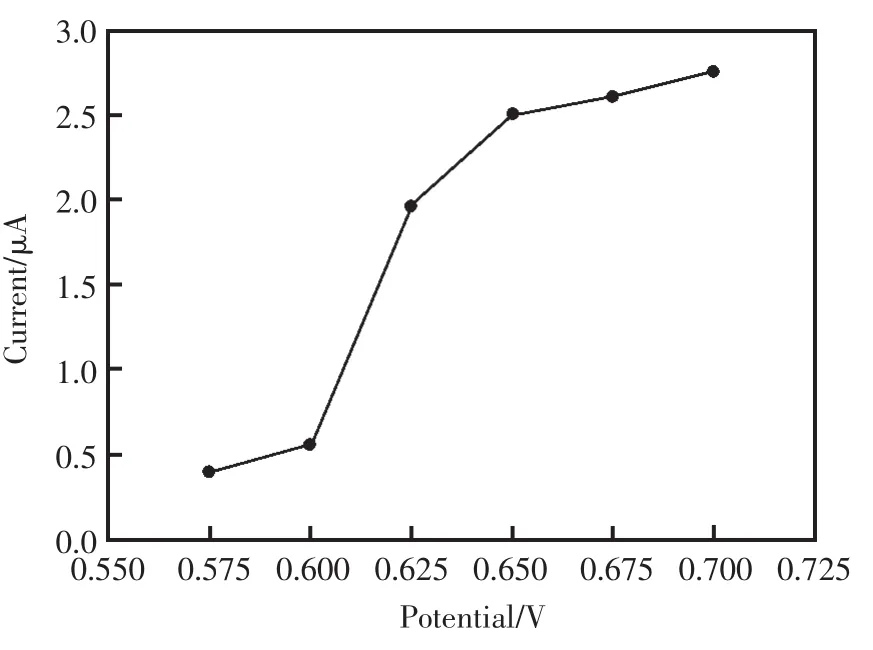
图4 不同应用电位对在0.1 mol/L的NaOH底液中测定0.25 mmol/L葡萄糖的影响Fig.4 Influence of different applied potentials toward 0.25 mmol/L glucose by amperometric responses in 0.1 mol/L NaOH solution
2.4 修饰电极实时电流检测葡萄糖
电沉积Ni纳米颗粒葡萄糖传感器在上述讨论确定的最佳实验条件下,用沉积了20 min Ni纳米颗粒修饰金电极,在0.1 mol/L NaOH (pH=13.0)底液中,应用0.65 V的电位来测定葡萄糖。
图5所示为该传感器连续加入0.25 mmol/L浓度葡萄糖时的电流-时间响应曲线,电流响应在3 s达到稳定。图6所示为该无酶生物传感器测定葡萄糖的校正曲线,葡萄糖浓度在10.0 μmol/L~2.5 mmol/L范围内与响应电流成线性关系(相关系数为 0.996 9),检测限为 5.0 μmol/L。 其响应时间、检测限和响应线性范围都要优于常规Ni材料传感器。
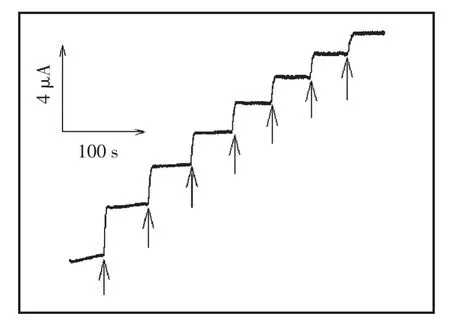
图5 Ni纳米修饰电极在0.1 mol/L的NaOH底液中对连续加入0.25 mmol/L葡萄糖的电流-时间图(应用电位:0.65 V)Fig.5 The current-time responses of the Ni nanoparticles electrode to the successive addition of 0.25 mmol/L glucose solutions in 0.1 mol/L NaOH at 0.65 V
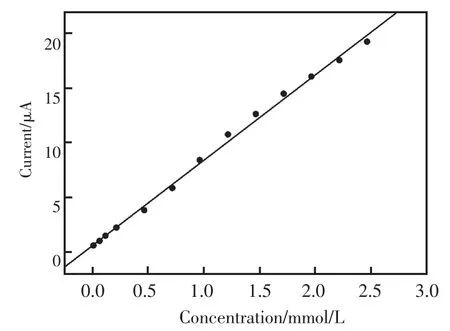
图6 在0.1 mol/L的NaOH底液中Ni纳米颗粒修饰电极对葡萄糖浓度响应的标准曲线(应用电位:0.65 V)Fig.6 Calibration curve of the response of the Ni nanoparticles electrode to glucose concentration in 0.1 mol/L NaOH at 0.65 V
2.5 修饰电极的重现性与稳定性
表1所示,用同一电沉积Ni纳米颗粒修饰电极对0.25 mmol/L葡萄糖连续进行7次平行测定,其相对标准偏差为4.6%。该结果表明该修饰电极有较好的准确性和重现性。该无酶传感器不使用时,也不需要特殊保存。15天后,用该电极测量一个0.25 mmol/L葡萄糖样本得出的结果是2.38 μA,其测量值仍保持最初电流响应值的95%;30天后,再次用该电极测量一个 0.25 mmol/L葡萄糖样本得出的结果是2.31 μA,其测量值仍保持最初电流响应值的92%。表明该电极具有良好的稳定性。
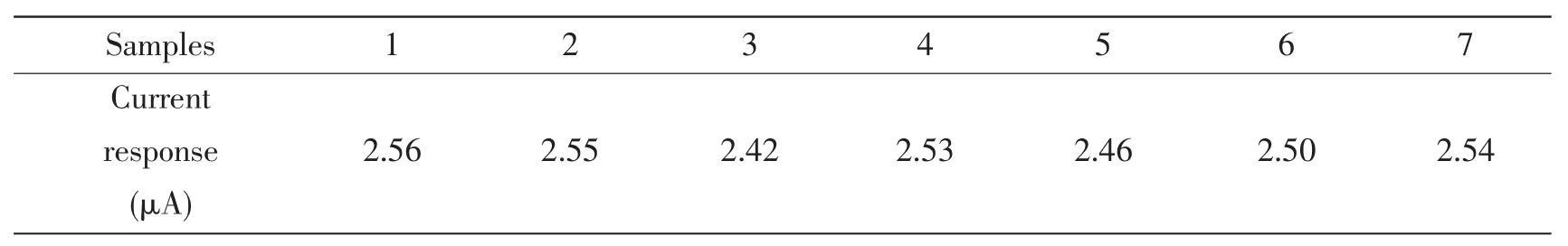
表1 7次平行测定0.25 mmol/L葡萄糖的电流响应值Tab.1 Responses to seven times parallel determination of addition 0.25 mmol/L glucose
3 结论
该文提出了一种简易的恒电位沉积Ni纳米颗粒的方法,将Ni纳米颗粒固定到金电极表面。相对于常规Ni材料构建的电极,这种Ni纳米颗粒修饰的电极具有对葡萄糖响应灵敏度高,响应时间快,线性范围宽,制备方法简单易行等优点。因此,该修饰电极可以作为一种具备一定应用前景的无酶葡萄糖传感器。另外,根据Ni纳米粒子对葡萄糖的电催化氧化机理,该电极还可能应用于甲醇或其它醛糖类物质的检测。
[1]Wilson R,Turner A P F.Glucose oxidase:an ideal enzyme[J].Biosens.Bioelectron,1992,7:165~185.
[2]Fu Y C,Chen C,Xie Q J,et al.Immobilization of Enzymes through One-Pot Chemical Preoxidation and Electropolymerization of Dithiols in Enzyme-Containing Aqueous Suspensions To Develop Biosensors with Improved Performance[J].Anal,Chem,2008,80:5 829~5 838.
[3]Zhao C Z,Shao C L,L iM H,et al.Flow-injection analysis of glucose without enzyme based on electrocatalytic oxidation of glucose at a nickel electrode[J].Talanta,2007,71:1 769~1 773.
[4]Park S,Boo H,Chung T D.Electrochemical non-enzymatic glucose sensors[J].Analytica Chimica Acta,2006,556:46~57.
[5]王立平,高燕,薛群基,等.电沉积镍纳米晶材料制备及性能[J].电镀与涂饰,2004,23(3):1~2.
[6]Afsaneh Safavi,Norouz Maleki,Elaheh Farjami.Fabrication of a glucose sensor based on a novel nanocomposite electrode[J].Biosens.Bioelectron,2009,24:1 655~1 660.
[7]Salimi A,Sharifi E,Noorbakhsh A,et al.Direct voltammetry and electrocatalytic properties of hemoglobin immobilized on a glassy carbon electrode modified with nickel oxide nanoparticles[J].Electrochem Commun,2006,8(9):1 499~1 508.
[8]赵常志,张志慧,葛童,等.无酶葡萄糖传感器 [J].应用化学,2007,24(2):192~195.
[9]Abdollah Salimi,Mahmoud Roushani.Non-enzymatic glucose detection free of ascorbic acid interference using nickel powder and nafion sol-gel dispersed renewable carbon ceramic electrode [J].Electrochemistry Communications,2005,7:879~887.
[10]Ali Mohammadi,Abdolmajid BayandoriMoghaddam,Mahmood Kazemzad,et al.Synthesis of nickel oxides nanoparticles on glassy carbon as an electron transfer facilitator for horseradish peroxidase:Direct electron transfer and H2O2determination[J].Materials Science and Engineering C,2009,29:1 752~1 758.
[11]Kaja S,Pickering H W,Bitler W R.Effect of pH on the microstructure of nickel electrodeposits:A TEM study[J].Plat&Surf Finish,1988,75(1):58~61.
[12]俞建国,李建平.高选择性的镍基无酶葡萄糖微传感器的研制及应用[J].分析化学,2008,36(9):1 201~1 206.
[13]D′Eramo F,Marioli J M,Arevalo A A,et al.HPLC Analysis of Carbohydrates with Electrochemical Detection at a Poly-1-naphthylamine/Copper Modified Electrode[J].Electro-analysis,1999,11(7):481~486.
[14]QuintinoM S M,Winnischofer H,Nakamura M,et al.Amperometric sensor for glucose based on electrochemically polymerized tetraruthenated nickelporphyrin[J].Analytica Chimica Acta,2005,539(1):215~222.
[15]Salimi A,Roushani M.Non-enzymatic glucose detection free of ascorbic acid interference using nickel powder and nafion sol-gel dispersed renewable carbon ceramic electrode[J].Electrochem.Commun.,2005,7(9):879~887.

