碳纳米管-表面活性剂修饰的H2O2酶电极
史汶灵,屈永霞,范小雪,张智慧,黄杉生
(上海师范大学生命与环境科学学院,上海200234)
0 引言
酶生物传感器用于环境中农药残留的检测,因其具有高度的选择性、结构简单、检测速度快,成本低,利于在线、可应急监测而引起人们的越来越多关注。纳米材料制备技术、生物技术的发展为扩展生物传感器的应用范围、提高其灵敏度、微型化打下了坚实的基础,极大地促进了酶生物传感器的研究与应用[1~3]。
酶生物传感器用于检测农药残留的原理主要有两种:(1)利用酶的催化放大作用和免疫分析的高特异性,酶催化底物发生相应的水解、氧化或还原反应,形成具有电活性的产物,进而采用不同的电分析方法进行测定[4];(2)利用农药与酶结合来抑制酶的活性,农药的浓度与酶被抑制的活性成一定的数学关系,从而实现对农药残留量的检测[1]。作为生物传感器关键组成物-活性酶的固定技术将直接影响传感器的稳定性、灵敏度、响应时间和使用寿命等。当前国内外对酶的固定技术进行了广泛的研究,并取得了许多重要进展[5]。
酶的固定化技术指的是通过某些方式使酶和载体结合,使酶被集中或限制,使之在一定空间范围内进行催化反应。目前酶的固定方法主要有吸附法[6]、共价键结合法[7]、凝胶/溶胶[8]、交联法[9]及自组装法[10]等方法。
基于带相反电荷胶体微粒的层层 (lay-bylay)自组装法,由于其具有成膜的有序性,可在分子水平上控制膜的厚度等优点,引起人们广泛的关注。层层自组装法是生物传感器研究中一个很重要的生物分子固定化技术,利用该方法酶分子和媒介体可共同固定到电极表面,易于消除干扰,而且生物传感信号可以放大,酶分子仍然具有其活性[5]。
碳纳米管被发现以来,由于其具有很好的电化学和化学稳定性、良好的导电性、大的比表面积和优良的电催化性能,能促进电活性物质的电子传递等优点。碳纳米管还可作为固定酶的载体材料,使人们对碳纳米管在电化学中的应用产生了极大的兴趣[11~14]。但采用共价键合法或交联法用碳纳米管作为固定酶的载体材料时,需要对碳纳米管要用强酸(硫酸和硝酸)进行预处理,并且其与酶交联时间久。在对碳纳米管进行强酸氧化过程中,也许会使碳纳米管的结构、长短、或者电子特性发生难以预料的改变,而且碳纳米管难溶于许多溶剂中也给碳纳米管-酶传感器的发展带来困扰[15]。
该文描述了一种新的方法来制备酶传感器。将碳纳米管溶解在表面活性剂中,使其表面带有正/负电荷。根据酶的等电点,改变溶液的pH值来使酶带有相反的电荷,再通过自组装法,制备出新的酶传感器。这种方法简单,不需对碳纳米管进行酸化。而且酶的活性稳定,为制备检测农药残留的生物传感器提供了一种新的方法。
1 实验部分
1.1 主要仪器
CHI 600电化学工作站 (上海辰华仪器有限公司),采用三电极系统,铂丝电极作辅助电极,饱和甘汞(SCE)电极为参比电极,铜电极为工作电极;pH计(6219型,上海任氏电子有限公司)。每次测试前试液均通氮气除氧10 min,实验中保持氮气氛围。所有电化学实验均在室温(25℃)下进行。
1.2 试剂及溶液
碳纳米管:(MWNTs,φ < 10 nm;长度 0.5~500 μm; 纯度 >95%,比表面积约为 300 m2/g,深圳市纳米港有限公司)。
葡萄糖氧化酶(GOD,上海生工):10 mg/mL;磷酸缓冲溶液(PBS):用 0.1 mol/L Na2HPO4和 0.1 mol/L NaH2PO4配制。十六烷基溴化钠(CTAB,0.85 mg/mL)所有的化学试剂均为分析纯。实验用水为二次蒸馏水。
1.3 酶-碳纳米管-表面活性剂修饰玻碳电极的制备
先将玻碳电极(GC,直径为4 mm)分别用6号砂纸、0.3 μm、0.1μm 和 0.05 μm Al2O3抛光粉抛光至镜面,然后分别在无水乙醇和二次蒸馏水中超声清洗各3 min。再分别用2 mol/L NaOH,1∶1 HNO3无水乙醇和水超声清洗。
GOD-MWNTs-CTAB-GC修饰电极的制备:将30 mg/mL的碳纳米管分散在30mL的CTAB(1.0%)水溶液中,超声分散 5 min,制备成黑色的碳纳米管悬浊液(1 mg/mL),以4 000 r/min离心30 min,去除少量的比较长的碳纳米管,得到上层CTAB-MWNTs溶液。 移取 10 μL的 CTABMWNTs溶液滴加在干净的GC电极表面,室温下挥发至干。再将CTAB-MWNTs-GC浸泡在GOD(10 mg/mL 的 pH7.0 PBS)中 2.5 h,取出,用二次水彻底冲洗干净,保存在4℃下,pH7.0 PBS溶液中。
2 结果与讨论
2.1 酶-MWNTs-表面活性剂-GC电极的电化学性质
将MWNTs溶解于CTAB水溶液中,制备MWNTs-CTAB-GC电极,使MWNTs表面带有正电荷,而 GOD 等电点是 4.2,在 pH7.0 PBS 中荷负电,再利用LBL的方法制备GOD-MWNTs-CTAB-GC修饰电极。
图1为不同修饰电极在pH7.0的PBS中的循环伏安曲线。曲线b是MWNTs-CTAB-GC电极,在-0.36 V处有一对很小的肩峰;曲线a是GOD-MWNTs-CTAB-GC电极在相同的扫描电位下,-0.36 V处的肩峰依然存在,说明此峰是CTAB所产生的,另外还出现了一对明显的氧化还原峰,Epa=-0.434 V,Epc=-0.487 V,ΔEp=53 mV,说明此峰是GOD在电极表面发生直接电化学所产生的。
2.2 GOD-MWNTs-CTAB-GC电极扫速与峰电流的关系
图2是GOD-MWNTs-CTAB-GC修饰电极的循环伏安曲线与扫速的关系,随着扫描速度的增加,峰电位差保持一个常数,约56 mV,阳极峰电流和阴极峰电流与扫描速度呈线性关系,说明电极是受电化学反应控制的。
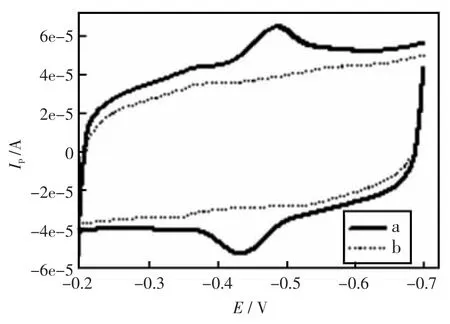
图1 GOD-MWNTs-CTAB-GC(a),MWNTs-CTAB-GC(b),在0.1 mol/L PBS(pH7.0)中的循环伏安曲线扫速:100 mV/sFig.1 Cycle voltammograms of different modified electrodes in 0.1mol/L PBS(pH7.0)GOD-MWNTs-CTAB-GC(a),MWNTs-CTAB-GC(b),Scan rates:100 mV/s
2.3 pH的选择
实验比较了GOD-MWNTs-CTAB-GC电极在各种不同pH值的0.1 mol/L PBS缓冲溶液中的电化学响应(图3)。实验发现修饰电极的氧化还原峰电位随着pH的增大而负移,峰电流随着pH的增大先增大后减小,在pH7.0的PBS中峰电流较高,氧化还原峰形较好,故实验选择pH7.0的PBS溶液。
2.4 MWNTs用量的选择
实验考查了GOD-MWNTs-CTAB-GC修饰电极的响应电流与MWNTs用量的关系 (图4)。响应电流随着MWNTs用量的增大而增大,当用量超过10 μL时响应电流达到了一个平台,可能是在不断增加MWNTs用量的过程中,电极上的活性位点也增加,从而导致响应电流也增高;但当MWNTs浓度再增大时,电极表面上的MWNTs膜达到了饱和,所以响应电流不再增加,所以实验中选择10 μL的MWNTs-CTAB溶液。
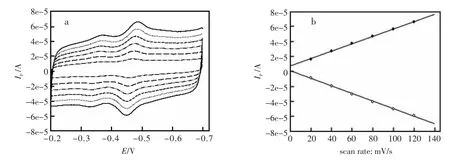
图2 (a)GOD-MWNTs-CTAB-GC修饰电极在0.1 mol/L PBS(pH7.0)中的循环伏安曲线;(b)氧化峰电流与还原峰电流与扫描速度的关系。 扫速:20,60,80,100,120 mV/sFig.2 (a)Cycle voltammogram of different scan rate in 0.1 mol/L PBS(pH7.0);(b)Relation of oxidation and reduction current peaks and scaning rate Scan rate:20,60,80,100,120 mV/s
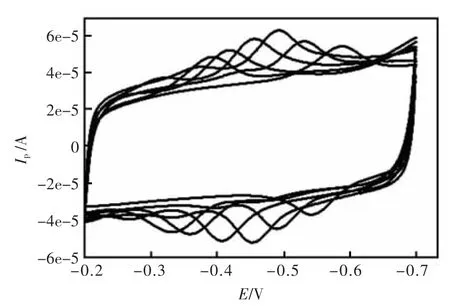
图3 GOD-MWNTs-CTAB-GC 在 pH=4.5,5.0,6.0,7.0,8.0,9.3 PBS中的循环伏安曲线Fig.3 Cycle voltammogram of different at GOD-MWNTs-CTAB-GC electrode
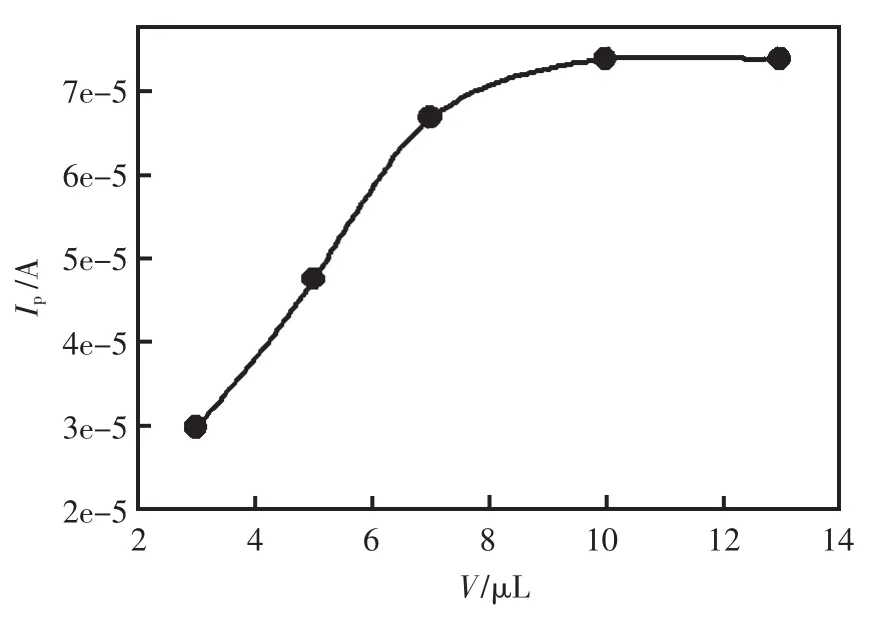
图4 MWNTs用量的影响Fig.4 Effect of concentration of MWNTs
2.5 浸泡时间的选择
实验考察了MWNTs-CTAB-GC分别浸泡在GOD 中 0.5 h、 1.0 h、2.0 h、2.5 h 和 3.0 h 时电极的循环伏安曲线,结果见图5。刚开始响应电流随着浸泡在GOD中时间的增长而明显增大,当浸泡时间为2.5 h时,响应电流不再增大,故实验中选择浸泡时间为2.5 h。
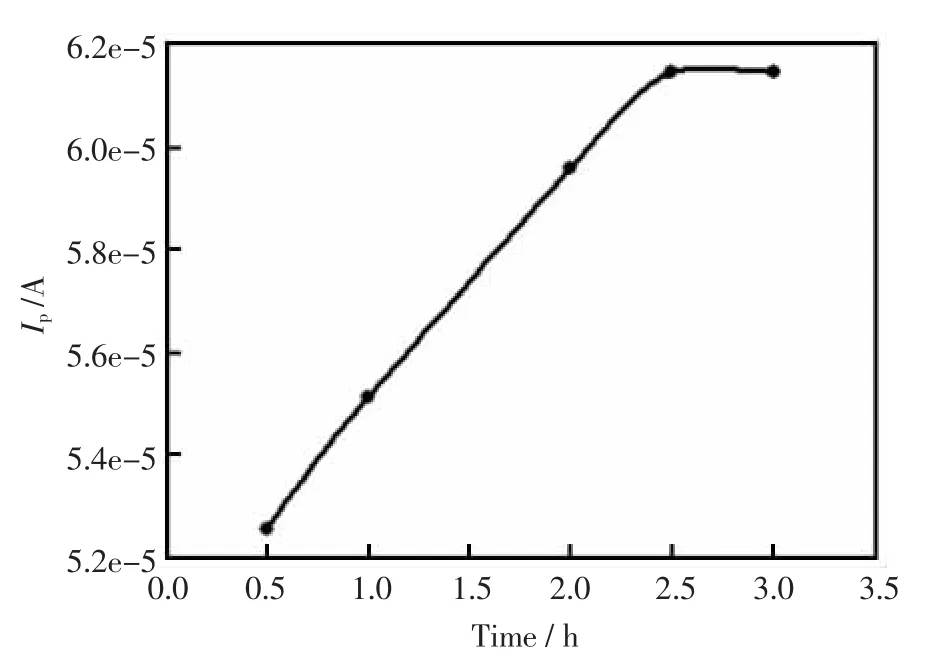
图5 浸泡时间的影响Fig.5 Effect of soaking time
2.6 计时安培法检测H2O2
在优化实验条件下,用GOD-MWNTs-CTAB-GC修饰电极,以安培法来检测H2O2,结果见图6。 H2O2浓度在 1.0×10-6~5.4×10-5mol/L 内与响应电流呈线性关系,最低检测限为5.3×10-7mol/L(3 倍信噪比)。
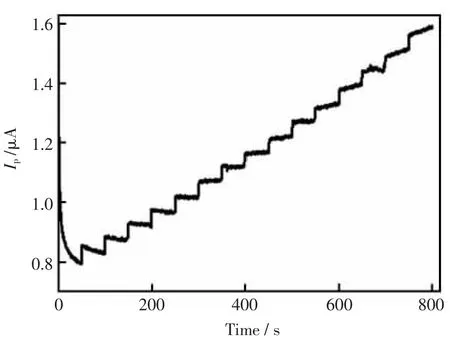
图6 GOD-MWNTs-CTAB-GC修饰电极检测H2O2的安培响应Fig.6 Determination of H2O2by GOD-MWNTs-CTABGC electrode
2.7 回收率的测定
在一定浓度医用消毒水中,以上述电极方法进行H2O2含量测定。逐次加入2 μL 0.005 mol/L H2O2标准溶液,测定其回收率,结果列入表1。测定的回收率在95%~104%之间。

表1 样品的检测(n=5)Tab.1 The determination results of samples(n=5)
3 结论
该文基于目前酶传感器制备技术基础上,研究了一种新的酶固定方法。实验证明,该方法不需对碳纳米管进行酸化、操作简单、步骤少、酶固定后电极的稳定性高并提高了检测的响应电流,为制备检测农药残留的生物传感器提供了一种新的方法。
[1]罗启枚,王辉宪,刘登友,等.农药残留检测生物传感器酶固定技术研究进展[J].化学传感器,2007,27(3):17~22.
[2]李颖娇,张荣全,叶非.生物传感器在农药残留分析中的应用[J].农药科学与管理,2003,24(8):11~13.
[3]袁永海,李建平.电化学生物传感器在农药检测中的应用[J].分析测试学报,2006,25(5):121~127.
[4]焦奎,张书圣.酶联免疫分析技术及应用[M].化学工业出版社,2004,200~203.
[5]董绍俊,车广礼,谢远武.化学修饰电极[M].科学出版社,2003,503~509.
[6]阳明辉,李春香,杨云慧,等.基于静电吸附多层膜固定酶的过氧化氢生物传感器的研究 [J].化学学报,2004,62(5):502~507.
[7]王富科.α-2淀粉酶固定化的研究[J].安徽农业科学,2008,36(21):8 872~8 873.
[8]黄超伦,修荣,董秋香,等.凝胶醌氢醌PVC涂膜曲马多选择电极的研制[J].分析测试学报,2005,24(4):35~38.
[9]张璐,张耀东,漆红兰.多壁碳纳米管修饰酶电极测定马拉硫磷[J].电化学,2007,13(4):431~435.
[10]温金凤,朱爱花,崔胜云.亚硒酸钠在L-2半胱氨酸自组装类生物膜修饰电极上的电化学行为[J].2009,37(12):1 771~1 775.
[11]Liu G D,Lin Y H.Biosensor based on self-assembling acetylcholinesterase on carbon nanotubes for flow injection/amperometric detection of organophosphate pesticides and nerve agents[J].Anal.Chem,2006,78:835 ~843.
[12]Liu G D,Riechers S L,Mellen M C,et al.Sensitive electrochemical detection of enzymatically generated thiocholine atcarbon nanotube modified glassy carbon electrode[J].Electrochemistry Communications,2005,7:1 163~1 169.
[13]Cai C X,Chen J.Direct electron transfer of glucose oxidase promoted by carbon nanotube[J].Electrochemistry,2004,10:159~167.
[14]Davis J J,Coles R J,Hil H A O.Protein electrochemistry at carbon nanotube electrodes[J].J.Electroanal.Chem.,1997,440(1-2);279~282.
[15]Yan X B,Chen X J,Tay B K,et al.Transparent and flexible glucose biosensor via layer-by-layer assembly of multi-wall carbon nanotubes and glucose oxidase[J].Electrochemistry Communications,2007,9:1 269~1 275.

