纳米材料在适体传感器中的应用研究进展
徐 凤,常艳兵,张银烽,陶满兰,杨云慧
(云南师范大学化学化工学院,云南昆明650092)
0 引言
纳米材料是指材料的基本单元大小限制在1~100 nm范围的材料。由于其尺寸小而具有的量子效应、表面效应和宏观量子隧道效应等特性,因此纳米材料在催化、磁介质、生物医药和生物电分析领域等方面有着广阔的应用前景[1]。经过近几十年的研究,已经制备出了各种形貌的纳米材料,比如纳米颗粒[2]、纳米管[3]、纳米线[4]、纳米棒[5]、纳米带[6~7]等。
适体是由25~80个碱基组成的能与蛋白质、多肽、金属离子、小分子等特异性结合的寡核苷酸DNA或RNA链。自从1990年Gold[8]和Ellington[9]等实验室各自独立地建立自己的核苷酸文库并创立一种从超过1015个核苷酸分子文库里筛选出能与配体专一、高效结合的DNA或RNA片段的指数级富集的配基系统进化技术(SELEX)以后,适体的合成与研究引起了越来越多的科研工作者的关注。适体的出现弥补了传统免疫反应的不足,也为传统免疫传感器注入了新的活力。
由于纳米材料在比表面和结构上的重要特性,其研究和开发在近年来得到迅速发展,特别在适体生物传感器的研制方面有广泛的应用。纳米材料在适体传感器中的应用主要有两方面:①将纳米材料修饰到电极表面用于适体分子的固定;②纳米材料作为标记物用于检测。该文将从这两方面来综述纳米材料最近几年在适体传感器中的应用。
1 纳米材料在适体传感器中的应用及研究进展
1.1 纳米材料作为固定材料修饰电极表面
由于纳米材料具有比表面积大,电化学窗口宽,电子传递能力高而广泛应用于电极修饰。将纳米材料修饰到适体传感器的表面主要有两个方面的作用:提高适体分子的固定量和增大电化学信号。
1.1.1 利用金纳米颗粒固定适体
随着生物化学合成技术的发展,目前可以通过商业途径购买到按要求修饰的合成寡核苷酸,修饰方式主要是在适体DNA的末端连接含硫化合物,再通过这一基团将适体固定在纳米金颗粒表面。Chen[10]等研制了一种使用表面增强的拉曼散射光谱来检测腺苷的适体传感器。先将金包被的银溶胶固定到金片表面,然后将一段标记了巯基的捕获探针修饰到传感器表面,再将抗腺苷的适体与标记有四甲基罗丹明的DNA的混合物修饰到传感器上,最后将腺苷滴到传感器上,由于腺苷与腺苷适体的特异性结合导致传感器上标记四甲基罗丹明的DNA释放到拉曼散射的培养基上,这样就产生了拉曼散射增强的信号,实现了对腺苷的检测。该传感器的检测线性范围是2.0×10-8~2.0×10-6mol/L, 检测下限为 1.0×10-8mol/L。
Kang等[11]还采用纳米金和壳聚糖的混合物修饰电极表面来改善电极的导电性,开发了一种抗体作为捕获探针,适体作为检测探针,亚甲基蓝作为电活性物质的凝血酶电化学适体传感器(结构如图1)。该传感器的检测下限为0.5 nmol/L,检测线性范围为1~60 nmol/L。
Li等[12]将固定到玻碳电极上的金纳米颗粒作为固定带巯基的适体的一个平台,采用[Fe(CN)6]3-/4-作为检测探针来检测传感器界面电子的转移量。凝血酶的量与电极表面电子转移量在凝血酶浓度为0.12~30 nmol/L成线性关系。该小组考察了三种不同的适体与凝血酶之间的结合与分解速率,并证实了将金纳米颗粒沉积到玻碳电极作为固定适体的平台可以提高传感器的检测灵敏度。Feng等[13]设计了一种检测腺苷的非标记型适体传感器,采用1,6-硫醇将金纳米颗粒固定到金电极表面,固定的金纳米颗粒能提高电极表面俘获探针的量,采用亚甲基蓝作为检测探针来检测腺苷的量。该传感器检测范围宽,灵敏度高,传感器使用超过十次后信号仍能保持到原有信号的90%。Zhao等[14]设计了一种新型的检测茶碱的RNA适体传感器。该小组首先通过电沉积使玻碳电极表面生成金纳米颗粒,然后探针RNA通过巯基组装到金纳米颗粒上。该小组用阿霉素作为电化学检测探针,通过阿霉素在电极表面的氧化还原情况检测茶碱的浓度,线性范围为2.0~50.0 μmol/L,检测下限为 1.2 μmol/L。Suprun[15]等利用生物素亲和素技术将适体固定到已用金纳米颗粒修饰的丝网印刷电极上面,用溶出伏安法在一定电位下将金纳米颗粒氧化为金的氧化物,通过检测金的氧化物的量来测定电极上凝血酶的含量。该方法的检测下限达10-9mol/L,线性范围为 10-8~10-5mol/L(溶液中),2×10-14~2×10-11mol/L(电极上)。
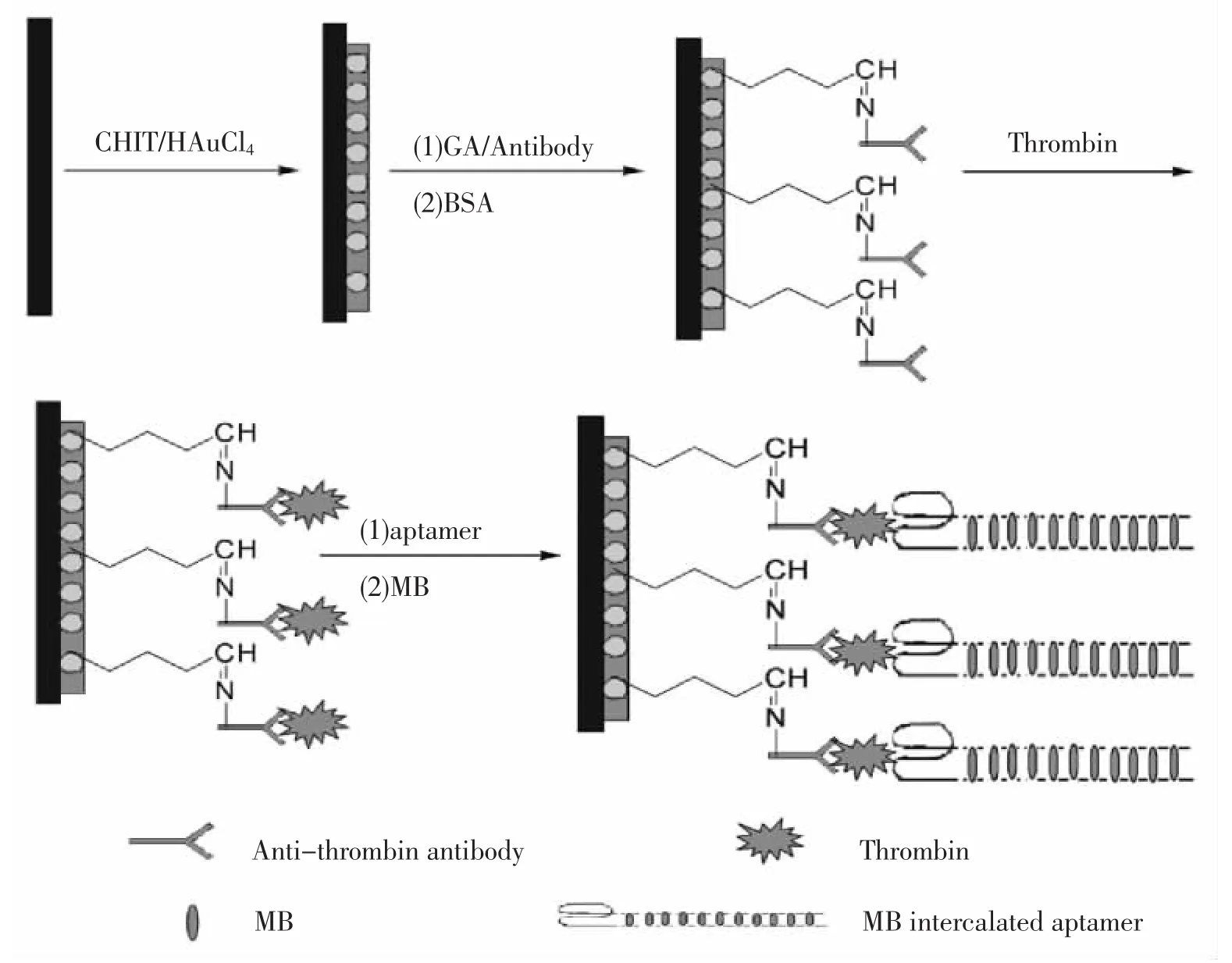
图1 传感器制备流程图[11]Fig.1 Schematic representations of the principle for the sensing steps[11]
1.1.2 利用磁性纳米颗粒固定适体
Kawde[16]等首次证实了核酸适体可以用于电化学检测蛋白质。该小组首先将生物素标记的抗溶菌酶适体结合到链霉亲和素化的纳米磁珠上,然后再加靶蛋白溶菌酶,由于溶菌酶适体和溶菌酶的特异性结合导致纳米磁珠上溶菌酶适体的解离,用磁性分离从磁珠上解离的溶菌酶适体,最后通过计时电位溶出法检测溶菌酶适体的量来测定溶菌酶的浓度,该方法对溶菌酶的检测下限为7 nmol/L。
1.1.3 利用碳纳米管固定适体
杨佳等[17]用碳纳米管负载钌联吡啶衍生物标记的凝血酶适体Ⅱ,根据钌联吡啶衍生物的电化学发光信号强度的改变采用夹心法检测凝血酶的浓度,该方法的检出限为1.3×10-12mol/L。且在对凝血酶浓度为1.0×10-10mol/L的情况下进行平行测定,其相对标准偏差为5.0%。李延[18]用单壁碳纳米管负载凝血酶的第二段适体和钌联吡啶的复合物构成电化学发光检测探针检测凝血酶, 该传感器检测的线性范围为 1.0×10-14~1.0×10-11mol/L,检测下限为 3.0×10-15mol/L,且在凝血酶的浓度为5.0×10-13mol/L的情况下进行11次平行测定的相对标准偏差为5.3%。
1.2 纳米材料作为标记物进行检测
1.2.1 以金纳米颗粒为标记物
Wang等[19]设计了一种电化学发光适体传感器来检测腺苷的浓度。该组将金纳米颗粒与电化学发光物质钌联吡啶形成的络合物标记作为传感器的发光平台,将二茂铁标记的腺苷适体作为发光强度控制开关,通过传感器的发光强度来检测腺苷的浓度。郑静等[20]将凝血酶的第二段适体用金胶标记后作为检测信标,采用夹心法通过检测信标金胶上的核苷酸链与另一段标记有金胶的互补链进一步杂交而实现金的选择性富集,金的富集可实现信号扩增而大大提高了传感器的灵敏度。该传感器的结构示意图见图2,此方法对凝血酶的检测下限达4.52×10-15mol/L,且在对凝血酶浓度为7.47×10-14mol/L的情况下平行测定8次,其相对标准偏差为3.0%。

图2 凝血酶适体生物传感器示意图[20]Fig.2 Schematic illustration of the thrombin aptasensor[20](A)Fabrication of the sandwich format bymagnetic nanoparticle labeled aptamerⅠ,thrombin and gold nanoparticle labeled aptamerⅡ;(B)enrichment of gold nanoparticles through the hybridization with the complementary oligonucleotide
Wang等[21]利用凝血酶为模型设计了一种利用金纳米颗粒和适体组合的适体传感器,原理是将用染料标记的DNA和标记有金纳米颗粒的适体杂交,利用金纳米颗粒的荧光淬灭程度实现凝血酶的检测,该组设计了三种模型并认为通过自组装将适体和金纳米颗粒固定到电极上是最好的模型。Wang等[22]将纳米颗粒和适体相结合采用表面等离子共振的方法灵敏的检测了人类免疫球蛋白E(IgE)。该传感器利用了金纳米颗粒对检测信号的放大作用,检测下限为1 ng/mL。Zheng等[23]同时利用了磁性纳米颗粒和金纳米颗粒开发了一种快速高效灵敏检测凝血酶的适体传感器。该文用磁性纳米颗粒固定适体,用金纳米颗粒标记互补核苷酸链,将适体与互补核苷酸的杂交体系作为探针,由于凝血酶的引入,导致探针结构破坏,标记金纳米颗粒的互补核苷酸被释放出来,再将游离出来的金纳米颗粒氧化为AuCl4-,最后用差分脉冲法检测AuCl4-的信号来检测凝血酶的浓度。该方法的优越性在于能简单快速而灵敏的检测凝血酶并由于不需要标记凝血酶而可以用于复杂体系真实样品的检测。
1.2.2 以量子点为标记物
Yang等[24]利用CdSe量子点标记凝血酶第二段适体,采用夹心法依次将凝血酶的第一段适体、凝血酶、标记量子点的第二段适体固定到金电极表面,然后通过在硝酸溶液中用方波溶出伏安法来检测Cd2+的浓度来测定凝血酶的浓度,且该传感器在凝血酶浓度为1 pmol/L时平行测定相对标准偏差为9.3%。 Huang[25]等设计了一种采用量子点电化学发光检测凝血酶的适体传感器。首先将巯基标记的凝血酶第一段适体固定到金电极上,然后将目标物凝血酶结合到适体1上,接着向电极上滴加用生物素标记的凝血酶适体2,这样电极上就形成了适体1/凝血酶/适体2的夹心结构。最后将链霉亲和素标记的量子点被加到电极上与适体2形成生物素-亲和素体系,量子点的发光强弱反应了电极上凝血酶的浓度,该传感器检测的线性范围为0~20 μg/mL,且该传感器选择性好,性能稳定。
2 展望
纳米材料是一种性能优异的功能材料,应用开发的前景十分广阔。将纳米材料应用于适体传感器为适体传感器的发展提供了巨大的空间。与传统的传感器相比,基于纳米材料的适体传感器具有超高的灵敏度和良好的选择性,且可实现高通量的实时检测分析。但是由于一些纳米材料合成困难以及适体的筛选耗时,筛选过程复杂等不利因素制约了基于纳米材料的适体传感器的发展。随着纳米技术和传感器技术的发展,如何将纳米科学和适体传感器有机的结合,如何利用纳米材料的特殊性能来提高适体传感器的检测灵敏度和检测通量是科研工作者努力的方向和研究的热点,也是适体传感器发展的新方向之一。
[1]Kerner E H.Dynamical Feynman's Theorem[J].Phys.Rev.Lett.,1959,2(4):152~153.
[2]Nelson E J,Samulski E T.Preparation of CdS nanoparticles within an ordered polypeptide matrix [J].Mater.Sci.Eng.C,1995,2(3):133~140.
[3]Iijima S.Helical microtubules of graphitic carbon[J].Nature,1990,347(11):56~58.
[4]Liu J,Lin Y H,Liang L,et al.Templateless assembly of molecularly aligned conductive polymer nanowires:a new approach for oriented nanostructures[J].Chem.Euro.J.,2003,9(3):605~611.
[5]Könekamp R,Word R C,Dosmailov M,et al.Pentagonal ZnO nanorods[J].Phys.Status Solidi(RRL),2007,1(3):101~103.
[6]Pan Z W,Dai Z R,Wang Z L.Nanobelts of semiconducting oxides[J].Science,2001,291(5 510):1 947~1 949.
[7]Xu L,Su Y,Cai D,et al.Synthesis and photoluminescence properties of CdS nanobelts [J].Mater.Lett.,2006,60(11):1 420~1 424.
[8]Tuerk C,Gold L.Systematic evolution of ligands by exponential enrichment:RNA ligands to bacteriophage T4 DNA polymerase[J].Science,1990,249(4 968):505~510.
[9]Ellington A D,Szostak J W.In vitro selection of RNA molecules that bind specific ligands[J].Nature,1990,346(6 287):818~822.
[10]Chen J W,Liu X P,Feng K J,et al.Detection of adenosine using surface-enhanced Raman scattering based onstructure-switching signaling aptamer[J].Biosens.Bioelectron.,2008,24(1):66~71.
[11]Kang Y,Feng K J,Chen J W,et al.Electrochemical detection of thrombin by sandwich approach using antibody and aptamer[J].Bioelectrochem.,2008,73(1):76~81.
[12]Li X X,Shen L H,Zhang D D,et al.Electrochemical impedance spectroscopy for study of aptamer-thrombin interfacial interactions[J].Biosens.Bioelectron.,2008,23(11):1 624~1 630.
[13]Feng K J,Sun C H,Kang Y,et al.Label-free electrochemical detection of nanomolar adenosine based on target-induced aptamer displacement [J].Electrochem.Commun.,2008,10(4):531~535.
[14]Zhao G C,Yang X.A label-free electrochemical RNA aptamer for selective detection of theophylline[J].Electrochem.Commun.,2010,12(2):300~302.
[15]Suprun E,Shumyantseva V,Bulko T,et al.Au-nanoparticles as an electrochemical sensing platform for aptamer-thrombin interaction [J].Biosens.Bioelectron.,2008,24(4):825~830.
[16]Kawde A N,Rodriguez M C,Lee T M H,et al.,Labelfree bioelectronic detection of aptamer-protein interactions[J].Electrochem.Commun.,2005,7(5):537~540.
[17]杨佳.基于适体均相电化学发光法检测凝血酶的研究[D].陕西:陕西师范大学,2008.
[18]李延.电化学发光DNA和适体生物传感器的研究[D].陕西:陕西师范大学,2008.
[19]Wang X Y,Dong P,He P G,et al.A solid-state electrochemiluminescence sensing platform for detection of adenosine based on ferrocene-labeled structure-switching signaling aptamer[J].Anal.Chim.Acta.,2010,658(2):128~132.
[20]郑静,冯婉娟,黄翠华,等.利用互补核酸杂交富集金胶实现信号扩增的电化学凝血酶蛋白生物传感器研究[J].高等学校化学学报,2007,28(12):2 274~2 279.
[21]Wang W J,Chen C L,Qian M X,et al.Aptamer biosensor for protein detection using gold nanoparticles[J].Anal.Biochem.,2008,373(2):213~219.
[22]Wang J L,Munir A,Li Z H,et al.Aptamer-Au NPs conjugates-enhanced SPR sensing for the ultrasensitive sandwich immunoassay[J].Biosens.Bioelectron.,2009,25(1):124~129.
[23]Zheng J,Cheng G F,He P G,et al.An aptamer-based assay for thrombin via structure switch based on gold nanoparticles and magnetic nanoparticles[J].Talanta,2010,80(5):1 868~1 872.
[24]Yang H,Ji J,Liu Y,et al.An aptamer-based biosensor for sensitive thrombin detection[J].Electrochem.Commun.,2009,11(1):38~40.
[25]Huang H P,Zhu J J.DNA aptamer-based QDs electrochemiluminescence biosensor for the detection of thrombin[J].Biosens.Bioelectron.,2009,25(4):927~930.

