液晶材料在化学与生物传感器中的应用
周瑾艳,谭 慧,杨胜园,吴朝阳
(湖南大学化学化工学院,化学生物传感与化学计量学国家重点实验室,湖南长沙410082)
0 引言
今天,液晶显示器无处不在。手表、计算器、计量器、电脑、电视等的显示器件中都有它的身影。从被偶尔发现到普及应用于电子工业,仅仅数载时光。70年代,集成电路的出现极大地推动了液晶在显示器件中的高速发展。同时,液晶液被成功应用到温度传感器、水流计、压力分布计等计量仪表中。作为特殊的“敏感元件”,液晶分子近年来也被引入传感器领域,尤其是生命科学研究中,用于构建液晶生物传感器,初露锋芒。
1 液晶分子概述
1.1 液晶分子的发现
1888年,奥地利科学家Friedrich Reinitzer(1857-1927)在研究中不经意发现了一种奇怪的有机化合物[1],它有两个熔点。把它的固态晶体加热到145℃时,便熔成带有彩色的液体,只不过是浑浊的,而一切纯净物质熔化时却是透明的。如果继续加热到175℃时,它似乎再次熔化,色彩消失,变成清澈透明的液体。1920年,德国物理学家 O.Lehmann(1855-1922)把处于“中间地带”的浑浊液体叫做液晶 (Liquid Crystal,简称LC)[2]。它好比是既不象马,又不象驴的骡子,所以有人称它为有机界的骡子。液晶自被发现后,人们并不知道它有何用途,直到1968年,人们才把它作为电子工业上的材料。
1.2 液晶分子的分类
液晶分子依其排列方式主要分为三种:向列型(nematic)、层列型(smectic)、胆固醇型(cholesteric),如图1。
向列型:液晶分子长轴方向有序,方向有序的距离约数千埃。
层列型:液晶分子除了方向一致性外,还具有层状结构,层与层之间可以相互移动。
胆固醇型:液晶分子不具层状结构,液晶分子方向沿螺旋轴形成连续扭转的方向变化并与螺旋轴垂直。
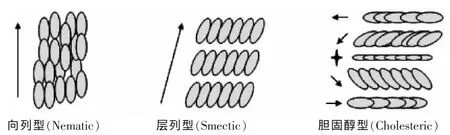
图1 三种液晶分子排列示意图Fig.1 Schematic arrangement of liquid crystal
除了依分子排列方式分类外,根据生成方法的不同,液晶分子也可以分为:热致型液晶(thermotropic)、溶致型液晶(lyotropic)。
热致型:热致型液晶主要根据温度的变化产生不同的液晶相。当温度从低温上升时,固态晶格结构消失而形成分子有序的排列,如图2。
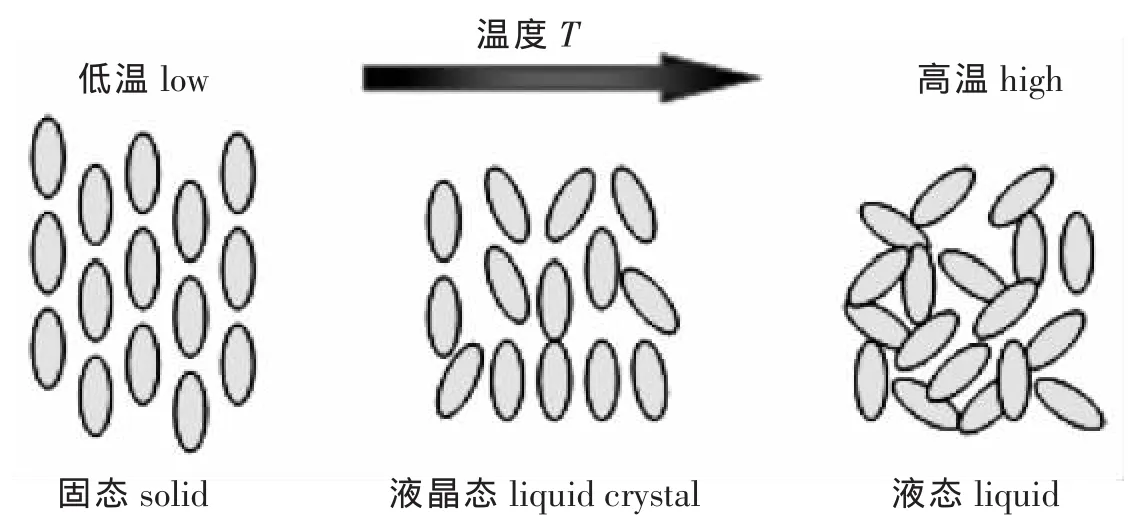
图2 热致型液晶随温度排列示意图Fig.2 Schematic arrangement of thermotropic liquid crystal with the temperature
溶致型:溶致型液晶存在于溶液体系中,当溶质与溶剂在适当的比例时,双亲性溶质在溶剂中形成特殊的排列结构而产生液晶相,通过改变溶液的浓度以产生不同的液晶相结构。例如十二烷基硫酸钠族的磺酸盐等的肥皂水溶液均具有液晶性,当肥皂水溶液浓度高时,则会出现多种双折射性的中间相,可粗分浓度低时出现Middle相(又称Hexagonal相),及浓度高时的Lamella相(又称 Neat相),如图3。
1.3 液晶分子特性
液晶分子是介于液态和晶态之间一种高分子有序材料,有不完全的取向长程有序和位置有序,既有液体一样的流动性,也有类似晶体的各向异性。其主要特性就是光学各向异性,或称双折射性(birefringence),即:自然光通过偏振片变成线性偏振光,当线性偏振光通过各向异性的液晶后,发生双折射分解为寻常光(O-ray)和异常光(E-ray),寻常光的偏振方向垂直其前进方向和光轴构成的平面并与波阵方向平行,异常光的偏振方向平行于前进方向和光轴构成的平面并与波阵方向平行(图4)。
液晶分子的折射率为ne和no,ne定义为偏振方向与液晶光轴方向相平行时所测得的折射率;

图3 肥皂水溶液形成的溶致型液晶分子排列示意图Fig.3 The arrangement diagram of lyotropic liquid crystal formed soap solution

图4 入射光进入双折射晶体中发生偏光示意图Fig.4 Incident was polarized into the birefringent crystal
no定义为偏振方向与液晶光轴方向相垂直时所测得的折射率,一般定义液晶折射率异向性Δn=ne-no。若ne>no,则Δn>0,此时将液晶称为正型液晶;若ne<no,则Δn<0,此时将液晶称为负型液晶(如图5)。
若光是斜向入射,则其折射率(neff)符合下列公式:

其中,θ为入射光与液晶光轴的夹角,因而,不同方向的入射光,对双折射的液晶介质,就会有不同的折射率,相对来说也会有不同的相位延迟(Δφ):

通过不同的相位延迟参数改变达到入射光偏振状态,在检偏片调节下可使入射光穿过或不穿过检偏片形成亮态或暗态。
1.4 液晶配向的方法
液晶生物传感器原理主要是基于上述液晶分子的特性,通过处理基底诱导液晶发生向列变化,调变偏光图像亮暗强度。因此,内部液晶分子的排列结构,直接影响传感器的性能,而要控制液晶分子排列的好坏,则取决于液晶配向技术[3]。液晶配向主要是利用基板表面的配向处理,形成薄膜的配向层,并借由液晶分子间的范德华力、偶极间引力、氢键等相互作用力[4],使得液晶分子呈现有秩序的排列。

图5 液晶的双折射率异向性图Fig.5 The birefringence of liquid crystal anisotropy
液晶生物传感器的研究中,使得液晶分子排列整齐的配向方法主要有两种[5~6]:物理方法:即摩擦配向法 (也是构建液晶显示器件的主要方法)和化学法。
1.摩擦法(rubbing)是传统的液晶配向方法。原先平滑的表面经摩擦后产生定向的沟槽或刮痕,液晶分子在沟槽诱导下按一定方向排列,而达到配向效果,液晶长轴排列方向平行于摩擦方向[7~8]。这种方法操作简单,技术成熟,使用范围广,可连续生产。但这种传统的摩擦法也存在如静电干扰、摩擦绒布掉毛、灰粒吸附等不足,这些都将严重影响配向效果。
早在1995年,Kim等[9]利用扫描原子力显微镜(SFM)研究了摩擦配向过程。研究发现,随着摩擦强度(rubbing strength,RS)的增强,所获得的沟槽越深(如图6)。同年,Huang[10]也研究发现了通过摩擦烷基链的聚酰亚胺膜能有效诱导液晶分子整齐排列。随后,Abbott小组[11]用机械摩擦法使BSA组装膜诱导液晶分子排列,而构建良好的BSA液晶传感器。在此基础上,该小组[12]又研制出IgG液晶传感器,液晶分子在摩擦后的BSA膜上成有序排列,通过交联剂作用,交联上IgG后,打乱了液晶的有序性,而达到检测IgG的效果。此小组的一系列研究成果开启了液晶生物传感技术的新篇章。

图6 不同摩擦强度下摩擦基底的SFM图像[9]Fig.6 A sequence of SFM images showing the effect of increasing rubbing strength(RS)[9]
2.化学法配向制程主要原理在于通过在基底表面构筑有序的纳米沟槽结构,液晶分子在这些纳米结构上有序的排列。文献报道的基底修饰方法有:喷金法[13~14],DNA 杂交法[15~16],分子印迹法[17~18],分子组装法[19~24](单分子组装、混合分子组装)等。
喷金法:通过在干净玻片基底上有角度地喷射一层金(如图7),金膜在基底上成波浪状分布,峰高大小分布在2~100 nm范围内。液晶分子在这种特殊表面呈有序分布。通过自组装将生物分子固定在这种起伏的表面,生物分子有效填埋起伏的金膜,而使液晶出现偏光现象,达到检测生物分子的目的。
DNA杂交法:这种修饰方法主要借助DNA杂交前后的组装密度的变化。单链DNA(ss-DNA)修饰的基底表面,组装密度小,液晶分子(15~20 Å)在与 ss-DNA(68Å)空间相互作用下,整齐排列。这时,ss-DNA充当着液晶垂直配向膜(如图8a)。然而,当DNA杂交后,分子组装密度增大,DNA分子自由空间减小,渗透到其间的液晶也减少,这就实现了液晶从垂直到平行排列的转化(图8b)。
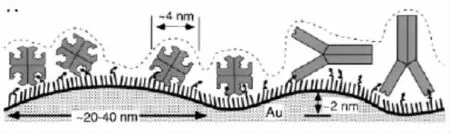
图7 波浪状金膜上组装生物分子诱导液晶排列[13]Fig.7 Schematic illustration of the change in surface roughness caused by the binding of biomolecules to ligands hosted within a SAM of molecules supported on a gold film[13]

图8 DNA杂交对液晶取向排列的影响[15]Fig.8 The effect of DNA hybridization to liquid crystal orientation[15]
分子印迹法:分子印迹法是基于模板分子(印迹分子)与聚合物单体接触时形成多重作用点,通过聚合过程这种作用就会被记忆下来,当模板分子除去后,聚合物中就形成了与模板分子空间构型相匹配的具有多重作用点的空穴,这样的空穴将对模板分子及其类似物具有选择识别特性[17]。Abbott小组[18]借用这种原理,在基底表面印迹免疫结合物,使表面成间隔空腔结构。如图9所示,在凹槽型模板上固定生物素标记的BSA,再与抗-BSA的IgG免疫结合后,印迹到金表面,基底表面形成凹槽结构,液晶在这层印迹膜上定向排列。

图9 分子印迹-液晶传感器原理[18]Fig.9 The principle of Molecular Imprinting-Liquid Crystal Sensors[18]
分子组装法:通过对基底组装本身对液晶有诱导效应的有机分子,以达到配向效果。这些分子有些单独使用即可达到配向作用,如DMOAP(N,N-二甲基-N-十八烷基-3-氨丙基三甲基硅烷)[19~22];而有些则需要不同分子混合组装[23~24]。DMOAP结合到玻片基底后,有一条长链状的烷基链,此结构使得液晶分子依长链状方向排列,而成垂直配向结果。利用此方法构建DNA液晶传感器,此方法取得良好的信噪比,并具有DNA无损性。
Shah等[23]通过不同pH的硅烷试剂修饰液晶盒的上下玻片,使得液晶在不同pH下呈现不同的排列方式。研究发现,液晶在HOOC(CH2)10SH修饰的基底上,平行于金沉积表面,而在HO(OCH2CH2)2(CH2)10SH修饰的基底,垂直与基底表面。他们推测这是由于随着基底修饰膜pH的增加,液晶分子与羧基的氢键作用受到抑制,而造成液晶排列方式的改变。
2 液晶生物传感器在生命科学中的应用
液晶分子作为一种良好的敏感材料,是基于它对外界刺激物(如电场或磁场)的快速反应。而且,由于各向异性,有序排列的液晶会被引入的抗体分子或细胞打乱。而这种排列上的变化可通过光学信号传达,初始状态的任何变化与引入物的性质和浓度有关,这正是液晶可用于生物传感器的原理。
由1.2可知,液晶可分为热致型液晶 (如5CB)和溶致型液晶。热致型液晶用于生物传感器中,其优势在于能与小分子(如蛋白质)兼容,但不能在水相中进行。此外,热致型液晶具有一定的毒性。溶致型液晶虽然无毒,且能与水兼容,但操作困难且只能用于大分子检测,如整个细胞。
2.1 免疫分析
早在1998年,Abbott与合作者开辟了液晶用于检测生物分子的新领域[13]。在随后的报道中,Abbott小组研究了关于金-硫醇自组装膜对液晶锚定作用[25]。研究旨在确定能否通过液晶5CB排列的扰乱程度来定量结合的IgG。5CB在24℃~35℃范围内表现出液晶特性,在液晶生物研究领域,被最常使用。IgG结合在自组装膜上,两片修饰有自组装膜的基底玻片面对面地组成液晶盒,中间留有约10 mm的间隙。5CB加热到液态,通过毛细管作用力被注射到液晶盒中,待冷却到液晶相,即可用偏光显微镜观察它的偏光信号。实验证实了结合的蛋白质与液晶偏光信号之间的联系,为后来的液晶传感器用于定量检测生物分子奠定了基础。
上述研究结果也间接证实了同一实验小组2001年的报道[26]。通过摩擦BSA标记的生物素膜,产生纳米微结构,对5CB起定向作用。这种配向方法为BSA标记的生物素与其抗生物素IgG之间的免疫反应提供一种良好的检测手段。低浓度的IgG对液晶均一排列产生轻微的扰乱,而高浓度时,扰乱程度加大,也就表明,液晶受扰乱程度与结合BSA的IgG量有关。该小组进一步研究发现[24],如同基底表面形貌对于5CB的影响,IgG-抗体复合物对液晶5CB的响应取决于该复合物的结构。然而,根据一定的结构,对IgG-抗体复合物进行结构修饰会限制5CB定向排列的能力。
2.2 蛋白质分析
Luk等[27~28]精心设计了优良的组氨酸激酶液晶传感器。在三(乙二醇)烷基硫醇修饰的基底上固定His-tag MEK酶,捕获抗-MEK IgG与之结合,免疫蛋白复合物修饰的基底改变液晶排列状态,实现对His-tag MEK酶的检测。在他们随后的研究中又发现了一有趣的事实:5CB的光学信号与蛋白质共价键合在金表面的排列状态有关。
Guzman 2005年研究了在液晶溶液中随机分散和有序分布的纳米颗粒对其影响[29]。对于高浓度的纳米粒子,各向异性的液晶5CB保持了单域取向,但对周期性吸附的纳米粒子则不尽相同。这些纳米级粒子大小与蛋白质和病毒分子相当。此研究通过正交偏光状态下的偏光图像确定了纳米颗粒对液晶畴结构的影响。由此,也考察了液晶生物传感器的敏感性。
传统的蛋白质分析主要依靠于紫外和可见吸收光谱分析。Xue和Yang[30]报道了一种准确、可靠的液晶蛋白分析法。该方法可用于检测浓度非常低的IgG,BSA,抗IgG的FITC和抗生物素的 FITC (5.0 μg/mL,6.0 μg/mL,0.40 μg/mL 和0.37 μg/mL)。但是这种方法只能提供一个简单的肯定或否定的回答。
2.3 核酸分析
Kim和合作者们研究了DNA芯片上DNA杂交所引起液晶向列变化[15]。该小组证实了DNA杂交引起5CB各向异性的变化通过肉眼可测。Lai等的研究开启了DNA无损检测的大门[19]。他们在TEA/DMOAP修饰的基底表面,制成DNA芯片。DNA即可诱导液晶5CB发生向列变化,偏光图像由黑暗转为明亮,且DNA固定区和无DNA区现象差别显著。更重要的是,该方法不会破坏固定上的核酸链,将液晶溶液清洗掉,DNA单链仍可与目标链杂交,通过荧光信号可证明。Andrew和Daniel结合了阳离子表面活性剂(OTAB),构建了DNA液晶传感器[16]。通过二次诱导,实现对DNA的低浓度检测,检测下限可达50 fmol,且能很好的区别一个碱基错配的DNA。
2008年,Lockwood[31]报道了单分子磷脂在液晶-水相界面中的特殊作用。寡肽聚合膜在液晶-水相界面,有选择的实现磷脂的传递。从液晶5CB的光学定向信号即可看出水相到液晶相的传递。据此推断,通过酶动力传递特定磷脂,可间接测定酶活力。同小组[32]也报道了关于在5CB-水相交界面上的单分子磷脂与蛋白质之间的相互作用。只有特定的蛋白质才能引起5CB光学信号的变化。
2.4 溶致型液晶的运用
除了5CB,研究者们还发现了一种特殊的聚合物分散型液晶-一种溶致型液晶相[33]。色甘酸磷酸钠盐-DSCG溶于不同的多羟基水化物中,被水乳胶包裹,呈现表面活性剂性质,与同浓度的热致型液晶相比,双折射性更强。这种聚合物液晶被用于药物传递检测中。
使用热致型液晶时,配体和受体需要在液晶加入前结合,而溶致型液晶则可先让配体与液晶相达到平衡,加入受体后,液晶向列变化。这样使得实验能在生理条件进行(如体液或细胞液中)。
Abbott小组[12]2002年运用月桂酸钾酯/正癸醇和水的混合物制得溶致型液晶,以检测IgG。2006年,该小组[34]在进一步研究中发现一种新的液晶:β-氨基酸的螺旋低聚体。这种短的β-多肽在水中能构成溶致型液晶,这样大大扩展了液晶生物传感技术的应用领域。Woolverton的研究[35]也提出了一种简单、有效的溶致型液晶传感器,用于检测微生物。病原体存在下,免疫复合物的加入打乱了DSCG的有序性。这种快速的变化有望实现液晶生物传感技术的在线实时监测。
3 液晶生物传感器的展望
从最初化学家们的好奇发现,到现在液晶显示器的大批量生产,液晶分子引领了现代工业技术的新潮流。同时,它对外界刺激(电场或磁场)的高灵敏性与现代集成电路的高速发展,给电子工业带来一场空前的革命。
随着近年来科学家们对液晶用于生物分析领域的极大关注,液晶似乎又开启了它应用领域的巨大篇章。尽管液晶生物传感器的研究还处于初级阶段,但发展势态良好。在短短一代人的时间里,液晶生物传感器就已被用于病原体检测、重大疾病诊断、基因组学分析等领域。随着科学技术之间的相互渗透,酶联免疫法、SPR、荧光分析等方法与液晶生物传感技术相结合,可以发展更灵敏更快速的传感器,且可望实现液晶传感器的微型化和自动化。便携式液晶传感仪用于疾病诊断可使病人无需在医院漫长的等待,在家即可自我检测。如同对集成电路工业的推动一样,液晶液将给基因组学的发展带来又一次风暴。
[1]王新久.液晶光学与液晶显示[M].北京:科学出版社,2006.1~20.
[2]Demus D.100 Years liquid crystal chemistry[J].Mol.Cryst.Liq.Cryst,1988,165:45~84.
[3]Shoichi Ishihara.How far has molecular alignment of liquid crystals been elucidated[J].IEEE/OSA Journal of display Technology,2005,1(1):30.
[4]Scheidt K A,Johnston J N,Willis M C.Rubbing-Induced Molecular Reorientation on an Alignment Surface of an Aromatic Polyimide Containing Cyanobiphenyl Side Chains[J].J.Am.Chem.Soc,2001,123(12):5 678~5 776.
[5]Castellano J A.Surface anchoring of liquid crystal molecules on various substrates[J].Mol.Cryst.Liq.Cryst.,1983,94(12):33~36.
[6]Robert W F,Patel J S.Chemically induced high-tilt surfaces for liquid crystals[J].Appl.Phys.Lett.,1987,50(20):1 426~1 428.
[7]Berreman D W.Solid Surface Shape and the Alignment of an Adjacent Nematic Liquid Crystal[J].Phys.Rev.Lett.,1972,28(26):1 683~1 686.
[8]Berreman D W.Alignment of Liquid Crystal by Grooved Surfaces[J].Mol.Cryst.Liq.Cryst.,1973,23(26):215.
[9]Kim Y B,Park S Y,Choi J W,et al.Rubbed polyimide films studied by scanning force microscopy[J].Appl.Phys.Lett.,1995,66(17):2 218~2 219.
[10]Huang J Y,Li J S,Chen S H.Rubbing-Induced Molecular Alignment on a Rubbed Alkyl-Branched Polyimide Film[J].Mol.Cryst.Liq.Cryst.,1995,270(8):77~84.
[11]Kim S R,Shah R R,Abbott N L.Orientations of LiquidCrystals on Mechanically Rubbed Films of Bovine Serum Albumin:A Possible Substrate for Biomolecular Assays Based on Liquid Crystals[J].Anal.Chem.,2000,72(19):4 646~4 653.
[12]Kim S R,Abbott N L.Manipulation of the Orientational Response of Liquid Crystals to Proteins Specifically Bound to Covalently Immobilized and Mechanically Sheared Films of Functionalized Bovine Serum Albumin[J].Langmuir,2002,18(13):5 269~5 276.
[13]Gupta V K,Skaife J J,Abbott N L,et al.Optical Amplification of Ligand-Receptor Binding Using Liquid Crystals[J].Science,1998,279:2 077~2 080.
[14]John A Van Nelson,Seung-Ryeol Kim,Nicholas L Abbott.Amplification of Specific Binding Events between Biological Species Using Lyotropic Liquid Crystals[J].Langmuir,2002,18(13):5 031~5 035.
[15]Hak-Rin Kim,Jae-Hoon Kima,Tae-Sun Kim,et al.Optical detection of deoxyribonucleic acid hybridization using an anchoring transition of liquid crystal alignment[J].Applied Physics Letters.,2005,87(14):143 901~143 903.
[16]Andrew D Price,Daniel K Schwartz.DNA Hybridization-Induced Reorientation of Liquid Crystal Anchoring at the Nematic Liquid Crystal/Aqueous Interface[J].J.Am.Chem.Soc.,2008,130(26):8 188~8 194.
[17]Haupt K,Mosbach K Mosbach.Molecularly Imprinted Polymers and Their Use in Biomimetic Sensors[J].Chem.Rev.,2000,100(7):2 495~2 504.
[18]Matthew L Tingey,Sean Wilyana,Edward J Snodgrass,et al.Imaging of Affinity Microcontact Printed Proteins by Using Liquid Crystals[J].Langmuir,2004,20(16):6 818~6 826.
[19]Siok Lian Lai,Shisheng Huang,Xinyan Bi,et al.Optical Imaging of Surface-Immobilized Oligonucleotide Probes on DNA Microarrays Using Liquid Crystals[J].Langmuir,2009,25(1):311~316.
[20]Deny Hartono,Wei Jie Qin,Kun-Lin Yang,et al.Imaging the disruption of phospholipid monolayer by proteincoated nanoparticles using ordering transitions of liquid crystals[J].Biomaterials,2009,30(12):843~849.
[21]Lelidis I,Öedman C.Influence of substrate nature and growth conditions on the morphology of thin DMOAP films[J].Liquid Crystals,2003,30(6):643~649.
[22]Karabert M S,Osmanagic E,Musevic I.Surface anchoring of nematic liquid crystal 8OCB on a DMOAP silanated glass surface[J].Liquid Crystals,2006,33(5):581~585.
[23]Shah R R,Abbott N L.Using Liquid Crystals To Image Reactants and Products of Acid-Base Reactions on Surfaces with Micrometer Resolution[J].J.Am.Chem.Soc.,1999,121(49):11 300~11 310.
[24]Skaife J J,Abbott N L.Influence of Molecular-Level Interactions on the Orientations of Liquid Crystals Supported on Nanostructured Surfaces Presenting Specifically Bound Proteins[J].Langmuir,2001,17(18):5 595~5 604.
[25]Skaife J J,Abbott N L.Quantitative interpretation of the optical textures of liquid crystals caused by specific binding of immunoglobulins to surface-bound antigens[J].Langmuir,2000,16(7):3 529~3 536.
[26]Kim S R,Abbott N L.Rubbed Films of Functionalized Bovine Serum Albumin as Substrates for the Imaging of Protein-Receptor Interactions Using Liquid Crystals[J].Adv.Mater.,2001,13(19):1 445~1 449.
[27]Luk Y Y,Tingey M L,Dickson K A,et al.Imaging the binding ability of proteins immobilized on surfaces with different orientations by using liquid crystals[J].J.Am.Chem.Soc.,2004,126(29):9 024~9 032.
[28]Luk Y Y,Tingey M L,Hall D J,et al.Using Liquid Crystals to Amplify Protein-Receptor Interactions:Design of Surfaces with Nanometer-Scale Topography that Present Histidine-Tagged Protein Receptors[J].Langmuir,2003,19(5):1 671~1 680.
[29]Guzman O,Abbott N L,Pablo J J.Quenched Disorder in a Liquid-Crystal Biosensor:Adsorbed Nanoparticles at Confining Walls[J].J.Chem.Phys.,2005,122(18):184 711-4~184 711-10.
[30]Xue C Y,Yang K L.Dark-to-bright optical responses of liquid crystals supported on solid surfaces decorated with proteins[J].Langmuir,2008,24(2):563~567.
[31]Lockwood N A,Gupta J K,Abbott N L.Self-assembly of amphiphiles,polymers and proteins at interfaces between thermotrpic liquid crystals and aqueous phases[J].Surf.Sci.Rep.,2008,63(2):255~293.
[32]Park J S,Teren S,Tepp W H,et al.Formation of oligopeptidebased polymeric membranes at interfaces between aqueous phases and thermotropic liquid crystals[J].Chem.Mater,2006,18(26):6 147~6 151.
[33]Simon K A,Sejwal P,Gerecht R B,et al.Water-in-Water Emulsions Stabilized by Non-Amphiphilic Interactions:Polymer-Dispersed Lyotropic Liquid Crystals[J].Langmuir,2007.23(3):1 453~1 458.
[34]Pomerantz W C,Abbott N L,Gellman S H.Lyotropic Liquid Crystals from Designed Helical beta-Peptides[J].J.Am.Chem.Soc.,2006,128(27):8 730~8 731.
[35]Woolverton C J,Gustely E,Lanfang L,et al.Liquid crystal effects on bacterial viability[J].Liq.Cryst.,2005,32(4):417~423.

