双介入联合放疗治疗肝癌合并门静脉癌栓初步临床研究
李志欣,刘秀荣,高登鹏
(河北省廊坊市医院,河北 廊坊 065000)
肝细胞癌(HCC)是我国常见的恶性肿瘤,年病死率位居恶性肿瘤病死率的第2位。伴发的门静脉癌栓(PVTT)既可成为转移扩散、术后复发的基础,又可引起或加剧门静脉高压、顽固性腹水、肝功能衰竭而导致死亡,是影响肝癌患者生存期的重要因素。据文献报道,尸检、影像学或肝癌病理学检查发现20%~70%的HCC患者合并有PVTT[1]。PVTT的出现是肝癌中晚期表现,预后差,自然生存期只有3个月左右[2]。本研究目的在于探究肝脾动脉双介入治疗结合PVTT放疗治疗肝癌合并PVTT的临床效果。
1 资料和方法
临床资料:选择2002年3月~2008年7月在我院住院治疗的肝癌合并PVTT,并且超声或造影显示门脉向肝性血流方向患者61例,其中23例经病理证实,男46例,女15例,年龄36~78岁,平均56.3岁,合并乙肝36例,合并肝硬化22例,AFP>400μg/L 43 例,AFP 20~400μg/L 11 例,AFP<20μg/L 7例,CHILD-PUGH肝功能分级:A级43例,B级18例,肝内肿瘤个数1~3个,肿瘤直径3~12cm,平均5.8cm,门静脉癌栓Ⅰ型18例、Ⅱ型26例、Ⅲ型17例,随机分为两组,治疗组30例,对照组31例,两组临床症状无显著性差异。
治疗方法:治疗组采用喜素20mg、5-Fu 500~1000mg、表阿霉素10~20mg、超液化碘油5~20ml,其中喜素及5-Fu各取半量于肝固有动脉及脾动脉内分别灌注,表阿霉素和超液化碘油制成混悬液进行肝内癌灶及门脉癌栓的栓塞,双灌注术后1周进行门脉癌栓的放疗,用超声或CT定位,Co60照射剂量3Gy/次,时间3周,每周5次,癌栓总剂量为45Gy,放疗结束3周后复查,根据患者身体及癌栓情况可重复进行双灌注治疗2~6次。对照组肝动脉化疗栓塞(TACE),所用药物喜素、顺铂、5-Fu、表阿霉素、超液化碘油等,每次间隔4~6周,治疗2~8次。治疗期间两组均给予保肝、增加免疫力、保护胃黏膜等综合支持治疗。
观察指标:肿瘤大小变化、癌栓变化、AFP变化、生存期。
统计学分析:用SPSS统计软件分析两组数据,P<0.05为两组间差异有统计学意义,生存率采用Log-Rank检验。
2 结果
治疗组两疗程后PVTT消失4例,占13.33%,缩小6例,20例增大。TACE组门脉癌栓1例消失,占3.22%,4例缩小,26例增大。癌栓的变化两组间有显著差异(P<0.05)。
TACE组6、12、18和24个月生存率分别为 45.16%(14/31)、29.03%(9/31)、16.13%(5/31)和 12.90%(4/31),平均生存期12.19个月。
治疗组6、12、18和24个月生存率分别为76.66%(23/30)、50.00%(15/30)、23.33%(7/30) 和 16.66%(5/30), 平均生存期17.82个月,两组生存率亦有显著差异(P<0.05)。
AFP值的变化:治疗前AFP≥200μg/L的患者,治疗后下降 50%以上者,治疗组 60%(18/30),对照组 61.3%(19/31),两组比较无显著性差异(P>0.05)。
两组病例均有不同程度的胃肠反应,经对症处理后,得到了完全缓解;治疗组骨髓抑制16例,对照组骨髓抑制14例,给以升白药物处理后,完全恢复,未出现严重并发症。
3 讨论
HCC合并PVTT发生率较高,而且不论原发灶大小均可发生癌栓。据文献报道[3],40%~90.2%晚期肝癌患者在门静脉主干或主要分支内形成癌栓。即使小肝癌,门静脉内形成癌栓的比例也相当高。Chau等[4]发现37例直径<2cm肝癌的手术切除标本,镜下PVTT发生率为40.15%,而115例直径为2.1~4cm肝癌的手术切除标本,PVTT发生率高达49.6%。
目前,由于术中常有肉眼不可见的癌栓残留、脱落致栓塞及播散的可能,多数病例手术取栓后癌栓很快复发,部分病例可能反而加快了其病程进展;而且,不论采用何种手术方法,要彻底取尽癌栓多较困难;另外,由于多数患者发现肝癌合并PVTT时,已无法手术根治,因此,外科治疗PVTT效果并不理想。
TACE被公认为HCC非手术治疗的首选方法。但既往认为,PVTT造成门静脉阻塞,加重了门静脉高压,同时减少了肝脏供血,此时行TACE阻塞肝动脉血流,易造成肝脏缺血,从而加重肝损害,造成肝功能衰竭。因此,TACE被视为禁忌。随着对PVTT研究的深入及介入治疗水平的提高,HCC合并PVTT已不再是TACE的禁忌证。
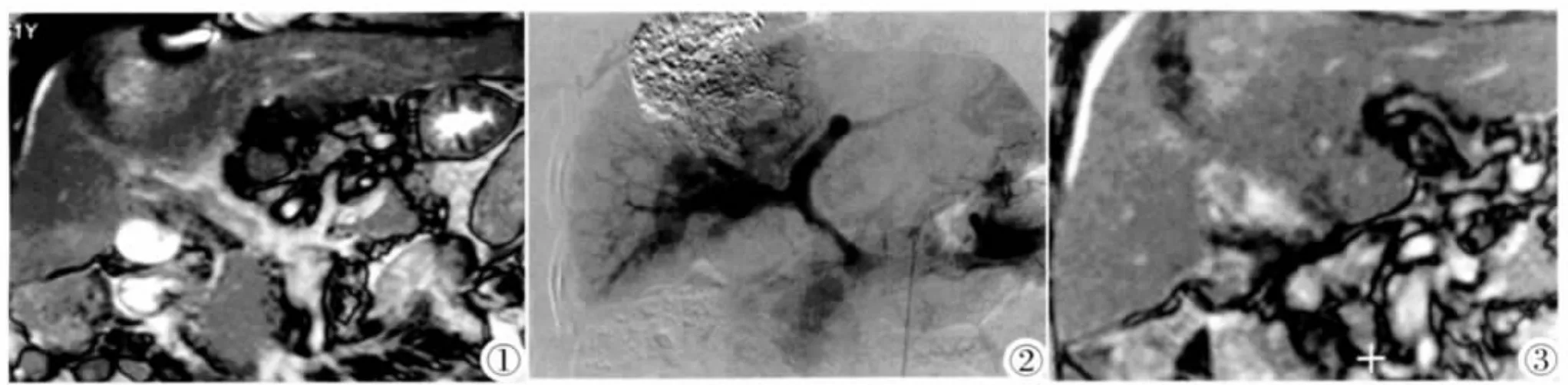
图1 MRI显示门脉主干及右支癌栓。 图2 TACE术中造影显示门脉主干及右支癌栓。 图3 经TACE联合放疗后PVTT缩小。Figure 1.MRI showed tumor emboli in main portal vein and its right branch. Figure 2.Angiography showed tumor embolus of portal vein and right branch during TACE. Figure 3.Tumor embolus of portal vein decreased in size after TACE and radiotherapy.
有研究表明,大部分PVTT生长有一定的特征性或规律性[5]:①大部分(95%以上)癌栓以主瘤为基部在同侧门静脉内生长,而在对侧门静脉内生长较少。②绝大多数(几乎100%)癌栓以门静脉壁作为支架离心式向门静脉主干方向生长蔓延。③癌栓的平均生长速度为每月(1.2±0.4)cm,生长相对缓慢,这为临床干预治疗创造了机会。
程树群[6]基于癌栓的生长规律和特征以及门静脉解剖的特点建立了一个PVTT分型标准:根据癌栓的发展程度(即侵犯不同门静脉部位),将癌栓分为Ⅰ~Ⅳ型:癌栓累及二级以上门静脉分支者为Ⅰ型;累及一级门静脉分支者为Ⅱ型;累及门静脉主干者为Ⅲ型;累及肠系膜上静脉或下腔静脉者为Ⅳ型。该分型标准对判断预后、制定正确的治疗方案,评价疗效具有指导意义。
一般认为,如果间接门静脉造影显示向肝血流,PVTT位于左干或右干(Ⅱ型),或二级分支(Ⅰ型),或主干癌栓(Ⅲ型)未引起门静脉的完全阻塞,可超选至供血动脉予灌注化疗加碘油栓塞,深行明胶海绵颗粒等主干栓塞。如果间接门静脉造影显示离肝血流,则以灌注化疗为主,可超选至供血动脉行少量碘油栓塞。而Ⅳ型则是TACE禁忌证。
HCC合并的PVTT在大多数患者中只是不同程度地减少了门静脉血流,并未完全阻断血流,而且PVTT是缓慢形成的,在其形成过程中,机体可代偿地在门静脉周围形成侧支循环。已有研究表明,PVTT主要接受动脉性肿瘤血管和胆管周围毛细血管丛的动脉血供应,部分癌栓可具有动脉和门脉的双重血供。TACE治疗中,碘油可通过交通支进入PVTT内,并可少量沉积,这说明TACE对癌栓有一定疗效。临床研究发现,癌栓碘油沉积量与其缩小比率呈正相关[7]。
由于单纯TACE治疗HCC合并PVTT疗效有限,目前,有学者采用经皮经肝门静脉灌注化疗或化疗栓塞术联合TACE治疗HCC合并PVTT。由于经双途径给药,无论其依靠何种血供,都能起到治疗作用。但是,HCC大多是在肝硬化的基础上发生的,肝脏体积缩小,质地变硬,肝裂增宽,门静脉主干突出于肝实质外,加之肿瘤及癌栓对穿刺路径的阻挡,增加了经皮经肝穿刺的操作难度和风险,而且凝血机制受损,拔管后穿刺道不易止血等都给临床实施带来重重困难。笔者采用脾动脉置管,经间接门静脉途径灌注化疗,达到了经双途径给药的目的,降低了技术难度,避免了经皮经肝穿刺的各种并发症,避免了双重穿刺给患者带来的痛苦和不便,利于推广。
HCC的放射根治量为6000cGy,全肝的放射耐受量为5000cGy,局部小野的放射耐受量为5500cGy,因此,肝脏的放射耐受量低于HCC的放射根治量,致使常规放疗效果不佳。针对门静脉癌栓的局部放疗,靶区照射剂量集中,提高了疗效,减少了周围正常组织不必要的损伤,提高了患者耐受力。部分患者放疗后癌栓体积缩小,减少了癌栓脱落所致的转移和播散,增加了门静脉血流量,改善肝功能,缓解了门静脉高压,从而提高了生存质量,延长了生存期。
TACE的近期疗效显著,缩小肿瘤作用优于放射治疗,因而先行TACE治疗,使PVTT的发展尽快得到控制,以免出现PVTT引起的严重并发症,为进一步治疗赢得时机。TACE治疗后宜间歇足够时间再行放射治疗,以利正常肝细胞的修复。放射治疗后可根据肿瘤及癌栓的控制情况及患者的耐受性再行TACE治疗。此外,根据PVTT内肿瘤细胞的活性程度可将其分成4型[8]:增生型、坏死型、混合型和机化型。在HCC伴PVTT时,早期癌栓以增生型为主,对射线比较敏感,放疗后癌栓可有不同程度的缩小;晚期癌栓为增生和坏死混合型,体积较大,癌栓部分坏死机化,此时,即使其中的癌细胞被射线杀死,癌栓失去活性不再发展,癌栓大小也无明显变化,而临床症状改善或无发展,也应认为临床治疗有效。
[1]黄文坚.原发性肝癌合并门静脉癌栓的研究进展[J].国外医学外科分册,1991,18(2):81.
[2]刘瑞鸣,毕玉华,郝全.肝癌合并门静脉癌栓的影像诊断及治疗[J].实用外科学杂志,1992,12(5):241.
[3]Nakashima T.Pathology of hepatocellular carcinoma tumor thrombus of the portal vein[J].Acta Hepathologica Japonica,1984,25:120-126.
[4]Chau CY,Lui WY,Wu CW.Spectrum and significance of microscopic vascular invasion in hepatocellular[J].Surg Oncol Clin N Am,2003,12:25-34.
[5]程树群,吴孟超,程红岩.原发性肝癌门静脉癌栓生长特征的研究[J]. 中国现代普通外科进展,2003,6:103-105.
[6]程树群.原发性肝癌癌栓分型的探讨[J].中国现代普通外科进展,2003,6:171-173.
[7]Guler C,Samli M,Aksoy Y,et al.Effects of carbon dioxide pneumoretroperitoneum on free radical formation in remote organs and use of verapamil as an antioxidant[J].J Endourol,2004,18:245-249.
[8]Atsuo J.Pathological study of hepatocellular carcinoma:a study of tumor thrombus of the portal vein[J].Acta Hepathologica Japonica,1983,24(6):641-643.

