儿童局灶性颞叶癫痫:3.0T1H-MRS及MR海马容积分析
孙 鹤,刘兆玉,王丰哲,王晓煜,郭启勇
(中国医科大学附属盛京医院放射科,辽宁 沈阳 110004)
癫痫是神经系统常见疾病,在不同年龄组中,儿童发病率最高,原发性癫痫大部分为颞叶癫痫(TLE),而80%的原发性癫痫与海马硬化有关,但常规MRI对海马硬化的显示和诊断敏感性较低[1]。随着MRI技术不断发展,氢质子波谱(1H-MRS)及海马磁共振容积 (vMR)测量已成为诊断该疾病较先进的无创性检查手段。本研究对临床及动态脑电图确诊的30例局灶性颞叶癫痫 (fTLE)患儿行海马1H-MRS及vMR检查,并结合其临床症状、发作频率等特点进行影像学分析,旨在提高癫痫诊断的准确率及敏感性。
1 材料与方法
1.1 研究对象
患者组30例均为采用国际抗癫痫联盟标准(临床及动态脑电图)确诊的fTLE患儿(年龄5~14岁,平均8.5岁,男 18例,女12例),常规 MRI检查均为阴性。排除由颅内占位、炎症及脑血管疾病等其他疾病引起的继发性癫痫。正常对照组30例(年龄5~14岁,平均8.8岁,男14例,女16例),无系统性疾病及神经系统症状和体征、无脑实质病变的非癫痫患者。30例fTLE患儿入院前首发症状年龄为1个月~9岁,癫痫发作频率为1~21次/月不等,4例具有癫痫家族史,6例儿时有热惊厥史。
24小时动态脑电图诊断标准:发作开始时的临床症状和脑电图变化都是由于一侧大脑半球局部神经元异常放电所引起,病灶区出现棘慢波。左颞叶病变14例,右颞叶16例。临床表现多以抽搐为主,伴有其他不典型癫痫症状。
1.2 检查技术
扫描仪器为我院3.0T MR扫描仪 (Philips Intera Achieva),SENSE 头线圈,常规 MRI检查:轴位T1WI (TR/TE=127.75/2.3ms)、T2WI (TR/TE=3000/80ms)、DWI (TR/TE=1630.84/56ms)、T2-FLAIR(TR/TE=11000/143.12ms);矢状位 T1WI(TR/TE=142.18/2.3ms);冠状位 T1WI(TR/TE=135.82/2.3ms),层厚为4mm,间隔为4.8mm。
1H-MRS扫描采用Brain_1VOI_144_exc序列,Measurements:128,Acq time:512,TR/TE=2000/37ms,体素大小为20.0mm×10.0mm×10.0mm,正交模式扫描。患者组感兴趣区(ROI)分别取左、右侧海马,正常对照组取任一侧海马,获取相应的1H波谱曲线,计算相应各个波峰面积值并得到NAA/Cr值。
海马容积测量以T1加权斜冠状位扫描层面(TR/TE=136/2.3ms)作为主要的测量层,层厚5mm,无间隔。应用PACS自带软件手动勾画出海马轮廓并测量其容积。
1.3 后处理
1.3.11H-MRS后处理
ROI定位于病灶侧及对侧海马(图1)。1H-MRS后处理包括零点调整、基线调整、相位校正等。软件自动分析、测量波谱中主要代谢产物的信号强度,包括 NAA (化学位移 δ=210),Cr (化学位移 δ=310),Cho(化学位移δ=312),各代谢物含量的测量以波谱曲线下面积积分的绝对值为准,并计算代谢物NAA/Cr比值。
1.3.2 海马vMR测量
海马结构划分[2](图2):MRI上通常将海马结构分为头、体、尾三部分。海马头部:前上界借侧脑室钩状隐窝区分杏仁体与海马头部;下界与下托紧邻的白质结构极易区分下托及海马旁回;外界为颞角内界借下界向上的延伸区分海马结构和钩。海马体部:上界为脉络膜裂,内缘游离;外界及下界划分方法与头部相同。海马尾部:外上界为穹窿脚;内上界为胼胝压部;下界为扣带回峡部及海马旁回。
海马结构体积计算:在T1斜冠状面进行海马容积测量,采用人工分割方法计算各层面积,乘以层厚即可获得该层面海马容积(图3)。
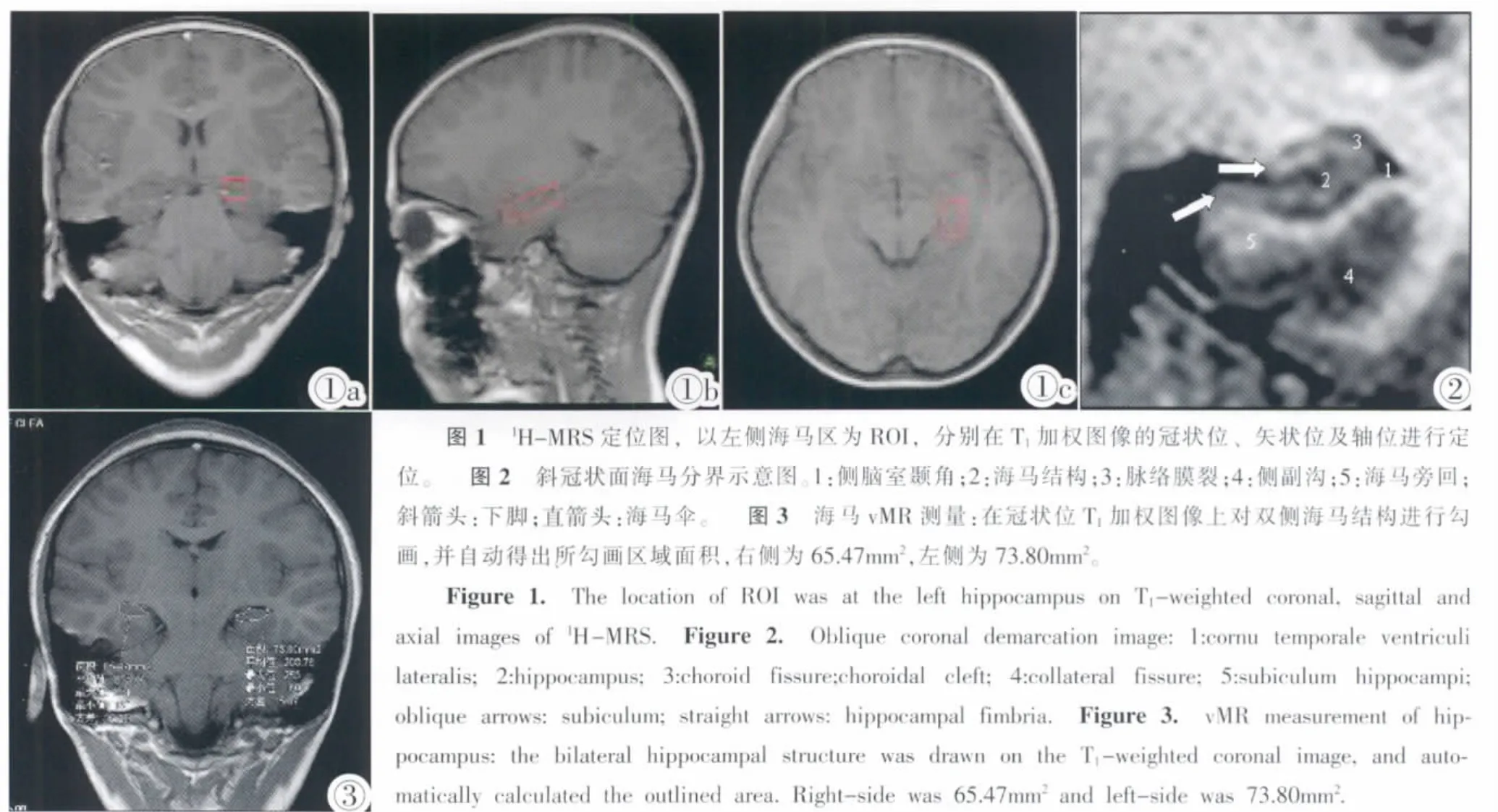
图1 1H-MRS定位图,以左侧海马区为ROI,分别在T1加权图像的冠状位、矢状位及轴位进行定位。 图2 斜冠状面海马分界示意图。1:侧脑室颞角;2:海马结构;3:脉络膜裂;4:侧副沟;5:海马旁回;斜箭头:下脚;直箭头:海马伞。 图3 海马vMR测量:在冠状位T1加权图像上对双侧海马结构进行勾画,并自动得出所勾画区域面积,右侧为65.47mm2,左侧为73.80mm2。Figure 1. The location of ROI was at the left hippocampus on T1-weighted coronal,sagittal and axial images of1H-MRS. Figure 2. Oblique coronal demarcation image:1:cornu temporale ventriculi lateralis;2:hippocampus;3:choroid fissure;choroidal cleft;4:collateral fissure;5:subiculum hippocampi;oblique arrows:subiculum;straight arrows:hippocampal fimbria. Figure 3. vMR measurement of hippocampus:the bilateral hippocampal structure was drawn on the T1-weighted coronal image,and automatically calculated the outlined area.Right-side was 65.47mm2and left-side was 73.80mm2.
海马结构容积标准化[3]:
VOLin=VOLi×TIVm/TIVi
(其中VOLin为标准化后的体积,VOLi为未标准化体积即原始测量体积,TIVm是所有受试者平均颅内体积,TIVi为该受试者颅内体积,即从脑的顶点到大脑脚出现层面,测量方法同海马体积测量)。
为了降低主观因素所造成的误差,所有数据均为同一人在同一计算机上进行测量。
1.3.3 统计分析
结果采用SPSS 11.0统计软件进行分析,测得各参数以±s表示。病灶侧与正常对照组及病灶对侧比较采用单因素方差分析;癫痫发作频率与病灶侧海马容积相关性比较采用Spearman相关性研究。以P<0.05为有显著性差异。
2 结果
2.1 海马1H-MRS及vMR值比较
患者组及正常对照组儿童常规MR检查结果均为阴性。病灶侧、病灶对侧及对照组的海马区NAA/Cr值及容积值比较见表1。病灶侧较病灶对侧NAA/Cr值及海马容积明显减小,其结果具有统计学差异(P<0.001);病灶侧与对照组比较NAA/Cr值及海马容积亦具有显著性差异(P<0.001);病灶对侧与对照组比较其结果无显著性差异(P>0.05)。正常对照组及fTLE患儿病灶侧波谱图见图4a,4b。
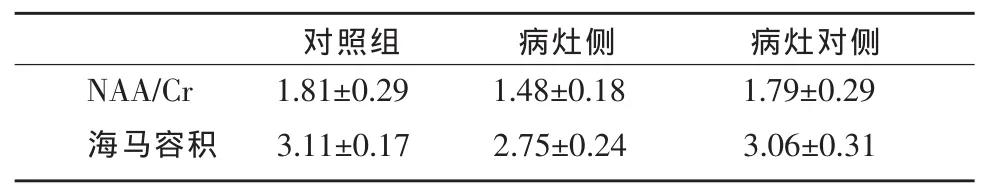
表1 fTLE患儿病灶侧、病灶对侧及对照组1H-MRS代谢物和海马vMR定量结果
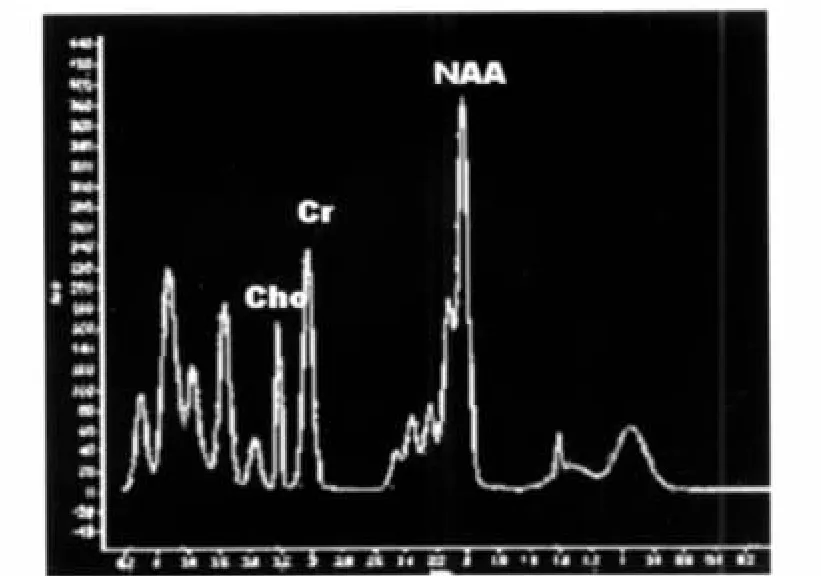
图4a 正常对照组儿童1H-MRS图,NAA/Cr值为2.11。Figure 4a. 1H-MRS image of the normal control child:NAA/Cr value was 2.11.
研究中6例有热惊厥史的患儿病灶侧海马容积为(2.31±0.15)cm3,其余 24 例无热惊厥史患儿病灶侧海马容积为(2.85±0.29)cm3,两者比较有统计学差异(P<0.05)。
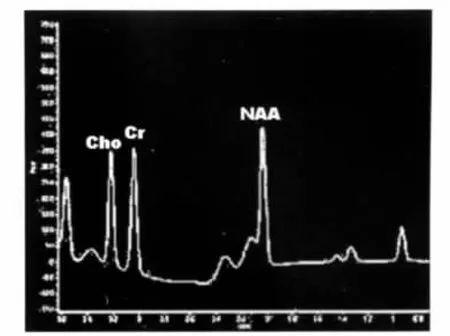
图4b fTLE患儿病灶侧1H-MRS图,NAA/Cr值为1.12。Figure 4b. 1H-MRS image of the focus side:NAA/Cr value was 1.12.
2.2 1H-MRS及vMR定位结果
30名正常对照组儿童NAA/Cr值的95%参考值范围为1.71~1.91;海马容积的95%参考值范围为3.04~3.17cm3。当患儿测量值低于此范围最小值者视为病灶侧,并与动态脑电图(AEEG)结果进行比较,得到1H-MRS的准确率为80%、敏感度为93%,vMR的准确率为78%、敏感度为83%,详见表2,3。结合病史,病程时间短的患儿(<1个月,n=4)1H-MRS定位准确率为75%(3/4)。
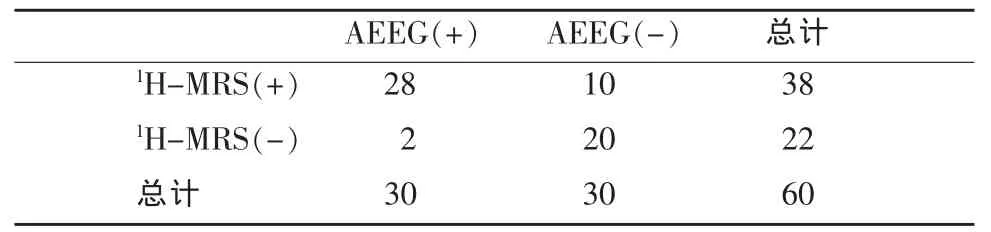
表2 1H-MRS与AEEG结果比较
2.3 癫痫发作频率与病灶侧海马容积的相关性研究
本研究中,30例fTLE患儿病灶侧海马vMR值与癫痫症状发生频率并未表现出明显相关性 (相关系数r=0.024,P=0.902),见图5。在6例癫痫发作频率较低患儿(≤2次/月)中,我们发现他们病灶侧的海马容积[(2.64±0.35)cm3]与其余 24 例癫痫发作频率相对较高患儿(>2 次/月)海马容积[(2.77±0.35)cm3]比较,不具有统计学差异(P>0.05)。
3 讨论
儿童癫痫是小儿神经内科一种常见病,但常规MRI检查很难明确诊断[1],随着1H-MRS及vMR检查技术的应用,可以为癫痫患儿特别是采取手术治疗的患儿提供更准确、可靠的诊断信息。
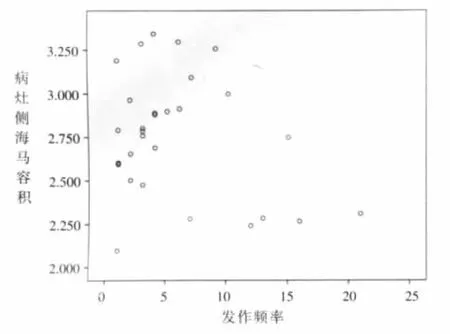
图5 fTLE患儿病灶侧海马容积与发作频率的散点图,可见两者并未表现出相关性。Figure 5. The focus side vMR of fTLE children and seizure frequency showed no correlation on the scatter plot.
3.1 1H-MRS
3.1.1 磁共振波谱原理及测定物质
MRS是检测活体组织器官能量代谢、生化改变的一种无创性技术。1H-MRS测定的常见物质有NAA、Cr和Cho等。NAA是乙酰天门冬氨酸类,广泛存在于神经元和轴突内,被认为是神经元的标志,其浓度减低常被解释为不可逆性神经元丧失;Cr属于肌酸/磷酸肌酸类,是能量代谢中高能磷酸键的缓冲储备物,其改变反映能量代谢的变化,由于其分布相对稳定,波谱分析中用作参照物;Cho是胆碱/磷酸胆碱类,是细胞膜的成分之一,其改变反映膜的代谢状态。1H-MRS是将检测到的脑代谢物反映在图谱上形成不同化学位移的共振峰[4]。
3.1.21H-MRS的定位、定量研究
1H-MRS对于TLE的定位诊断标准,国内外都以NAA/(Cr+Cho)值作为参考标准,而限于本院3.0T Philips Intera Achieva磁共振只能测量NAA/Cr,故本研究用该指标值对结果进行评价。研究结果显示30例fTLE患儿病灶侧NAA/Cr值较病灶对侧及正常对照组均明显减低,而病灶对侧与正常对照组比较未见明显差异,与国内外大多数研究结果一致[5]。并且Hammen等[6]的研究认为NAA的减低,很可能预示了神经元功能异常,而发作期Cr的增高可能与神经胶质细胞的增生有关。本研究中有6例患儿双侧海马区NAA/Cr值均低于参考范围最低值。Cross等[7]认为这是因为海马硬化引起的痫性放电传导至对侧,形成镜像病灶,导致了对侧相应部位脑组织神经元缺失及胶质增生,从而引起相应的化学代谢改变。
最近研究显示,1H-MRS检查显示的代谢异常要早于常规MRI,甚至亦早于MRI容积测量[8]。我们研究发现病史时间短的患儿(<1个月,n=4)1H-MRS定位准确率为75%(3/4),并未显示出此结果。
1H-MRS作为无创性研究活体脑组织代谢功能的方法进一步提高了对fTLE诊断的敏感性和准确性,但其技术性还存在一定局限及不足[9]:①1H-MRS所采集信号强度低,因此易受不确定因素影响,尤其对磁共振机磁场均匀度要求很高;②1H-MRS检查易受颅骨皮层内的钙及板障内脂肪等物质信号干扰;③区域定位选择方法不确定;④还不能有效的区别出代谢产物与神经递质混合物中的各种成分。
3.2 海马vMR测量
3.2.1 海马容积定位、定量研究
我们研究显示30例fTLE患儿病灶侧海马容积较病灶对侧及正常对照组均出现明显萎缩。Varho等[10]对19例患儿进行海马区域的研究显示患侧海马容积较对照组显著减小。此外,Spanaki等[11]对TLE患者的研究中得出了同样结论。
3.2.2 癫痫发作频率与海马萎缩
癫痫发作的频率与脑损伤程度之间的关系一直存在争议。K覿lvi覿inen在对一组无热惊厥的患者进行的研究发现,海马容积与部分或全身性癫痫发作的总次数具有相关性[12]。此外,Pulsipher等的研究认为受损处海马容积的减小与临床症状的发生具有相关性[13]。但本研究结果并未显示出二者之间存在相关性,这与Spanaki等[11]研究结果相同。而且我们将癫痫症状发作频率较少患儿(<2次/月)与发作频率相对较高患儿海马容积进行比较,并不具有统计学差异。由此我们认为,导致海马体积减小因素是多方面的,发作频率可能并不是主要因素。
3.2.3 热惊厥史与海马萎缩
研究还发现,6例有热惊厥病史患儿病灶侧海马容积较24例无热惊厥史患儿病灶侧海马出现明显萎缩,这与Salmenper覿[14]对难治性癫痫患者研究结果相似,他认为,患有难治性癫痫且曾有过复杂性热惊厥,这些患者较无此症状者来说,早期海马容积即明显减小。Cendes等[13]同样发现海马萎缩与儿时高热惊厥史有关。
3.2.4 其他影响海马容积因素
①利手,有关利手对海马容积右/左侧比率的系统性研究认为不同利手之间是有差别的[15];②年龄,有文献报道年龄亦会对海马容积造成影响[16];③性别,有学者报道男性海马大于女性[17]。本研究对象均为儿童,利手、年龄及性别对研究结果影响较小,且全部测量值均经过标准化处理,所以未对以上影响因素进行分组研究。
海马vMR测量的优势在于能够提供客观的判断数据,而且准确性较好;在病人体位不对称时,有利于对疾病作出诊断。但作为一项较新的技术手段,在实际应用中也存在许多问题:测量海马容积的方法不一致;是否进行标准化校正;根据解剖知识划定海马边界,存在着无法避免的人为干扰。这些都会造成实验的不准确性,需进一步完善。
总之,对于fTLE儿童的诊断,1H-MRS和海马vMR测量较常规MRI具有更高准确性及敏感度。但并不意味着它们可以取代其它相关检查,比如24小时动态脑电图监控,现在仍作为癫痫较常用的确诊手段。1H-MRS及海马vMR测量同其它新的检查一样,仍有待于更进一步的研究来加以完善,相信随着其深入的研究和推广应用,将会对癫痫的病因、诊断及其治疗带来重要影响。
[1]Briellmann RS,Mark Wellard R,Masterton RA,et al.Hippocampal sclerosis:MR prediction ofseizure intractability[J].Epilepsia,2007,48(2):315-323.
[2]Jack CR,Twomey CK,Zinsmeister AR,et al.Anterior Temporal Lobes and Hippocampal Formations:Normative Volumetric Measurements from MR Images in Young Adults[J].Radiology,1989,172(2):549-554.
[3]Cendes F,Leproux F,Melanson D,et al.MRI of amygdala and hippocampus in temporal lobe epilepsy[J].J Comput Assist Tomogr,1993,17(2):206-210.
[4]Schellinger PD,Fiebach JB,Jansen O,et al.Stroke magnetic resonance imaging within 6 hours after onset of hyperacute cerebral ischemia[J].Ann Neurol,2001,49(4):460-469.
[5]Hajek M,Dezortova M,Krsek P,et al.1H MR Spectroscopy in epilepsy[J].Eur J Radiol,2008,67:258-267.
[6]Hammen T,Schwarz M,Doelken M,et al.1H-MRS indicates severity markers in temporal lobe epilepsy:correlations between metabolic alterations,seizures,and epileptic discharges in EEG[J].Epilepsia,2007,48(2):263-269.
[7]Cross JH,Connelly A,Jackson GD,et al.Proton magnetic resonance spectroscopy in children with temporal lobe epilepsy[J].Ann Neurol,1996,39(1):107-113.
[8]Vermathen P,Laxer KD,Schuff N,et al.Evidence of neuronal injury outside the medial temporal lobe epilepsy:N-acetylaspartate concentration reductions detected with multisection proton MR spetroscopic imaging-initial experience[J].Radiology,2004,226(1):195-202.
[9]Willmann O,Wennberg R,May T,et al.The role of1H magnetic resonance spectroscopy in pre-operative evaluation for epilepsy surgery:A meta-analysis[J].Epilepsy Res,2006,71(2-3):149-158.
[10]Varho T,Kome M,Sonninen P,et al.Quantitative1H MRS and MRI volumetry indicate neuronal damage in hippocampusof children with focal epilepsy and infrequent seizures[J].Epilepsia,2005,46(5):696-703.
[11]Spanaki MV,Kopylev L,Liow K,et al.Relationship of seizure frequency to hippocampus volume and metabolism in temporal lobe epilepsy[J].Epilepsia,2000,41(9):1227-1229.
[12]K覿plvi覿inen R,Salmenper覿 T,Partanen K,etal.Recurrent seizures may cause hippocampaldamage in temporallobe epilepsy[J].Neurology,1998,50(5):1377-1382.
[13]Pulsipher DT,Seidenberg M,Morton JJ,et al.MRI volume loss of subcortical structures in unilateral temporal lobe epilepsy[J].Epilepsy Behavior,2007,11(3):442-449.
[14]Salmenper覿T,K覿lvi覿inen R,Partanen K,et al.Hippocampal and amygdaloid damage in partial epilepsy:a cross-sectional MRI study of 241 patients[J].Epilepsy Res,2001,46(1):69-82.
[15]Szabo CA,Xiong L,Lancaster JL,et al.Amgdalar and hippocampal volumetry in control participants:differences regarding handedness[J].Am J Neuroradiol,2001,22(7):1342-1345.
[16]Pruessner JC,Li LM,Serles W,et al.Volumetry of hippocampus and amygdala with software minimizing the discrepancies beween laboratories[J].Cereb Cortex,2000,10(4):433-442.
[17]Bhatia S,Bookheimer SY,Gaillard WD,et al.Measurement of whole temporal lobe and hippocampus for MR volumetry:normative data[J].Neurology,1993,43(10):2006-2110.

