新型碘油制剂及肝癌介入治疗研究进展
张洪瑞,陈 虎,朱 靖,毛景松,刘 刚
(1.厦门大学公共卫生学院 分子影像暨转化医学研究中心,福建 厦门 361102) (2.厦门大学附属翔安医院 介入科,福建 厦门 361102)
1 前 言
肝癌是全世界发病率和病死率最高的癌症之一,也是全球第6大常见癌症和第3大致死性癌症[1]。我国是全球肝癌高发国家之一,肝癌已成为我国第2大致死性癌症,对人民生命健康造成严重危害,其有效诊治是亟待研究和解决的问题[2]。肝细胞癌(hepatocellular carcinoma, HCC)是原发性肝癌中最常见的组织学类型[3]。手术切除和肝移植治疗是早期肝细胞癌的最佳治疗手段,但是由于疾病起病隐匿,大部分患者被发现时已经处于中晚期,失去了手术治疗的最佳时机。并且,肝移植价格昂贵且肝源稀少,能够接受肝移植治疗的患者十分有限[4]。对于不能手术切除、多病灶型或肝外扩散的中晚期肝细胞癌患者,经肝动脉化疗栓塞(transcatheter arterial chemoembolization, TACE)已成为国际各大诊疗指南的一线推荐治疗方法[5, 6]。碘油是目前TACE使用最广泛的栓塞剂,与各类抗肿瘤药物物理混合,制备成互不相溶的新型碘油复方药物乳剂是最主要的应用方式。
2 碘油应用于肝细胞癌诊疗的理论基础
2.1 肝细胞癌特殊的血供
大多数肝细胞癌是典型的富血管肿瘤,微血管生物标志物的表达与疾病的发展和进展有关[7]。正常肝脏组织受肝动脉和门静脉的双重血供,其中75%左右的血供来自门静脉,约25%来自肝动脉[8]。但原发性肝细胞癌主要是依靠肝动脉供血,仅有约10%的肝细胞癌存在门静脉供血[9]。正是由于肝细胞癌特殊的血供特点,经肝动脉开展介入治疗已经成为治疗非手术切除肝癌的重要手段之一。
2.2 碘油的特性
碘油能长期积聚于肝细胞癌组织中,而在正常组织中却很少积聚或很快被排泄掉[10]。碘油出现以上特性的原因尚不完全明确,目前多数学者认为,这与肝细胞癌组织血管丰富、血流量大、血管管壁弯曲,以及碘油粘度大、难排泄有关,肝细胞癌组织内淋巴系统的不完整及吞噬细胞的缺乏,也可能是碘油得以长时间滞留的原因[11-13]。根据肝脏肿瘤的血供特点和碘油在肝癌组织中的特异性分布,碘油常被用于肝动脉的栓塞治疗。碘油经肝动脉进入肿瘤靶血管之后,进入主要栓塞末梢血管并滞留,从而使肿瘤组织缺血、缺氧而坏死[13]。
碘油还具有不透X射线的特性,因此富集于肿瘤区域的碘油不仅可用于肿瘤的治疗,还可以应用于早期肿瘤的电子计算机断层扫描(computed tomography, CT)成像,协助诊断肿瘤在体内的位置和大小[7]。Liu等[14]研究发现,利用碘油做CT造影可以有效诊断直径≤1 cm的肝癌病灶。
在碘油的介入治疗中,碘油不仅发挥栓塞剂的作用,而且还承担载体的角色[7, 11],因其特异性滞留于肝细胞癌组织内的性质,可以在碘油中混入各类抑制肿瘤细胞生长的化疗药物、放射性核素等制成碘油混合乳剂,使药物在病灶局部长时间滞留,从而提高药物的疗效,并减少药物对其他正常组织细胞的毒副作用[7]。
3 碘油乳剂在肝细胞癌治疗中的研究进展
当前碘油乳剂在肝细胞癌治疗中的研究热点主要集中于以下2个方面:① 研究碘油作为载体与各类药物制成碘油乳剂的治疗效果;② 研究如何提高碘油乳剂的稳定性以取得更好的疗效。
3.1 与各类药物制成碘油乳剂
将碘油与各类药物混合制成的用于肝细胞癌治疗的碘油乳剂主要有细胞毒性化疗药物、药物洗脱微球(drug-eluting microspheres, DEBs)、放射性元素标记物、多功能纳米材料等乳剂(图1)。本文按上述分类选取了一些有代表性的研究进行了阐述。
3.1.1 碘油细胞毒性药物乳剂
目前经肝动脉化疗栓塞常用的细胞毒性药物有阿霉素、伊达比星、丝裂霉素C、顺铂等。细胞毒性化疗药物制成的碘油乳剂已被广泛应用于临床肝细胞癌的降期治疗和姑息疗法,并且已被众多临床试验证明能够有效抑制肝细胞癌的进展,延长患者的生存时间[15-17]。抗肿瘤的细胞毒性化疗药物与碘油在注射前经简单混合制成乳剂,经肝动脉注入,与单纯的静脉化疗相比,碘油和药物的混合乳剂能长期滞留在肝动脉,并且随血流进入肿瘤微血管内,药物在病灶处浓度更高、缓释时间更长,抑制、杀伤肿瘤的效果显著优于单纯静脉化疗,而且由于大部分药物都聚集于病灶处,化疗药物对正常组织细胞的影响减小,病人更少出现毒副作用[15, 17]。Lo等[16]开展了一项随机对照临床试验,试验选取了80名不能手术切除的肝细胞癌患者随机分为2组,试验组的40名病人采用TACE(顺铂碘油乳剂),对照组的40名病人采用一般对症治疗,结果分析显示,试验组的平均生存时间要显著长于对照组。目前临床上主要存在2个限制碘油化疗药物有效治疗肝细胞癌的因素。第1个因素是肝细胞的化疗栓塞尚未有统一规范化的定量标准[18],临床医师没有可参考的化疗药物种类及剂量标准,不同医院采用不同的方案和剂量,甚至同一科室的不同医师采用的方案也不相同。如何在标准不同的情况下比较疗效,以及如何依据不同的临床证据制定规范统一的量化标准是亟待解决的问题。第二个因素是简单混合的化疗药物碘油乳剂稳定性很差。临床上化疗药物和碘油的混合乳剂往往是在手术前用三通阀简单混合制成,由于许多化疗药物是水溶性的,无法稳定存在于碘油中,简单混合后仅数分钟便分层析出,这种药物突释作用严重影响了TACE治疗效果(图2)[19]。因此,改善碘油化疗药物混合乳剂的稳定性是提高TACE疗效的重要研究方向,本文后面章节将进行论述。

图2 超稳定均相混合配方技术及传统碘化配方技术制备的碘油阿霉素配方在0,3,12 h和21 d的稳定性情况[19]Fig.2 The stability of lipiodol doxorubicin (DOX) formula prepared by super-stable homogeneous intermixed formulation technology (SHIFT) and traditional iodinated formulation technology (TIFT) at 0, 3, 12 h and 21 days[19]
3.1.2 碘油药物洗脱微球乳剂
传统碘油栓塞剂的治疗效果虽然已在长期临床实践中得到证明,但是碘油在体内存在被组织降解及血液冲刷的问题,影响栓塞效果。药物洗脱微球是近年来发展的一类血管栓塞材料,其作为一种粒径可控的栓塞剂,可显著改善这一短板。除此之外,微球的使用更加精细和标准化[20],可减少治疗后的不良反应及毒副作用,如恶心、呕吐、肝区疼痛[7, 21]。然而微球本身没有靶向肿瘤细胞的性质,且目前还没有明确证据表明微球的疗效优于碘油。Golfieri等[22]开展的多中心随机对照试验对比了药物洗脱微球和传统碘油TACE在肝细胞癌中的疗效,指标包括肿瘤进展时间(time to progression, TTP)、不良事件(adverse events, AEs)和2年生存率。研究结果显示,DEBs与传统碘油TACE对肝细胞癌的治疗都是有效且安全的,TTP(P=0.766)和2年生存率没有统计学差异(P=0.949),唯一的不同是药物洗脱微球的腹痛发生率低于传统碘油TACE。如果能将碘油和微球混合,结合肿瘤对碘油特异摄取的优势和微球标准可控的优势,将极大提高栓塞剂性能,改善肝细胞癌介入治疗的效果。李兆南等[23]研究了聚乙烯醇微球碘油乳剂的治疗作用,发现聚乙烯醇微球碘油乳剂组的治疗有效率高于碘油明胶海绵颗粒组,且毒副作用和并发症的发生率更低。由于大部分药物洗脱微球表现为亲水性,因此与碘油难以实现稳定的混合,这成为阻碍碘油和微球混合应用的关键因素。为解决以上问题,Caine等[24]制备了新型的疏水性聚乙烯醇水凝胶药物洗脱微球,实现了微球与碘油的稳定混合,为研制碘油微球栓塞剂扩宽了道路。
3.1.3 碘油放射性元素标记物乳剂
经肝动脉放疗栓塞(transcatheter arterial radioembolization, TARE)是一种内部放射疗法,通过放射性高能射线的直接作用及电离辐射产生的氧自由基,导致DNA损伤,从而杀死癌细胞。与外部放射治疗相比,TARE在肿瘤内部的放射剂量更大而且对正常组织的影响更小,适用于多发性局部病灶和门静脉血栓形成的病例[7, 25]。根据肝细胞癌的血供特点,标记有放射性核素的碘油乳剂经导管通过肝动脉进入肿瘤组织之后,主要栓塞肿瘤末梢血管,在使肿瘤组织缺血缺氧坏死的同时实现“定向放疗”。这样就使得肿瘤组织本身聚集了足够的放射性核素,又减少了周围正常组织的暴露放射量,极大地提高了放疗效果,减小了放疗对正常组织细胞的影响[13]。而放疗与栓塞治疗的结合,进一步提升了治疗的效果。目前肝细胞癌TARE治疗应用较广泛的的核素有131I、90Y和188Re。131I标记的碘油已经在临床应用多年,但其疗效依旧存在争论。Dumortier等[26]进行了131I-碘油乳剂治疗的前瞻性研究,对研究对象随访2年,发现131I-碘油乳剂治疗组的肿瘤复发率低于单纯碘油组(28%vs.56%,P=0.0449)。近年来,由于其长半衰期(8 d)及高能γ辐射,131I碘油逐渐被90Y微球和188Re碘油取代。188Re与131I都发射β和γ射线,但188Re发射的γ射线很少,半衰期只有16.9 h,因此患者在治疗后仅需要短时间的隔离护理。此外,188Re辐射组织穿透深度达到4 mm,远大于131I的0.4 mm,更有利于杀伤深部肿瘤细胞[27]。188Re碘油的研究发展迅速,已有3种用于肝细胞癌治疗的188Re碘油类型:188Re-HDD、188Re-DEDC和188Re-SSS。其中188Re-HDD是研究最早和最多的,已经在数名中晚期肝癌患者的治疗中显示出良好的肿瘤抑制作用[27]。188Re-HDD的局限性在于其低放射标记率和过快的肾脏代谢。新研发的188Re-SSS是一种更稳定、标记效率更高的188Re碘油,目前正在进行临床试验[27, 28]。
3.1.4 碘油多功能纳米材料乳剂
随着多功能纳米材料技术的不断突破,以碘油作为载体,结合多功能纳米材料的治疗策略使得纳米药物的靶向递送性能不断改善。这种策略通过将纳米药物分散在碘油中,来实现肿瘤靶向的缓控释放,显著提高了纳米药物的给药效率,同时还减少了纳米材料对正常细胞组织的毒副作用,成为碘油临床应用研究的新方向[29]。Li等[30]制备了负载阿霉素的空心金纳米球,与碘油混合后经大鼠肝动脉给药,实现了光热消融和化疗栓塞的联合治疗,取得了良好的治疗效果。碘油多功能纳米药物不仅能在肿瘤部位实现多治疗联合,还可利用不同纳米材料的特点,实现多模态成像监测与可控的药物释放。Liu等[31]制备了一种有机二氧化硅包覆的磁性纳米颗粒,不仅可以负载阿霉素,还可以连接Cy5.5分子,与碘油混合经肝动脉给药,实现了荧光和核磁共振多模态成像。Kim等[32]制备了一种负载阿霉素的白蛋白纳米粒子碘油乳剂微泡复合物(DOX-NPs-MB),经肝动脉给药后可以通过超声监测药物的递送,并通过超声触发药物的释放,有效提高了VX2兔子模型中的肿瘤杀伤效果(图3)。多功能纳米材料极大地扩展了介入治疗在肝细胞癌中的应用,同时碘油又解决了纳米材料的靶向性和缓释性问题,这二者的结合应用还为肝细胞癌的介入治疗拓宽了道路。目前,碘油多功能纳米药物的研究还处于临床前研究阶段,如何尽早实现临床转化还需要研究人员的更多探索。
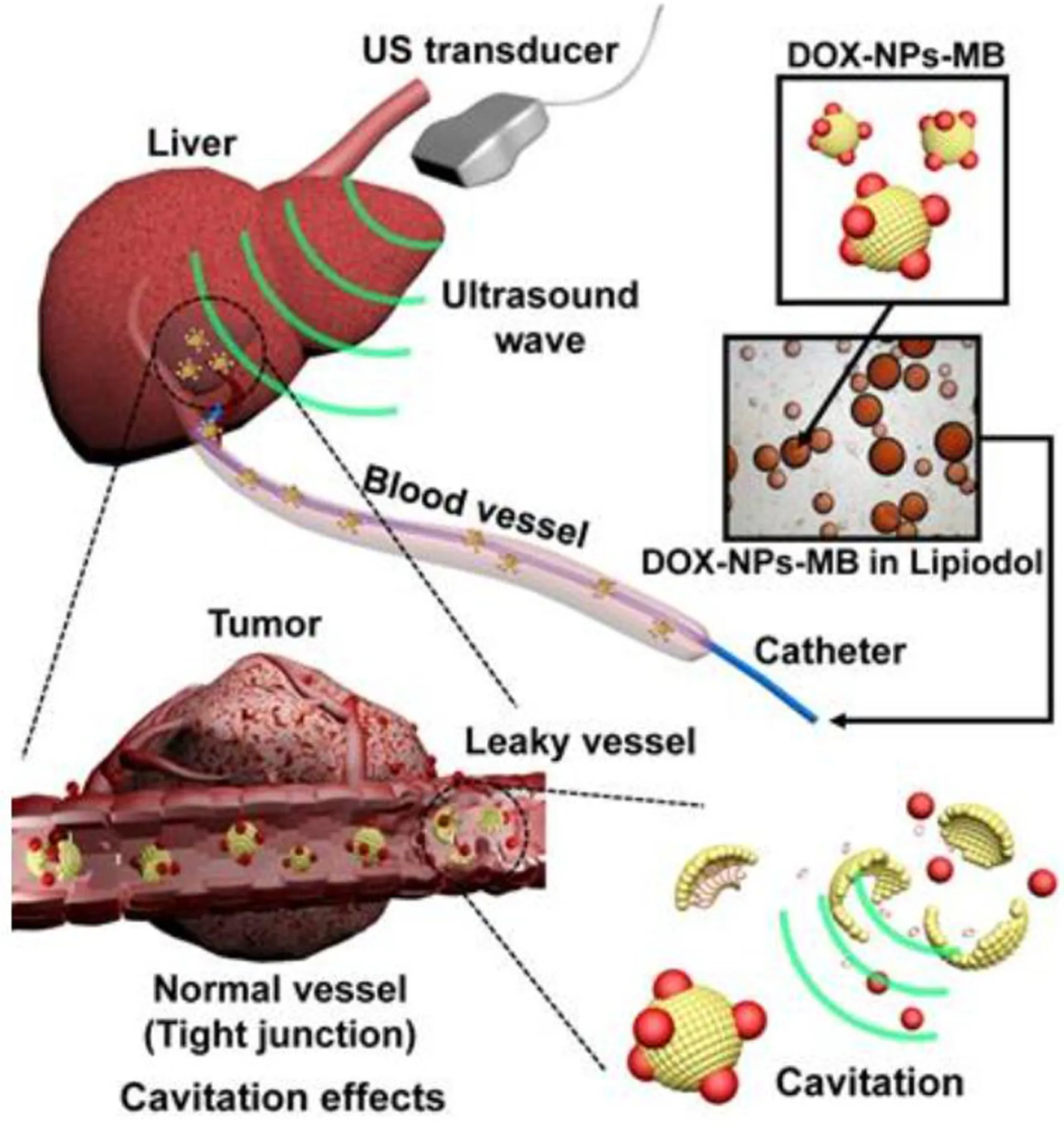
图3 碘油配方中采用DOX-NPs-MB复合物,以及在TACE过程中通过超声处理(US+)增强药物递送示意图(注:红色小球:负载阿霉素的白蛋白纳米颗粒,黄色小球:微泡)[32]Fig.3 Schematic illustration showing the use of DOX-NPs-MB complex in lipiodol formulation to enhance drug delivery via ultrasound irradiation (US+) during TACE procedure(PS:Red spheres :doxorubicin loaded albumin nanoparticles, yellow spheres:microbubbles)[32]
3.2 提高碘油乳剂稳定性
TACE的临床疗效尚不理想,可能的原因是用于治疗的碘油乳剂性质不稳定,导致能在靶点发挥作用的药物剂量小、浓度低、清除过快[33]。碘油乳剂的稳定性是影响其治疗效果的一个重要指标,稳定性好的碘油乳剂不易被冲刷稀释,在靶位的浓度更高、持续时间更久,可显著提高治疗效果。目前在化疗药物协同栓塞剂的常规制备工艺中,化疗药物与碘油大都是在手术前通过三向旋塞简单机械混合制备的。这种方式简单快捷,但是制作的乳剂往往存在药物分布不均、保存期短、制剂不稳定的问题。这些问题都限制了TACE的疗效。克服化疗药物在碘油中的不稳定性是提高肝细胞癌介入治疗疗效的重要方向和研究热点(表1)。

表1 增加碘油乳剂稳定性的策略Table 1 Strategies for increasing the stability of lipiodol emulsions
Deschamps等[34]在VX2兔子模型上探究了碘油乳剂的稳定性对治疗效果的影响,对照组使用传统的碘油阿霉素乳剂(油水体积比为1∶1),实验组使用提升稳定性的碘油阿霉素乳剂(油水体积比为3∶1,增添乳化剂)。结果表明,强化稳定型乳剂在HCC组织中的密度要高于传统乳剂组,实验组24 h后HCC组织中的阿霉素浓度也同样高于对照组,实验组肿瘤抑制程度更高,证明了稳定性更佳的碘油乳剂治疗效果更好。Boulin等[35]研究了4种稳定性不同的阿霉素碘油乳剂或伊达比星碘油乳剂,对8例不能手术治疗的肝细胞癌患者的治疗效果,结果显示,稳定性最好的碘油乳剂伊达比星-碘油乳剂抗肿瘤效果最好。
还有一种改善碘油乳剂稳定性的方法是制备Pickering乳剂,Pickering乳剂是一种以超细固体颗粒吸附在油/水界面以提高稳定性的剂型。Deschamps等[36]在VX2兔子模型上进行了分组实验,对照组采用传统的碘油奥沙利铂乳剂,实验组采用聚乳酸-羟基乙酸共聚物(poly lactic-co-glycolic acid, PLGA)纳米颗粒制备的Pickering碘油奥沙利铂乳剂。实验结果显示,Pickering组的药物稳定性更好、病灶处药物浓度更高、作用时间更长,显示出更好的肿瘤抑制效果。Deschamps等[37]还利用纳米PLGA成功制备了能稳定负载阿霉素的Pickering油包水碘油乳剂,并验证了其生物安全性,这种更稳定的Pickering乳剂有望为碘油乳剂栓塞治疗带来更好的疗效。
目前,提高碘油乳剂稳定性的策略大部分是改变药物性质或添加表面活性剂,但是这些方法可能会改变药物原本的结构,使药物无法发挥应有的作用,或者引入有毒基团引起毒副作用。基于此,作者课题组[38]开发了一种“超稳定均相混合配方技术(super-stable homogeneous intermixed formulation technology, SHIFT)”,该技术可以在超临界状态下混合制剂,提高了药物在碘油中的溶解度与稳定性。超临界状态即压力与温度都超过混合物的临界点时,该物质会处于一种特殊的流体状态,在这种状态下其扩散系数、密度、粘度等均会发生改变,有利于提高药物在溶质中的溶解性[39]。并且这种混合技术是绿色物理的,没有使用任何化学修饰,可应用于碘油与临床上广泛使用的多种药物的稳定混合,如诊断试剂、细胞毒性药物和放射性核素等[38]。利用该技术实现了化疗药物阿霉素和碘油的均一稳定混合,在取得更好疗效的同时减小了化疗药物对正常组织的影响[19]。此外,基于SHIIFT技术制备的吲哚菁绿(ICG)-碘油乳剂[40]表现出更好的荧光性能和稳定性,有望实现更精准的手术荧光导航(图4)。

图4 荧光引导下VX2兔子模型活体肿瘤切除的评价[40]:(a)分别用荧光强度投影系统和灯光下相机记录的手术前后照片,(b)对切除的肿瘤进行荧光成像、数字化X线成像系统(digital radiography,DR)成像和光声成像的照片,(c)在激光照射下抗淬灭情况Fig.4 Evaluation of living tumor resection in VX2 model rabbits guided by fluorescence[40]: (a) the fluorescence (FL) holographic projection and bright light (BL) was recorded at pre-operation and post-operation, (b) the resected tumors were measured by fluorescent, DR imaging and photoacoustic imaging, (c) the anti-quenching ability was recorded under laser exposure
4 结 语
碘油因其独特的性质在肝细胞癌的治疗中得以广泛应用,其不仅可作为栓塞剂,还可作为载体与各类抗肿瘤药物、放射性核素等制备成碘油药物乳剂,使这些抗肿瘤药物能够在肿瘤区聚集并持续发挥作用,显著提高治疗效果[7, 11]。研究碘油乳剂的应用对治疗肝细胞癌有着非常重要的意义,目前研究的热点集中于研制新型抗肿瘤碘油乳剂和增加碘油乳剂稳定性2大方面。随着对肝细胞癌分子发病机制和肿瘤微环境的不断深入研究,抗肿瘤血管生成治疗和免疫治疗正成为新的治疗趋势[41]。有研究报道,动脉栓塞术后会引起肿瘤内部缺氧加剧,导致HIF-α(缺氧诱导因子-1)和VEGF(血管内皮生长因子)等因子上调,引起肿瘤转移和复发[42]。多激酶抑制剂索拉非尼、舒尼替尼等药物能靶向阻断多种血管内皮生长因子信号,目前索拉非尼与经动脉栓塞的联合治疗已经在临床上得到应用,使患者无进展生存时间得到有效延长[43]。随着单克隆抗体药物被批准用于肝癌治疗,特别是程序性死亡受体1(PD-1)药物的应用,使免疫治疗联合介入治疗被寄予厚望,相关临床试验也不断开展起来。除此之外,还有一些肿瘤内部微环境响应的纳米材料也被设计出来[44],这些纳米材料能与肿瘤内部特殊的酸性、乏氧等微环境产生响应,缓解肿瘤内部缺氧、纠正过酸环境,使肿瘤内部微环境正常化,从而帮助抑制肿瘤血管的生长并激活抗肿瘤免疫。这些新型抗肿瘤药物在肝细胞的介入治疗中展现出惊人的潜力,有望制备成碘油乳剂,为患者带来新的希望。另一方面,碘油乳剂的良好稳定性是保证其抗肿瘤疗效的关键[33],制剂技术的突破和材料学的发展赋予碘油乳剂更加广阔的前景,应用新型制剂技术与新型纳米材料增加碘油乳剂的稳定性,能极大地拓展碘油乳剂平台,增强碘油被肝细胞癌特异性摄取的优势,不仅有利于更好地发挥药物疗效,还能显著减少治疗过程中的毒副作用和并发症,减轻病人的痛苦[29]。特别是既不改变药物性质,又不引入其他基团的“绿色”稳定技术研究,有望为碘油乳剂的应用带来新的突破。
碘油乳剂在长期治疗肝细胞癌的临床实践中业已证明极富应用价值,其缓释特性及对肝细胞肿瘤的超选择性使它成为肝细胞癌治疗研究道路上的“明灯”,对碘油乳剂的不断深入研究和应用拥有光明的前景。