15-脱氧前列腺素J2在大鼠缺氧性神经细胞损伤中的作用*
裴丽春,张一娜,张震环,刘美玲,韩 晶,张艳桥
(哈尔滨医科大学:1.附属第二临床医学院老年病科,哈尔滨150081;2.附属第三临床医学院内八科,哈尔滨150081)
脑卒中是许多发达国家致死和致残的主要原因。在中国,脑血管疾病是第3位致死因素,其中缺血性脑梗死占56.6%~80%,致残率占第1位。在以前的研究中发现环氧合酶-2(cyclooxygenase-2,COX-2)参与了缺氧性神经细胞损伤死亡的病理过程[1],过氧化物酶体增殖物激活受体-γ(PPA R-γ)参与了缺氧缺血后神经细胞损伤死亡的病理过程[2]。环氧合酶-2的代谢产物 15-脱氧前列腺素 J2(15d-PGJ2)是 PPAR-γ的天然配体[3],本实验通过使用缺氧再复氧装置,处理原代培养的大鼠皮质神经细胞,旨在探讨 15d-PGJ2在大鼠缺氧神经细胞损伤中的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组 使用的原代培养的大鼠皮质神经细胞来自于新生24 h以内的Sprague-Dawle大鼠的乳鼠,所有实验动物均由哈尔滨医科大学附属第二临床医学院动物中心提供。实验分别设对照组(未处理组)、缺氧再复氧组、不同浓度15d-PGJ2处理的缺氧再复氧组。
1.1.2 试剂 Neurobasal A、B27购自 Life Technologies Inc(Rockville,M D),15d-PGJ2购自Cayman Chemical Company。
1.2 实验方法
1.2.1 大鼠皮质神经细胞的原代培养 无菌条件下取出生24 h内的乳鼠放入75%的乙醇中消毒1~2 min后,用眼科剪刀迅速剪下鼠头部,用冰 D-Hank′s液冲洗,剪开颅腔,取出全脑,剥离皮层,仔细去除血管和脑膜。用手术剪刀将组织剪碎至1~3 mm大小。加入3~5倍体积的0.25%胰酶溶液,37℃水浴消化30 min,加入10%DMEM培养液终止消化,800 r/min离心5 min,弃上清液。加入10%DMEM培养液,用吸管轻轻吹打制成细胞悬液,静止后吸取上清液过200目不锈钢筛网。用10%DMEM培养液调细胞数为5×106/mL,接种至直径为35 mm培养皿中,每个培养皿2 mL。37℃、5%CO2培养。24 h后换维持含Neurobasal A、B27的培养液,以后每3天半量换液。接种3 d时加入终浓度为 5~10 μ mol/L的阿糖胞苷以抑制胶质细胞的生长。此方法培养的大鼠皮质神经细胞经鉴定证实95%为神经元。
1.2.2 神经细胞缺氧再复氧模型制备及分组 取培养第12天的皮质神经细胞,随机分成3组,即空白对照组(未处理组)、二甲基亚砜(DMSO)对照组、15d-PGJ2+缺氧再复氧组(缺氧前 30 min 分别加入 0、1、5、10、25、50 μ mol/L 15d-PGJ2),然后置于缺氧罐(95%N2,5%CO2)内,37℃培养箱中孵育2 h后,将神经细胞返回到37℃、5%CO2的细胞培养箱中再复氧21 h。
1.2.3 M TT比色法测定神经细胞生存情况 取培养第12天,生长在96孔培养皿中的原代培养的神经细胞,不同分组处理后,将125 mg/mL的噻唑蓝(M TT)40 μ L加入到每个孔中,37℃避光培养4 h后,每孔中加入 DMSO 150 μ L,振荡 10 min,置于酶标仪492 nm检测吸光度A值,结果以对照组生存率的百分比表示。
1.2.4 DNA凝胶电泳法检测神经细胞凋亡情况 培养第12天,生长在100 mm培养皿中的原代培养的神经细胞,经不同分组处理后,细胞用预冷的磷酸盐缓冲液洗涤1次,置于含有10 mmol/L Tris-盐酸(pH=7.4),10 mmol/L EDT A及0.5%TritonX-100裂解液中裂解,超速离心,使用碘化钠及乙醇在上清液中沉淀DNA,提取出的DNA在含1%~2%溴乙啶的1.2%琼脂糖凝胶中电泳,DNA被溴乙啶着色,最后在紫外线灯下摄影,观察凋亡的DNA在琼脂糖凝胶电泳中所出现的梯形裂解条带情况。
1.3 统计学方法 所有影像用Scion Image软件量化处理,统计学分析使用Statview软件的单因素方差分析(One-way ANOVA),以 P<0.05为差异有统计学意义。
2 结 果
2.1 神经细胞的原代培养 培养的皮质神经细胞接种1 h内开始贴壁,绝大多数是单个分散的细胞。3~5 h细胞开始变平,并且长出突起。3 d后细胞胞体清晰明亮、丰满、呈现锥体或星形;经细胞突起生长并形成网络。培养1周后,神经细胞胞体进一步增大,突起增粗并出现分支,此时神经细胞已接近成熟,成熟神经细胞边界清楚,在倒置显微镜下可见明显晕光(图1)。培养2周后,神经细胞网络连接紧密,形态更加饱满,可以应用于实验研究(图2)。
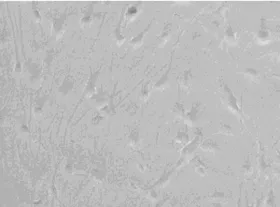
图1 皮质神经元细胞(培养1周,×100)
2.2 神经细胞特性鉴定 应用抗神经元特异性烯醇化酶(NSE)抗体对原代培养10 d的神经细胞进行免疫 FRTIC标记荧光实验,每个样本随机选择3个视野,分别计数200个细胞,判定原代培养神经细胞中神经元细胞和神经胶质细胞所占的比率。NSE抗体在培养的皮质神经细胞中的表达情况(图3),其中在荧光显微镜下观察呈现红色荧光的即为 NSE阳性细胞,即神经元细胞。结果为培养的皮质细胞中 NSE阳性细胞(即神经元细胞)占细胞总数的98.9%,提示原代培养的神经细胞中所含的神经元细胞数量完全能满足实验的需要。
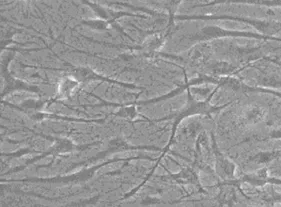
图2 皮质神经元细胞(培养 2周,×100)
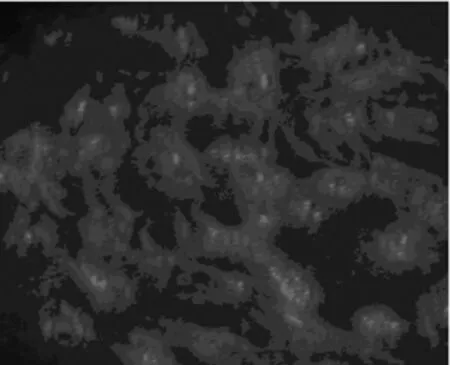
图3 NSE抗体在神经细胞中表达(×100)
2.3 15d-PGJ2对神经细胞生存率影响的剂量反应曲线 培养第12天的皮质神经细胞,给予不同浓度15d-PGJ2处理30 min,给予缺氧2 h再复氧21 h处理,使用M TT测定法测定神经细胞生存率。结果可见,外源性15d-PGJ2在1~5μ mmol/L(低剂量)没有明显的保护神经细胞的作用,而10 μ mmol/L(高剂量)以上则具有剂量依赖性保护神经细胞的作用,神经细胞生存率的上升情况在15d-PGJ2处理组与未处理组间比较差异有统计学意义(P<0.05,P<0.01)(图4)。
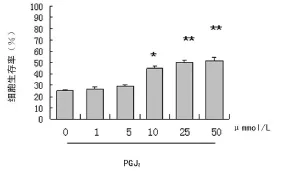
图4 外源性15d-PGJ2对神经细胞生存率影响的剂量反应曲线
2.4 15d-PGJ2对神经细胞损伤作用研究结果 给予培养第15d-PGJ2预处理 30 min,再予以缺氧2 h再复氧21 h处理,用DNA凝胶电泳法检测DNA核小体间断裂情况。结果显示,缺氧再复氧处理组皮质神经细胞出现典型的DNA梯形裂解条带,而15d-PGJ2预处理组皮质神经细胞DNA的断裂情况明显减轻(图5)。
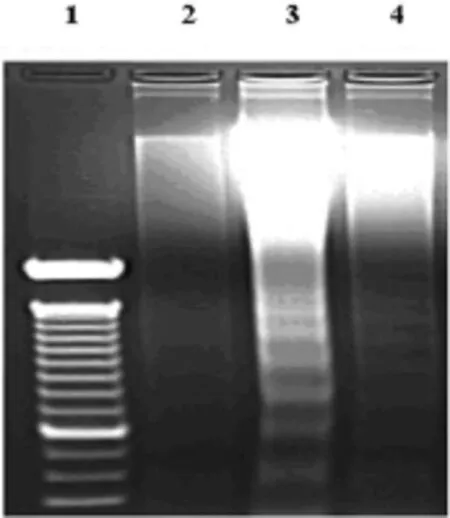
图5 DNA凝胶电泳法检测神经细胞凋亡情况
3 讨 论
脑血管疾病特别是缺血性卒中占长期致残疾病的第1位,严重威胁人类健康。对缺血性神经细胞损伤的研究,一直以来是学术界研究的热点。本研究在体外原代培养乳鼠神经细胞中使用缺氧再复氧模型,模拟体内缺血再灌注损伤,并应用15d-PGJ2进行干预。实验结果表明,15d-PGJ2在高剂量时具有剂量依赖性的保护神经细胞的作用,且15d-PGJ2预处理组皮质神经细胞DNA的断裂情况明显减轻。提示15d-PGJ2对神经细胞缺氧性损伤起保护作用。
目前发现环氧合酶(cyclooxygenase,COX)有2种亚型:COX-1和COX-2。COX-2是花生四烯酸代谢中的关键限速酶,将花生四烯酸转变为前列腺素H2(PGH2)[4-5],随后在不同酶的作用下分别生成 PGE2、PGI2、PGD2、PGF2a和 TXA2等。15d-PGJ2是由前列腺素D2(PGD2)在体内迅速通过脱水产生的具有的生物活性的 J2类的前列腺素。有资料表明15d-PGJ2对脑缺血具有保护作用[6]。15d-PGJ2能明显减少细胞凋亡,减少由于脑出血引起的炎症、行为障碍、神经元的丢失,促进过氧化氢酶的表达[7]。15d-PGJ2保护脑组织免于缺血再灌注损伤[8]。15d-PGJ2对脊髓损伤起保护作用[9]。血清15d-PGJ2浓度的升高使近期与远期的神经功能缺损相对轻于浓度低者,且梗死面积相对较小,15d-PGJ2对卒中患者起保护作用[1]。本实验在体外建立的神经细胞缺氧再复氧模型上验证了15d-PGJ2具有剂量依赖性保护神经细胞免于缺氧导致的死亡的作用,而且能减轻神经细胞凋亡。因此,推断15d-PGJ2参与了神经细胞死亡的病理过程。
但有关15d-PGJ2是通过何种机制达到保护神经细胞的作用机制迄今仍不清楚,有实验表明,15d-PGJ2能与PPAR-γ结合而影响着许多基因的转录而作用细胞周期[11]。但也有实验表明15d-PGJ2可能通过非PPAR-γ途径对卒中起保护作用[12]。另有实验表明15d-PGJ2可能通过阻止小神经胶质细胞活化和炎性细胞因子的表达起到神经保护作用[13]。对15d-PGJ2是通过何种机制达到保护神经细胞的相关研究有待进一步深入。
[1]张艳桥,陈仁武,徐长庆,等.环加氧酶-2在大鼠原代皮质神经细胞缺氧损伤中的作用[J].中国病理生理杂志,2004,20(12):2280.
[2]张艳桥,张一娜,吴江,等.过氧化物酶体增殖物激活受体γ在缺氧缺血性神经细胞死亡中的作用[J].中华医学杂志,2005,85(10):684.
[3]Ricote M,Li AC,Willson TM,et al.The peroxisome proliferator-activated receptor-γ is a negative regulator of macrophage activation[J].Nature,1998,391(6662):79.
[4]向银洲,魏莲枝.环氧合酶-2及其抑制剂与头颈肿瘤研究进展[J].重庆医学,2007,36(4):350.
[5]张祖列,闵苏.环氧化酶-2特异性抑制剂在心血管疾病中的应用及研究进展[J].重庆医学,2005,34(11):1742.
[6]Ou Z,Zhao X,Labiche LA,et al.Neuronal expression of peroxisom eproliferatoractivated receptor gamma(PPARγ)and 15d-prostaglandin J2-mediated protection of brainafter experimental cerebral ischemia in rat[J].Brain Res,2006,1096(1):196.
[7]Zhao X,Zhang Y,Strong R,et al.15d-Prostaglandin J2 activates peroxisome proliferator-activated receptor-gamma,promotes expression of catalase,and reduces inflammation,behavioral dysfunction,and neuronal loss after intracerebral hemorrhage in rats[J].J Cereb Blood Flow Metab,2006,26(6):811.
[8]Lin TN,Cheung WM,Wu JS,et al.15d-prostaglandin J2 protects brain from ischemia-reperfusion injury[J].Arterioscler Thromb Vasc Biol,2006,26(3):481.
[9]Kerr BJ,Girolami EI,Ghasemlou N,et al.The protective effects of 15-deoxy-delta-(12,14)-prostaglandin J2 in spinal cord injury[J].Glia,2008,56(4):436.
[10]Blanco M,M oro M A,Dávalos A,et al.Increased plasma levels of 15-deoxyDelta prostaglandin J2 are associated with good outcome in acute atherothrombotic ischemic stroke[J].Stroke,2005,36(6):1189.
[11]Kondo M.15-deoxy-delta 12,14-prostaglandin J2:the endogenous electrophile that induces neuronal apoptosis[J].Proc Natl Acad Sci USA,2002,99(11):7367.
[12]Pereira MP,Hurtado O,Cá rdenas A,et al.Rosiglitazone and 15-deoxy-Delta12,14-prostaglandin J2 cause potent neuroprotection after experimental stroke through noncompletely overlapping mechanisms[J].J Cereb Blood Flow Metab,2006,26(2):218.
[13]Kapadia R,Yi JH,Vemuganti R.Mechanisms of anti-inflammatory and neuroprotective actions of PPAR-gamma agonists[J].Front Biosci,2008,13:1813.

