姜黄素逆转HL60/ADR及MCF-7/ADR的多药耐药研究
靳 胜,陈书恩,张 曼,张 敏,张秀敏,郝 林,许华林
(1.北京世纪坛医院临检中心 100038;2深圳罗湖妇幼保健院检验科 518019)
多药耐药(multidrug resistance,MDR)是指肿瘤细胞一旦对某种化疗药物产生耐药性,同时对其他结构无关、作用机制亦各异的药物也产生交叉耐药性,这是一种独特的广谱耐药现象,是导致肿瘤化疗失败的最主要原因[1],90%以上肿瘤患者的死亡都与肿瘤耐药性有关。姜黄素(curcumin)是从姜科姜黄属植物姜黄根茎中提取的一种酚类色素,由于其色泽稳定且毒性低,目前已广泛用于食品添加剂中。姜黄素具有广泛的药理作用,有研究表明,姜黄素对多种肿瘤细胞具有明显的抑制作用,其机制可能为诱发肿瘤细胞凋亡、阻断肿瘤细胞的生长信号传导通路和抑制肿瘤血管生成等多种因素;同时有学者认为,它还具有逆转多药耐药的作用。本实验分别选择实体瘤(乳腺腺癌M CF-7/ADR,表达 Mdr1以及 M RP基因)和白血病(急性早幼粒细胞白血病HL60/ADR,表达M RP基因)2个细胞系观察姜黄素在体外能否逆转多药耐受糖蛋白 P-gp、MRP介导的耐药性并初步探讨其可能的机制,为进一步的研究奠定基础。
1 材料与方法
1.1 药物与试剂 姜黄素、阿霉素(ADM)为国产试剂,PRMI-1640、小牛血清购自Gibco公司。MTT为Sigma产品,RTPCR试剂盒为华美公司产品,引物由北京奥科生物公司合成。
1.2 细胞生长抑制试验 按MT T法进行[2],取1×105/mL的细胞,接种于96孔培养板中,每孔180μ L,培养24h后加入20μ L 不同浓度的 ADR(0.05、0.1、0.25、1.5、2.5g/L)以及姜黄素(25μ mol/L),对照组 1加 20μ L生理盐水,对照组 2单独加入姜黄素,对照组3仅加阿霉素继续培养72h,再向每孔加入20μ L MTT,避光孵育4h后,1 000×g离心10min,弃上清液,每孔加入 100μ L DMSO,震荡混匀后于酶标仪 490nm(630nm校准)处测定吸光度(A),计算抑制50%细胞生长的药物浓度值IC50,并计算逆转指数。
细胞存活率(IC)=实验组平均A值/阴性对照组平均A值。逆转指数(RI)=IC50(耐药细胞+ADR)/IC50(耐药细胞+ADR+CUR)。
1.3 流式细胞仪检测细胞凋亡 取对数生长期细胞,制备细胞悬液成1×108/mL,24h后加入阿霉素1.72μ mol/L(1g/mL)以及阿霉素和姜黄素,在37℃、5%CO2、饱和湿度的培养箱中培养,使用10%新生牛血清的RPMI1640培养液。继续培养24h。收集细胞,70%的冰乙醇固定过夜,50g/mL的RNase 37℃处理 1h,100g/mL的碘化丙啶(PI)4℃、染色30min,流式细胞仪进行检测分析。
1.4 细胞内ADM药物浓度测定 取对数生长期细胞,制备细胞悬液成1×108/mL,加入 1μ g/mL的 ADM,350目尼龙网过滤,于1h内用流式细胞仪测定,由于阿霉素有天然的荧光显色的性质,激发波长为 488nm,接收波长为575nm,观察荧光强度并以此为依据评价药物浓度。
1.5 RT-PCR法检测耐药基因表达 将两种细胞系分别收集并提取RNA,使用RNA提取试剂盒、AM V第一链cDNA合成试剂盒提取RNA和反转录为cDNA,再经PCR扩增,进行琼脂糖凝胶电泳,用凝胶图像分析仪照相并分析结果。具体操作步骤按试剂盒说明书进行。以β-actin为内对照,合成Mdr1、MRP引物[2-3],进行 RT-PCR,扫描灰度,计算目的基因与β-actin的灰度比值[4]。
Mdr1 引物 :5′-CCC ATC ATT GCA ATA GCA GG-3′;5′-GTT CAA ACT TCT GCT CCT CA-3′;片段长 157bp;PCR条件:94℃、40s,56℃、1min,72℃、1min,扩增 30个循环。MRP 引物 序列:5′-ACA CTC CAC AGA TCA CTC-3′;5′-CAT GGT GCA GGG TCT ACG-3′;片段长290bp;PCR条件:94℃、45s,55℃、45s,72℃、45s,扩增 30 个循环。β-actin 的引物[4]:5′-CTA CAA TGA GCT GCG TGT GGC-3′;5′-CAG GTC CAG ACG CAG GAT GGC-3′,片段长 292 bp;PCR 条件:94℃、40s,58℃、1min,72℃、1min,扩增 30 个循环。
1.6 Western blot检测Bcl-2蛋白的表达 将细胞系HL60/ADR和 MCF-7/ADR培养 24h,再加入阿霉素 1.72μ mol/L(1μ g/mL)和姜黄素(25μ mol/L)联合作用24h后提取总蛋白,用BCA法进行蛋白定量,取50μ g蛋白加入4×SDS凝胶加样缓冲液中,100℃加热10min以使蛋白质变性。用12%SDS聚丙烯酰胺凝胶进行电泳分离,转PVDF膜。用丽春红染色观察转移效果,并确定蛋白分子量标准位置。用5%脱脂牛奶封闭2h电泳转膜加一抗、二抗DAB染色,检测Bcl-2蛋白表达,分析差异。
1.7 统计学方法 结果取3次测定的平均值,进行t检验。
2 结 果
2.1 生长抑制试验结果 对照组显示姜黄素对细胞生长无毒性,单独的姜黄素细胞存活率在95%以上,排除了姜黄素对细胞的毒性作用;结果显示对于非耐药细胞系,加入姜黄素后IC50无明显差异,而耐药细胞系在加入姜黄素后IC50有显著性差异,逆转指数分别为4.18(HL60/ADR)和3.39(MCF-7/ADR),见表 1。
表1 姜黄素、ADM对不同细胞系的生长抑制试验结果(n=3,μ mol/L)

表1 姜黄素、ADM对不同细胞系的生长抑制试验结果(n=3,μ mol/L)
细胞系 ADM ADM+curcumin HL60/ADR 28.450±7.11 6.800±2.240 HL60 0.101±0.04 0.114±0.030 MCF-7/ADR 18.440±2.98 5.440±1.900 MCF-7 1.310±0.19 1.190±0.550
2.2 流式细胞仪检测细胞凋亡 由于细胞固定后质膜通透性升高,降解的DNA释放,因此DNA组方图出现二倍体峰(G0/G1期细胞)的减少,并在G0/G1期峰的左侧出现亚二倍体峰,即凋亡峰(Ap峰)。同时加入姜黄素和ADR的HL60/ADR和MCF-7/ADR均出现凋亡,数值分别为 35.15%和27.48%,而单独使用1.72μ mol/L(1μ g/mL)的阿霉素处理后,HL60/ADR和MCF-7/ADR的凋亡细胞百分比仅为4.11%和3.08%。这一实验结果说明姜黄素加入后可在体外诱导耐药肿瘤细胞凋亡,对细胞多药耐药有逆转作用。
2.3 细胞内药物浓度 HL60/ADR和MCF-7/ADR细胞分别经1μ g/mL的ADM、ADM 和姜黄素联合作用1h后,流式细胞仪测得细胞内的药物浓度有显著性差异;同时加入阿霉素和姜黄素的试验组细胞内的荧光强度明显高于单独使用ADM的试验组,差异有统计学意义(P<0.01),见表2和图1。
2.4 耐药基因以及 Bcl-2蛋白检测结果 HL60/ADR和MCF-7/ADR细胞经ADM和姜黄素联合作用1h后提取RNA进行逆转录,RT-PCR检测发现MCF-7/ADR细胞M dr1基因表达降低不明显(HL60/ADR细胞系本身不表达 Mdr1基因),检测MCF-7/ADR以及HL60/ADR细胞系的M RP基因表达发现下调显著,见图2;Bcl-2蛋白在两种细胞系中经加入姜黄素后表达均明显降低,见图3。这些结果说明耐药逆转的作用靶点可能是M RP基因,并且有促进凋亡的作用。

表2 ADM、姜黄素作用不同细胞系后细胞内ADM荧光强度

图1 流式细胞仪测得不同细胞系细胞内阿霉素浓度
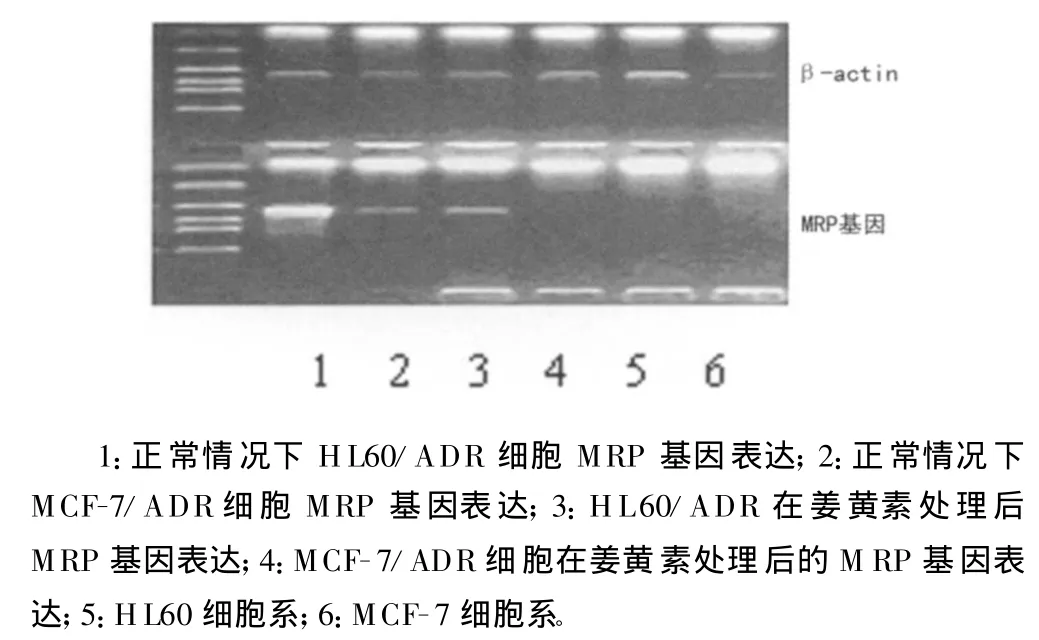
图2 M RP基因PCR扩增结果

图3 Bcl-2蛋白Western Blot检测结果
3 讨 论
姜黄素是从姜黄根茎中提取的一种酚类色素,主链为不饱和脂族及芳香族基团。目前认为其具有抗炎、抗菌、保肝、治疗创伤、抗癌、抗病毒等活性[5]。有文献表明,姜黄素对人类恶性肿瘤细胞有诱导分化和增殖抑制作用[6],并且可以促进肿瘤细胞凋亡,与丝裂霉素等抗肿瘤药物具有协同作用[7-8]。并且可以抑制血管的生成,有研究显示它也是抗致突变剂。由于上述原因,其抗癌作用近年来受到重视,有资料显示姜黄素能抑制实验动物乳腺癌、皮肤癌的发生,缩小瘤体大小并可显著降低小鼠膀胱移植癌的成瘤率。因其不良反应小,被认为是一种有广泛应用前景的抗癌新药,美国国家肿瘤研究所已将其列为第3代癌化学预防药。而且目前普遍认为对这类药物的研究不仅可以开拓它本身的应用领域,还可为设计更理想的新药提供新的独特的化学结构,后者可被用为创制新药的先导化合物,经验表明这种做法可以更经济的筛选发现新药。在抑制肿瘤的同时,有研究认为该药物还具有逆转多药耐药的作用。本实验结果也证实姜黄素同时可以在体外有效逆转某些实体瘤(乳腺腺癌 MCF-7/ADR)和白血病(急性早幼粒细胞白血病HL60/ADR)细胞系的多药耐药,姜黄素组和阿霉素组的敏感性分别比对照组增加3.39倍和4.18倍。根据RT-PCR和Western Blot检测结果,其逆转靶点可能为M RP基因,同时细胞系的凋亡也可能通过Bcl-2蛋白途经得到了加强。肿瘤细胞的多药耐药机制很多,但一般认为药泵是其主要并且是最易进行逆转的途径;Mdr1以及MRP基因的编码产物为药物转运蛋白通过外排泵作用使细胞内药物浓度下降导致耐药[9-10],通过RT-PCR检测发现MRP基因在两种耐药细胞系中表达均有所下调,而流式细胞仪检测加入姜黄素后的细胞内阿霉素荧光强度明显高于单独使用阿霉素的试验组,说明姜黄素可能通过抑制转运蛋白的药泵功能使药物有效进入细胞内部达到治疗的结果。同时其抑制效应不但作用于实体瘤细胞而且作用于白血病细胞系,提示姜黄素的作用不仅仅是针对某一类肿瘤(实体和血液病),其具有较好的广谱逆转效应。实验同时显示,姜黄素对耐药细胞系有明显的促凋亡作用,并对Bcl-2蛋白的表达有所抑制。姜黄素能否在体内试验中同样逆转多药耐药,以及是否通过促进凋亡以及抑制药泵在体内起到逆转耐药作用还需进一步研究。
[1]谭耀红,杨纯正.乳腺癌转移复发肿瘤标志物研究进展[J].国外医学肿瘤分册,2002,29(3):206.
[2]Carmixhael J,DeGraff WG,Gazadar AF,et al.Evaluation of a tetrazolium-based semiautomated colorimetric assay:assessment of chemosensitivity testing[J].Cancer Res,1987,47(4):936.
[3]刘宝,薛妍,慕利梅.姜黄素和阿霉素联合应用对人肝癌细胞SMMC 7721抑制作用的研究[J].肿瘤研究与临床,2000,12:372.
[4]李光耀,谭耀红,杨纯正,等.白血病患者可溶性耐药相关钙结合蛋白基因的表达及其临床意义[J].中华血液学杂志,2002,23:293.
[5]Tan YH,Li GY,Zhao CH,et al.Expression of sorcin predicts poor outcome in acute myeloid leukemia[J].Leuk Res,2003,27(2):125.
[6]林溪,许建华,柯丹如.姜黄素与阿霉素联合用药的体外抗肿瘤作用[J].中国药理学通报,2000,16:522.
[7]杨家荣,杨慧,潘铁军.姜黄素对膀胱肿瘤细胞组织蛋白酶 D表达的影响[J].重庆医学,2008,37(14):1540.
[8]陈忠,章咏裳,李家贵,等.人膀胱癌细胞耐药株多基因蛋白表达的意义[J].中华泌尿外科杂志,1998,19(12):707.
[9]Schuetz EG,Schinkel AH.Drug disposition as determined by the interplay between drugtransporting and drug-metabolizing systems[J].J Biochem Mol Toxicol,1999,13:219.
[10]吴晓健,吴凯南,董蒲江.姜黄素诱导人乳腺癌 MCF-7细胞凋亡的研究[J].重庆医学,2005,34(12):1768.

