磁共振技术在非典型弥漫性轴索损伤诊断中的价值*
夏海坚,孙晓川△,罗天友,方维东,吕发金,郭宗铎,郑履平,唐文渊
(重庆医科大学附属第一医院:1.神经外科;2.放射科 400016)
弥漫性轴索损伤(diffuse axonal injury,DAI)是创伤性脑损伤最常见的损伤类型之一。经典的概念认为DAI常在头颅存在成角及旋转加(减)速运动时产生,以持续昏迷和上脑干损害为主要临床表现,即认为DAI是重型脑伤的一种[1-2]。与此同时,神经外科学界的另外一种观点认为DAI不仅存在于重型脑伤中,也存在于部分中型甚至轻型脑伤中,即有非典型DAI的存在[3-4]。这两种观点的并存给DAI的临床诊断提出了很高要求,但由于DAI缺乏特异的临床表现及体征,经典影像学,包括CT和常规MRI对DAI诊断能力有限[5],加上绝大多数DAI患者不需手术治疗,不便行病理检查,所以临床上一直以来在DAI诊断上存在困难。为此,临床上需要一种敏感而准确的DAI检查手段。本研究将磁共振技术液体衰减反转恢复序列(fluid attenuated inversion recovery,FLAIR)和氢质子MR波谱(1H-M R spectroscopy,1HMRS)应用于临床,旨在探讨其在非典型DAI临床诊断中的价值。
1 临床资料
1.1 一般资料 2002年10月至2008年1月本科收治33例DAI患者和25例非典型DAI患者,共58例患者纳入本项临床研究。全部病例符合以下纳入标准:(1)外伤史明确;(2)有完备的病史资料;(3)病情允许进行MR检查。排除标准:(1)有严重的多发伤;(2)有严重的慢性疾病;(3)伤前有严重的中枢神经系统疾病;(4)病史资料不完整。
DAI组所有病例均符合经典的临床诊断标准[1]:(1)有确切外伤史,尤其是存在成角或旋转加(减)速运动;(2)伤后立即出现昏迷,且昏迷时间超过6h;(3)有瞳孔、眼球位置的改变;(4)神经影像学检查发现DAI特征性表现,即大脑球中线旁白质内或皮质与白质交界处、基底节内囊区域、胼胝体、小脑、脑干背外侧单个或多个出血灶(通常直径小于20mm),或有脑室出血,蛛网膜下腔出血,弥漫性脑肿胀等非特征性表现;(5)颅内压增高的程度与临床病情严重程度不一致;(6)CT无明显改变而临床表现重。
非典型DAI组的纳入标准:(1)外伤史确切;(2)伤后原发昏迷时间不超过6h,或无明显原发昏迷;(3)神经影像学检查在上述脑中线结构发现典型的轴索损伤征象;(4)病史中严格排除心肺等慢性疾病病史及中枢神经系统疾病病史。
58例患者中男40例,女18例,年龄13~62岁,平均 31.1岁;受伤原因:车祸伤36例、坠落伤14例、重物打击伤5例、跌倒伤2例、挤压伤1例;伤后就诊时间:12h内41例、12~24h 12例、48h后 5例。DAI组 33例中,入院Glasgow昏迷评分(Glasgow Coma Scale,GCS):3~5分6例(含最后死亡病例2例)、6~8分22例、9~12分4例、13~ 15分 1例;原发昏迷时间:6h至 3d 5例,3d至3周19例,>3周9例(含死亡病例 2例)。非典型DAI组 25例中,入院GCS评分:6~8分10例、9~12分11例、13~15分 4例;原发昏迷时间:6h内 20例,无确切原发昏迷5例。利用单纯随机抽样法随机选择在本院放射科接受MRI检查没有发现颅内异常的成年人20例作为对照组,其中男8例,女12例,年龄16~68岁,平均 32.3岁。
1.2 影像学检查
1.2.1 设备 使用GE signa M R/I 1.5 T MR成像仪,配备多体素M RS(multi-voxels spectroscopy,M VS)。1HMRS数据处理使用随机配备软件包,使用标准头部线圈作为发射和接收装置。
1.2.2 检查程序 具体程序:(1)患者入院后,按常规进行急诊处理、抢救,根据头颅CT扫描结果及病情,行急诊手术或进行药物治疗。(2)待患者生命体征和意识情况允许,如可以脱离心电监护,脱离呼吸机自主呼吸,可以耐受MR机的噪音和约0.5h的检查时间等,行M RI检查;M RI检查包括横断面和矢状面T1加权像(T1WI,TR 450ms,TE 8~9ms)、T2加权像(T2WI,T R 3 600ms,TE 100ms)和FLAIR序列(TR 10 000 ms,TI 2 500ms,TE 40ms)。(3)行M RI检查同时进行1HMRS检查,其主要步骤:首先确定感兴趣区(volume of interest,VOI),常规扫描结束后,用点解析波谱(Point resolved spectroscopy,PRESS)序列选择轴面侧脑室层面,包含胼胝体膝部、胼胝体压部和双侧基底节的长方形区域作为VOI,避开颅骨,这个区域是DAI损伤灶常见部位(图1);而后匀场、抑水;再用PRESS序列进行数据采集(TR 1 000ms,TE 144ms,激励次数为200次),数据来自VOI中胼胝体膝部、胼胝体压部和基底节(所有病例基底节的指标均来自右侧);1HM RS检测指标包括N-乙酰天门冬氨酸(NAA)、胆碱复合物(Cho)、肌酸和磷酸肌酸(Cr)、肌醇(mINs)及谷氨酸和谷氨酰胺(Glx)。
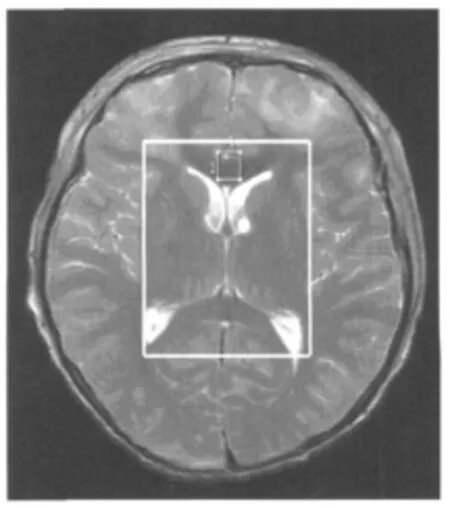
图1 1HMRS感兴趣区的选择
1.3 资料分析及统计学方法
1.3.1 资料分析 观察FLAIR对DAI组及非典型DAI组病例的诊断能力;利用计算机随机配备的软件包自动分析VOI内胼胝体膝部、压部和基底节1HM RS各指标的波峰下面积,计算各指标和Cr波峰下面积的比值,分别以NAA/Cr、Cho/Cr、mINs/Cr和Glx/Cr来代表以上物质在局部的相对含量。
1.3.2 统计学方法 本研究中,所有读片及波谱后期工作站分析分别由本院放射科两位医师在盲法原则下完成,两者结果相同的予以采信。采用SPSS 11.0统计软件。所有数据以表示,采用方差分析进行多个样本均值间的比较(studentnewman-keuls法)。
2 结 果
2.1 FLAIR对轴索损伤的诊断作用 作者的前期实验已经证明,与CT和常规MRI相比,FLAIR能显著提高DAI的临床诊断率和病灶检出率,有助于精确显示损伤范围和程度[6]。DAI组中,FLAIR在其中的29例发现在皮白质交界处、基底节内囊区域、胼胝体、小脑、脑干背外侧等部位有典型的DAI病灶分布,呈长 T1长 T2的 表现,相比之下,常规M RI仅在其中的22例发现有上述表现。另外4例(3例系车祸致伤,另1例系高处坠落致伤)伤后均持续昏迷,CT发现和临床表现不相符合,根据诊断标准考虑DAI,但 FLAIR与常规M RI均未发现典型的DAI表现。非典型DAI组25例均依靠磁共振影像学检查得以诊断。FLAIR于所有25例均在上述中线旁结构发现多个的点状或点片状病灶,与此相比,常规MRI仅在其中的6例发现有类似改变(图2)。非典型DAI组和DAI组影像学表现的唯一区别在于病灶分布范围集中于大脑半球中线旁白质内或皮质与白质交界处及胼胝体等区域,而分布于小脑与脑干的病灶极少。
表1 各组NAA/Cr和Cho/Cr的变化
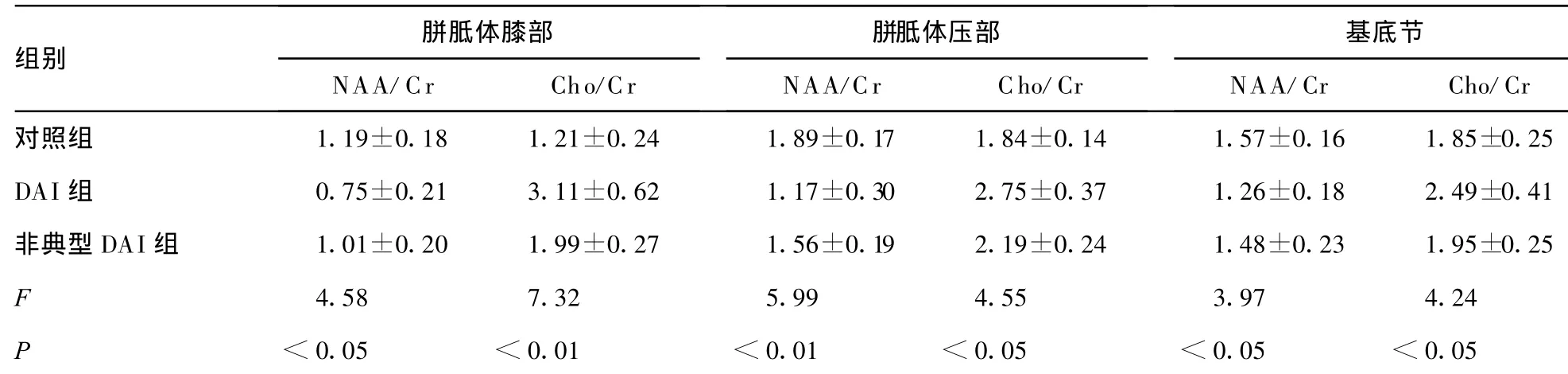
表1 各组NAA/Cr和Cho/Cr的变化
胼胝体膝部 胼胝体压部 基底节组别NAA/Cr Cho/Cr NAA/Cr Cho/Cr NAA/Cr Cho/Cr对照组 1.19±0.18 1.21±0.24 1.89±0.17 1.84±0.14 1.57±0.16 1.85±0.25 DAI组 0.75±0.21 3.11±0.62 1.17±0.30 2.75±0.37 1.26±0.18 2.49±0.41非典型 DAI组 1.01±0.20 1.99±0.27 1.56±0.19 2.19±0.24 1.48±0.23 1.95±0.25 F 4.58 7.32 5.99 4.55 3.97 4.24 P<0.05 <0.01 <0.01 <0.05 <0.05 <0.05
表2 各组mINs/Cr和Glx/Cr的变化
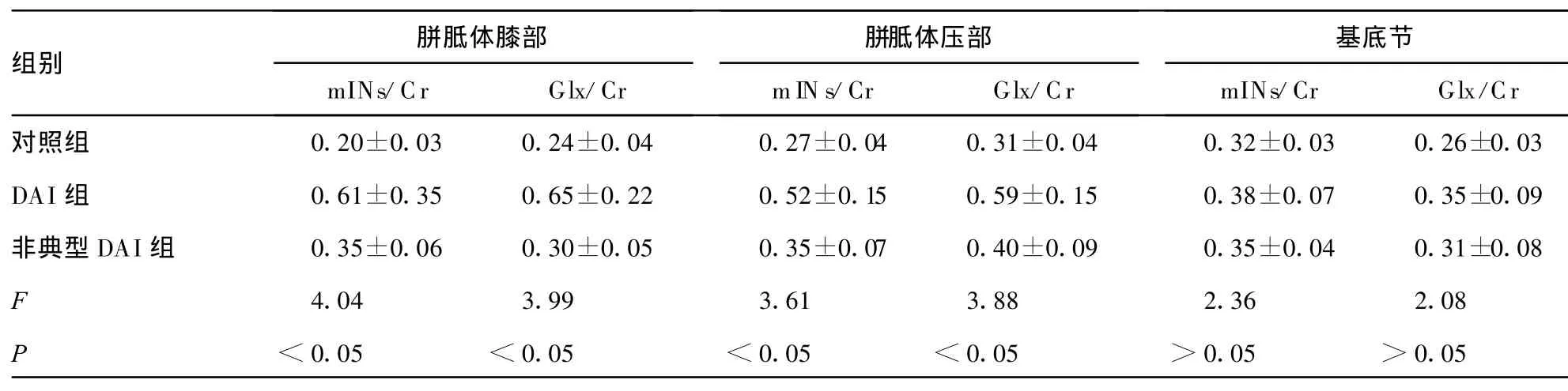
表2 各组mINs/Cr和Glx/Cr的变化
胼胝体膝部 胼胝体压部 基底节组别mINs/Cr Glx/Cr mIN s/Cr Glx/Cr mINs/Cr Glx/Cr对照组 0.20±0.03 0.24±0.04 0.27±0.04 0.31±0.04 0.32±0.03 0.26±0.03 DAI组 0.61±0.35 0.65±0.22 0.52±0.15 0.59±0.15 0.38±0.07 0.35±0.09非典型 DAI组 0.35±0.06 0.30±0.05 0.35±0.07 0.40±0.09 0.35±0.04 0.31±0.08 F 4.04 3.99 3.61 3.88 2.36 2.08 P<0.05 <0.05 <0.05 <0.05 >0.05 >0.05
2.2 DAI组和非典型DAI组1HM RS各指标的比较
2.2.1 DAI组和非典型DAI组 NAA/Cr和 Cho/Cr的比较对照组、DAI组和非典型DAI组胼胝体膝部、压部和基底节NAA/Cr和Cho/Cr差异均有统计学意义(表 1)。和对照组相比,DAI组的胼胝体膝部、压部和基底节有NAA/Cr的显著降低,差异有统计学意义(q=3.54,P<0.05;q=5.39,P<0.01;q=3.27,P<0.05);和非典型DAI组相比,DAI组以上3个观察点的NAA/Cr显著降低,差异有统计学意义(q=3.17,P<0.05;q=3.72,P<0.05;q=3.01,P<0.05);和对照组相比,非典型DAI组的胼胝体膝部和压部有NAA/Cr的显著降低,差异有统计学意义(q=3.76,P<0.05;q=3.83,P<0.05)。和对照组相比,DAI组的胼胝体膝部、压部和基底节的Cho/Cr显著升高,差异有统计学意义(q=8.58,P<0.01;q=3.67,P<0.05;q=3.49,P<0.05);和非典型 DAI组相比,DAI组以上3个观察点Cho/Cr显著升高,差异有统计学意义(q=7.03,P<0.01;q=3.59,P<0.05;q=3.46,P<0.05);和对照组相比,非典型DAI组的胼胝体膝部和压部有Cho/Cr的显著升高,差异有统计学意义(q=3.72,P<0.05;q=3.58,P<0.05)。
2.2.2 DAI组和非典型DAI组mINs/Cr和Glx/Cr的比较对照组、DAI组和非典型DAI组胼胝体膝部和压部mINs/Cr和Glx/Cr差异均具有统计学意义(表2)。和对照组相比,DAI组的胼胝体膝部和压部有mINs/Cr显著升高,差异有统计学意义(q=3.63,P<0.05;q=3.59,P<0.05);和非典型DAI组相比,DAI组以上2个观察点也有mINs/Cr显著升高,差异有统计学意义(q=3.28,P<0.05;q=3.13,P<0.05);和对照组相比,非典型DAI组的胼胝体膝部mINs/Cr显著升高,差异有统计学意义(q=3.55,P<0.05)。和对照组相比,DAI组胼胝体膝部、压部有Glx/Cr显著升高,差异有统计学意义(q=3.35,P<0.05;q=3.24,P<0.05);和非典型DAI组相比,DAI组以上2个观察点有Glx/Cr显著升高,差异有统计学意义(q=3.22,P<0.05;q=3.10,P<0.05);和对照组相比,非典型DAI组各观察点未见Glx/Cr的显著升高。
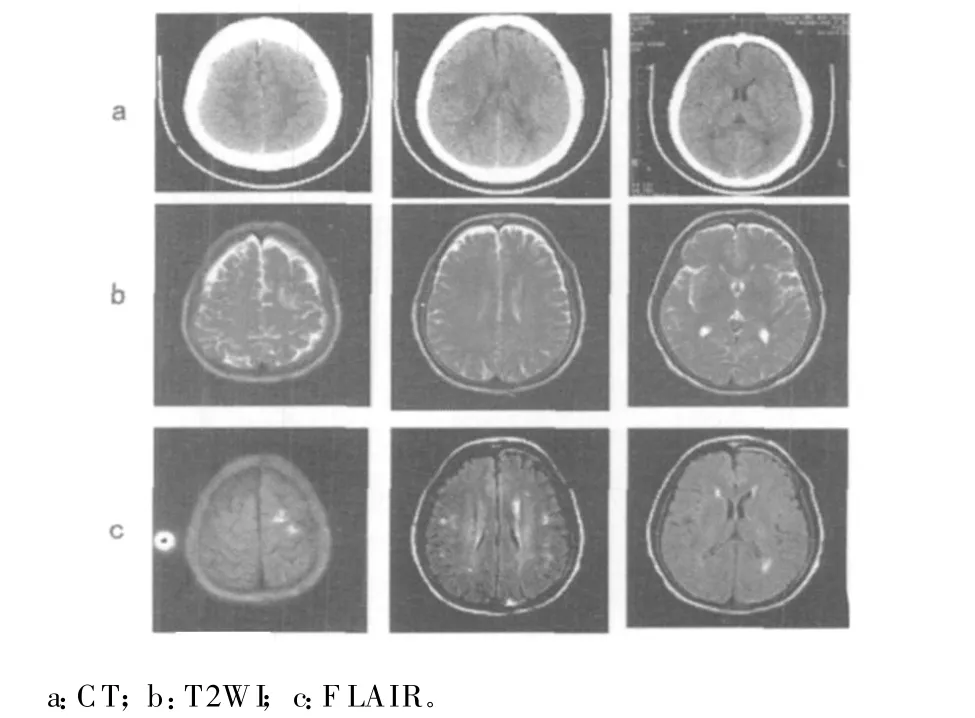
图2 非典型DAI组1例患者(45岁,女性)的大体影像学检查结果
3 讨 论
DAI的诊断是临床难题。因为有约80%是非出血性病灶,所以绝大多数DAI病灶CT不能显示[7],同时由于绝大多数DAI病灶位于中线旁临近脑脊液的结构,如皮质白质交界、侧脑室旁、胼胝体、上脑干背外侧等,容易受到脑脊液的部分容积效应和流动伪影干扰,加之在T2WI上DAI病灶的信号强度和脑脊液信号类似,故常规MRI对DAI的诊断能力也很有限[5]。因此既往临床上诊断DAI常缺乏客观的辅助检查结果,将伤后持续昏迷和上脑干损害症状作为诊断的主要依据,同时也出现了将“CT无明显改变而临床表现重”作为DAI诊断依据之一的尴尬局面。这种情况呼唤更敏感的DAI检查手段的出现。
作者的前期研究已经证明,与CT及常规 M RI相比,FLAIR的DAI诊断率和病灶检出率均显著提高。FLAIR通过抑制脑脊液信号,从而避免了脑脊液产生的部分容积效应及流动伪影干扰,加上FLAIR使用的回波时间更长,使病变与周围组织的对比度显著提高,因而对病灶的敏感性明显提高[6]。本实验DAI组33例中,FLAIR在其中的29例发现有典型的DAI病灶分布,较常规M RI的22例有明显的提高,这提示FLAIR能使绝大多数的DAI获得大体影像学证据。由于非典型DAI,即部分学者所指的轻、中型DAI靠临床表现诊断非常困难,主要依赖影像学提供的直观证据,FLAIR对轴索损伤病灶的高敏感性提示它能够在解剖层面发现大多数的非典型DAI病例。
但是,作为成像手段,FLAIR与CT及常规M RI一样,不能反映损伤灶(区)生化、代谢等病理生理的改变,也不能提供有关与损伤轴索相关的神经元和胶质细胞病理反应的信息[8]。1HMRS的出现有可能在 M RI解剖图像的基础上,一定程度反映脑损伤后脑各个区域功能代谢方面的信息[9]。NAA、Cho、Cr、mINs和 Glx都是人脑的基本生化物质,这些物质在健康成人脑内浓度基本恒定,与年龄无显著相关性;在正常人脑左右半球镜像区的浓度差异无统计学意义;在同一种族的不同性别间差异无统计学意义,是1HMRS应用于DAI临床研究的神经生化基础[9]。有研究表明Cr在人脑不同代谢条件下,尤其在病理条件下分布均匀且含量恒定,故本研究将把Cr作为内标准,计算其他代谢物和Cr波峰下面积的比值来推算此代谢物的含量[9]。
1HM RS在DAI组各检查点的发现与动物实验的神经生化结果相吻合。NAA是神经元和神经系统完整性的重要标志物,DAI患者胼胝体膝部、压部及基底节NAA/Cr的明显降低提示这些部位存在神经元功能障碍或迟发性死亡[10-11];因为胼胝体是神经纤维积聚的地方,所以胼胝体NAA的变化可能反映的是受损神经纤维相应神经元的病理变化。Cho是反映胶质细胞的指标,DAI组上述检查点Cho/Cr的升高提示在这些部位有神经胶质细胞的破坏、增生或炎症的存在[12];DAI的病理学早已证实,胶质细胞增生是DAI的病理特征之一,故1HM RS灵敏而准确地反映了DAI后脑局部的病理变化;而mINs/Cr的升高进一步说明胶质细胞增生是轴索损伤灶Cho/Cr升高的主要原因[12]。Glx中的谷氨酸是兴奋性氨基酸(EAA)的重要成分之一,目前大量研究表明EAA的过量释放在创伤后继发性脑损害中起重要作用[13],DAI组Glx的升高证实胼胝体部位有谷氨酸的过量释放。
非典型DAI组病例在胼胝体两个检查点的1HMRS结果和DAI组类似,表现为NAA/Cr降低和 Cho/Cr升高,在膝部更有mINs/Cr的升高,这提示该组病例在伤后于胼胝体也存在和DAI组病例类似的病理变化。至于在胼胝体呈现上述结果,而在基底节没有,这估计和胼胝体易受旋转加(减)速暴力损伤有关,文献报道胼胝体是最易受DAI损害的解剖部位之一[1-2]。非典型DAI组 NAA、Cho和mINs的变化程度较 DAI组弱提示在上述部位的原发和继发性神经损害没有DAI组明显,这和非典型DAI组临床表现轻的特点相符,同时其在胼胝体部位无Glx的显著升高进一步证实了这一点。
至于DAI组表现有持续的原发昏迷,而非DAI组欠缺,作者考虑和网状上行激动系统的损害与否有关。人意识的维持和网状上行激动系统有重要关系,其中中脑在此系统中又扮演了极重要角色。和DAI组相比,在非典型DAI组FLAIR发现的间脑水平以下的病灶极少,和DAI组有明显区别,这提示非典型DAI组病例在形态上无明显上脑干损害,即无明显网状上行激动系统的损害。这和文献报道相符,原发昏迷的时间和程度与脑干轴索损伤的范围和程度有关,与脑干以外区域的轴索损伤无明显关系[14]。另外,新近认为,DAI后的持续昏迷也和脑干网状上行激动系统的信号不能在丘脑的核团中放大有关,DAI后患者的丘脑有不同程度的萎缩[15],本实验DAI组基底节1HM RS指标NAA/Cr和Cho/Cr的变化也提示了这一点。
综上所述,通过FLAIR的形态影像学结果和1HMRS的活体神经生化检查结果,本实验发现非典型DAI组和DAI组不仅存在类似的病灶形态及分布,更在胼胝体存在类似的生化代谢改变;两者的区别在于轴索损害波及范围的不同,以及病理损害程度的不同。因此,作者认为,DAI不仅是重型脑伤的一种,它也存在于轻、中型脑伤中,磁共振技术在诊断非典型DAI中有很大价值。
[1]Adams JH,Graham DI,Gennarelli TA,et al.Diffuse axonal injury in non-missile head injury[J].J Neurol Neurosurg Psychiatry,1991,54(6):481.
[2]Gennarelli TA.Mechanisms of brain injury[J].J Emerg Med,1993,11(Suppl 1):5.
[3]陈洪,吴耀晨,陈建良,等.脑震荡病理机制探讨[J].中华神经外科杂志,1999,15(4):230.
[4]Smith DH,Meaney DF,Shull WH.Diffuse axonal injury in head trauma[J].J Head Trauma Rehabil,2003,18(4):307.
[5]Besenski N.Traumatic injuries:imaging of head injuries[J].Eur Radiol,2002,12(6):1237.
[6]Xia HJ,Sun XC,Tang WY,et al.Diagnostic value of fluid attenuated inversion recovery versus T2-weighted image in diffuse axonal injury[J].Neural Regen Res,2008,3(7):747.
[7]Gentry LR.Imaging of closed head injury[J].Radiology,1994,191(1):1.
[8]张冬,邹利光,文利,等.M RI弥散加权成像对胶质瘤分级的临床价值[J].重庆医学,2008,37(14):1557.
[9]Salibi N,Brown M A.Clinical M R spectroscopy:first principles[M].New York:Wiley-Liss Inc,1998.
[10]Serles W,Li LM,Antel SB,et al.Time course of postoperative recovery of N-acetyl-aspartate in temporal lobe epilepsy[J].Epilepsia,2001,42(2):190.
[11]王怡,黎海涛,李露斯,等.特发性全面性强直阵挛发作癫痫磁共振波谱改变的临床意义[J].重庆医学,2007,36(17):1739.
[12]Siger-Zajdel M,Selmaj KW.Proton magnetic resonance spectroscopy of normal appearing white matter in familial and sporadic multiple sclerosis[J].J Neurol,2005,252(7):830.
[13]Suma T,Koshinaga M,Fukushima M,et al.Effects of in situ administration of excitatory amino acid antagonists on rapid microglial and astroglial reactions in rat hippocampus following traumatic brain injury[J].Neurol Res,2008,30(4):420.
[14]Smith DH,Nonaka M,Miller R,et al.Immediate coma following inertial brain injury dependent on axonal damage in the brainstem[J].J Neurosurg,2000,93(2):315.
[15]Admas JH,Graham DI,Jennett B.The neuropathology of the vegetative state after an acute brain insult[J].Brain,2000,(Pt 7):327.

